6 种中药注射液联合SOX 化疗方案治疗胃癌的网状Meta 分析
2019-01-25吉跃进李红晓陆为民
吉跃进, 李红晓, 陆为民∗
(1. 南京中医药大学附属医院, 江苏 南京210029; 2. 南京中医药大学医学与生命科学学院, 江苏 南京210023)
胃癌是世界上常见的恶性肿瘤之一, 为导致癌症相关性死亡的重要因素。 就全球而言, 男性发病率通常是女性的2 倍, 而且各国差异很大[1], 2012年全球发病数为95.1 万例(占总数的6.8%), 其中半数发生在东亚(主要在中国)[2]; 2015 年, 肺癌、 胃癌、 肝癌、 食管癌、 结直肠癌占中国所有癌症相关性死亡的75%[3]。
替吉奥作为一种新型氟尿嘧啶衍生物口服抗癌剂, 于1999 年在日本被批准用来治疗晚期胃癌,并于2009 年在中国上市, 因其能维持较高血药浓度、 增强抗癌活性、 减少药物毒性、 给药便捷等优点被广泛应用于临床。 替吉奥联合奥沙利铂(SOX) 方案是目前晚期胃癌最常用的化疗方案之一[4], 武惠丽等[5]研究表明, SOX 化疗方案的疗效略优于奥沙利铂联合氟尿嘧啶(FOLFOX)、 奥沙利铂联合卡培他滨(XELOX) 方案, 而且不良反应相对较低; 黄客增等[6]报道, 与表柔比星联合顺铂及氟尿嘧啶(ECF) 方案相比, SOX 化疗方案对胃癌根治术患者的化疗效果更佳, 随着该方案广泛使用, 其优越性逐渐体现出来, 但不良反应依然不可忽视。
目前, 中药注射液联合化疗治疗胃癌已得到国内外广泛关注, 在改善临床症状、 提高生存质量、减轻放化疗毒副作用、 延长生存期等方面具有明显优势, 杨旭平等[7-10]指出它在提高临床疗效及安全性方面的作用值得肯定。 本研究引入网状Meta 分析, 在SOX 化疗方案基础上同时比较3 种或3 种以上中药注射液辅助治疗胃癌的临床疗效及安全性, 遴选出最优治疗方案, 为相关临床决策提供参考。
1 材料
1.1 研究类型 国内外公开发表的随机对照试验,无论是否采用盲法。
1.2 研究对象 符合经胃镜联合病理活检确诊的胃癌患者, 年龄、 性别不限。
1.3 干预措施 对照组均采用SOX 化疗方案, 治疗组在对照组基础上加用中药注射液。
1.4 结局指标 ①疗效评价[11]: 采用WHO 实体瘤评价标准或RECIST 1.0 标准纳入的研究, 包括完全缓解、 部分缓解、 疾病稳定、 疾病进展4 个等级, 有效率= [(完全缓解数+部分缓解数) /总例数] ×100%; ②生活质量指数[12]: 参照KPS 评分标准, 较治疗前增加≥10 分为提高, 增加或减少<10 分为稳定, 降低≥10 分为降低, 改善率=提高例数/总例数×100%; ③安全性评价: 按照WHO化疗药物毒性反应分度标准Ⅰ~Ⅳ级的不良反应发生率, 主要包括白细胞减少、 恶心呕吐、 肝损伤及周围神经毒性等四个方面; ④无进展生存期(PFS): 肿瘤患者接受治疗至疾病进展或死亡时的时间; ⑤中位生存期(MST): 当累积生存率为0.5 时所对应的生存时间[13]。
1.5 排除标准 ①非随机对照试验或半随机对照试验, 如综述、 系统评价、 病例报道、 疾病证型限定、 按入院顺序随机等; ②非临床试验, 如动物、细胞实验等; ③中药注射液非静脉使用, 如灌肠、腹腔灌注、 穴位注射等; ④中药注射液剂型不符,如片剂、 胶囊等; ⑤无本研究结局指标或无法提取有效数据; ⑥研究对象合并其他肿瘤者, 如食管癌、 结直肠癌等; ⑦其他干扰治疗者, 如放疗、 中药煎剂口服等; ⑧重复文献, 选取时间较早的1 篇。
2 方法
2.1 检索策略 检索Pubmed、 Embase、 The Cochrane Library、 Wed of science、 中国知网、 万方数据库、 维普、 中国生物医学文献数据库, 检索策略以“中药注射液及其相关自由词+胃癌及自由词+替吉奥及自由词” 的方式进行构建, 检索时间为建库至2018 年3 月31 日。
2.2 文献筛选及资料提取 由2 名研究人员根据纳入、 排除标准分别独立进行文献筛选, 并交叉核对, 如有分歧, 则加入第3 名研究人员讨论解决。文献筛选完成后, 根据作者、 发表时间、 分配方法、 肿瘤分期、 病例数、 干预措施、 周期、 结局指标等方面将数据分别提取。
2.3 质量评价 采用Cochrane 推荐的“偏倚风险评估工具” 进行质量评价, 主要项目有7 个, 包括随机序列产生、 分配方案隐藏、 对研究参与者采用盲法、 结局指标的盲法评价、 结果数据的完整性、 选择性报告、 其他偏倚。
2.4 统计学分析 首先, 通过Stata14.0 软件进行异质性检验及生存数据的Meta 分析, 若P>0.1 且I2≤50%, 表明各研究间具有同质性或异质性较小, 采用固定效应模型, 并在一致性模型下进行网状Meta 分析; 若P<0.1 或I2>50%, 表明各研究间异质性较大, 查找分析其来源, 采用随机效应模型, 并在不一致性模型下进行网状Meta 分析。 然后, 通过ADDIS 1.16.8 软件进行网状Meta 分析[14], 以P<0.05 和95%CI (不包括1) 作为有统计学差异的标准; 计数资料应用比值比OR 及其95%CI 表示效应量, 并绘制各干预措施的网状关系图和排序图。 有效率、 生活质量改善率、 无进展生存期、 中位生存期归为有益结局, 概率排序在Rank 1 最好, Rank N 最差; 白细胞减少、 恶心呕吐、 肝损伤、 周围神经毒性归为不利结局, 概率排序Rank N 最好, Rank 1 最差。 ADDIS 软件主要采用潜在的标尺缩减参数(PSRF) 来评价结果收敛性, 当PRSF 接近或等于1 时, 表明结果有很好的收敛效能, 分析可信度高。
3 结果
3.1 文献检索 初检得到文献369 篇, 其中CNKI 57 篇、 VIP 63 篇、 万 方117 篇、 CBM 46 篇、PubMed 25 篇、 Embase 42 篇、 Web of science 9 篇、Cochrane Library 10 篇、 手工检索0 篇, 经NoteExpress 文献管理软件剔除重复文献137 篇, 阅读题目和综述后排除文献159 篇, 初步纳入30 篇, 再通过阅读全文剔除不适合文献, 最终纳入22 篇,均为公开发表。 流程见图1。
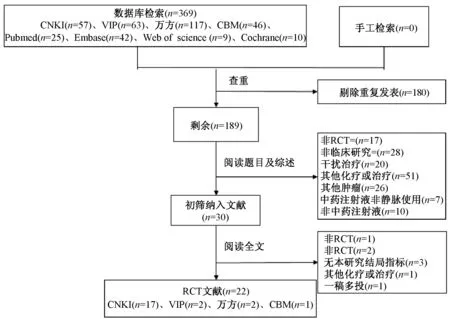
图1 文献检索与筛选流程Fig.1 Literature retrieval and screening process
3.2 基本特征 共纳入22 项随机对照试验, 包含6 种中药注射液, 分别为艾迪注射液(6 篇)、 参芪扶正注射液(6 篇)、 消癌平注射液(4 篇)、 康艾注射液(3 篇)、 康莱特注射液(2 篇)、 复方苦参注射液(1 篇); 共纳入病例数1 419 例, 其中治疗组722 例, 对照组697 例; 所有纳入文献中治疗组均为中药注射液+SOX 化疗方案, 对照组均为单用SOX 化疗方案; 20 项研究以有效率为结局指标, 9 项研究报道了KPS 评分, 14 项研究报道了白细胞减少, 12 项研究报道了恶心呕吐, 9 项研究报道了肝损害, 15 项研究报道了周围神经毒性, 5项研究报道了PFS, 7 项研究报道了MST。 见表1。
3.3 质量评价 所有研究均提出随机分配, 但均未实施盲法, 其中9 项为随机数表法, 1 项[26]为信封法随机, 仅有2 项[26,28]对随机方法进行具体描述; 10 项描述随访情况; 2 项[19,22]未对主要结局指标有效率进行报道。 然后, 根据Cochrane 推荐的“偏倚风险评估工具” 对纳入研究进行质量评价, 结果见图2。

图2 纳入研究质量评价Fig.2 Quality evaluation of included studies
3.4 网状Meta 分析 所有研究均为中药注射液联合SOX 化疗方案与单用SOX 化疗方案的直接比较, 并均为双臂(总臂数为44), 干预措施关系见图3。 各研究结局指标PSRF 均<1.02, 表明收敛性良好, 分析可信度高。

图3 纳入研究干预措施关系Fig.3 Relationships of intervention measures in included studies
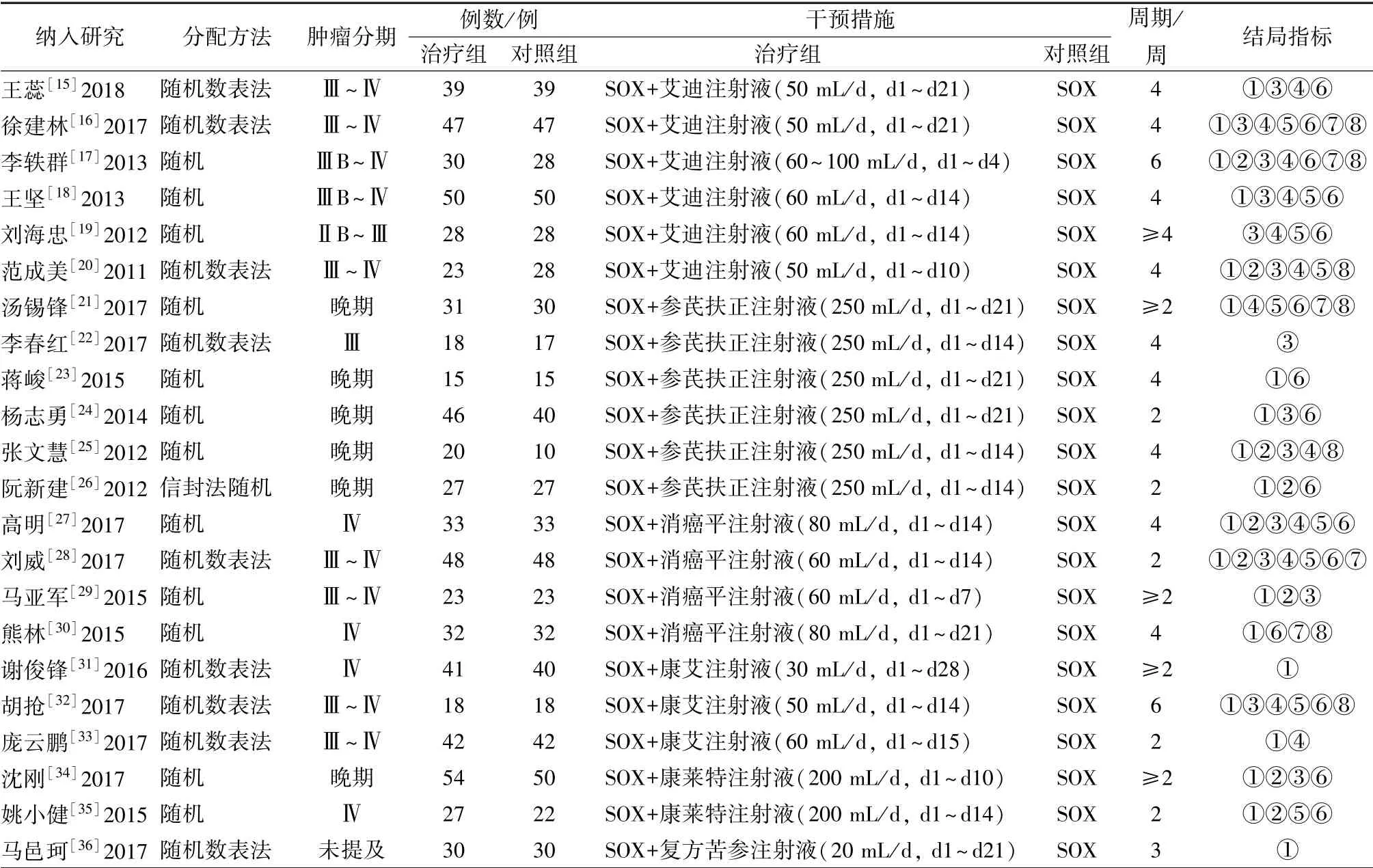
表1 纳入研究基本特征Tab.1 Basic characteristics of included studies
3.4.1 有效率 20 项研究报道了有效率, 包括艾迪注射液、 参芪扶正注射液、 复方苦参注射液、 康艾注射液、 康莱特注射液、 消癌平注射液。 异质性检验(表2) 显示, 中药注射液联合SOX 化疗方案较单用SOX 化疗方案的组内研究间异质性较小,故采用一致性模型进行网状Meta 分析(表3)。结果显示, 与单用SOX 化疗方案比较, 艾迪注射液+SOX、 参芪扶正注射液+SOX、 康艾注射液+SOX、复方苦参注射液+SOX 差异有统计学意义, 其余无统计学意义, 并且6 种联合用药两两比较差异也无统计学意义。 Rank 1 ~7 概率排序显示, 复方苦参注射液+SOX(50%) >康艾注射液+SOX (35%) >参芪扶正注射液+SOX (27%) >艾迪注射液+SOX(27%) >消癌平注射液+SOX (26%) >康莱特注射液+SOX (20%) >SOX (88%)。
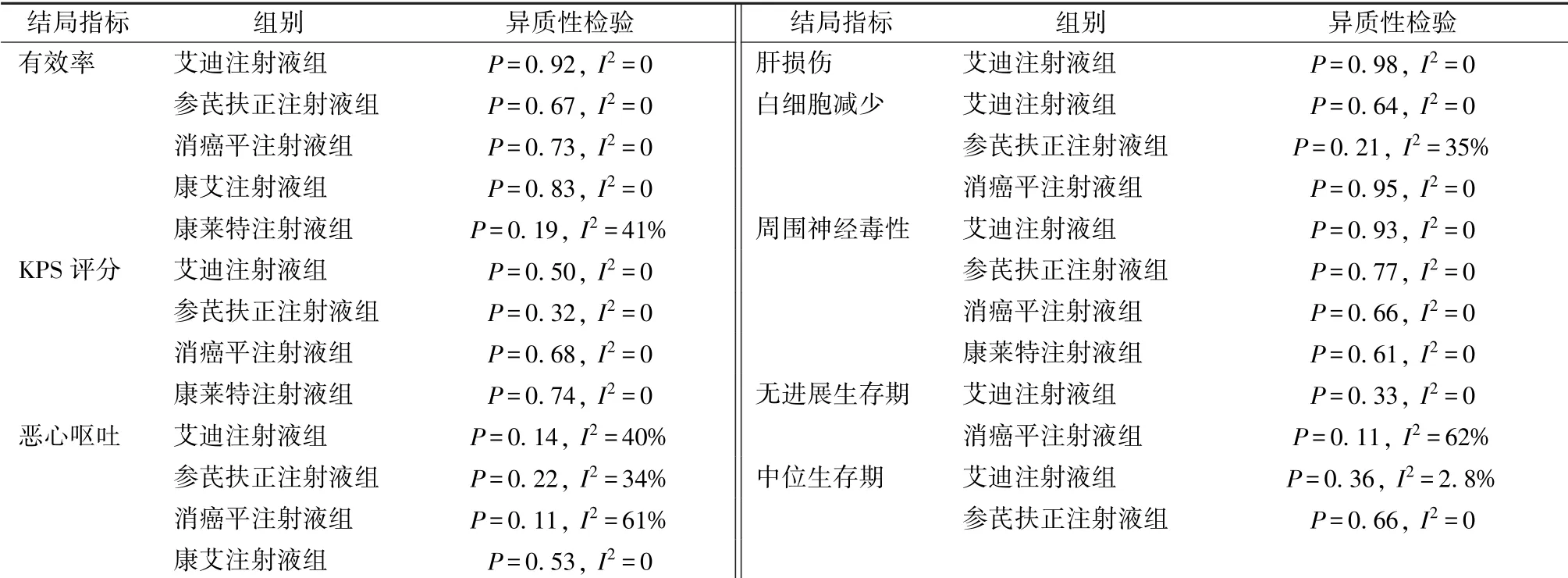
表2 纳入研究异质性检验结果Tab.2 Results of heterogeneity tests for included studies
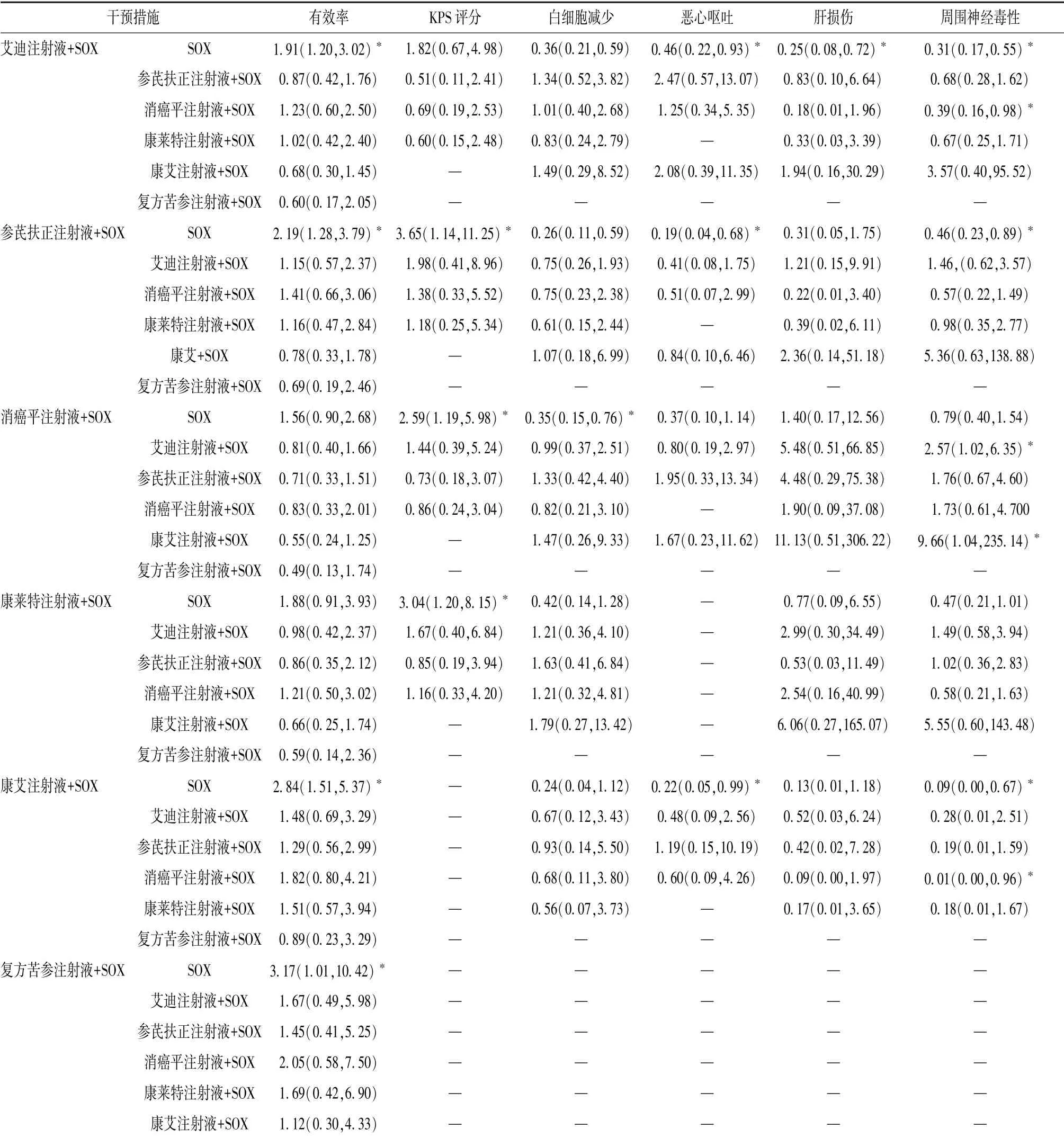
表3 网状Meta 分析结果[OR (95%CI)]Tab.3 Results of network Meta-analysis[OR (95%CI)]
3.4.2 生活质量改善率 9 项研究报道了生活质量改善率, 包括艾迪注射液、 康艾注射液、 参芪扶正注射液、 消癌平注射液。 异质性检验(表2) 显示, 中药注射液联合SOX 化疗方案较单用SOX 化疗方案的组内研究间具有同质性, 故采用一致性模型进行网状Meta 分析(表3)。结果显示, 与单用SOX 化疗方案比较, 参芪扶正注射液+SOX、 消癌平注射液+SOX 差异有统计学意义, 其余无统计学意义, 并且4 种联合用药两两比较差异也无统计学意义。 Rank 1~5 概率排序显示, 参芪扶正注射液+SOX(49%) >康莱特注射液+SOX(34%) >消癌平注射液+SOX(37%) >艾迪注射液+SOX(49%) >SOX (86%)。
3.4.3 白细胞减少 14 项研究报道了白细胞减少, 包括艾迪注射液、 参芪扶正注射液、 消癌平注射液、 康莱特注射液、 康艾注射液。 异质性检验(表2) 显示, 中药注射液联合SOX 化疗方案较单用SOX 化疗方案的组内研究间异质性较小, 故采用一致性模型进行网状Meta 分析(表3)。结果显示, 与单用SOX 化疗方案比较, 艾迪注射液+SOX、 参芪扶正注射液+SOX、 消癌平注射液+SOX差异有统计学意义, 其余无统计学意义, 并且5 种联合用药两两比较差异也无统计学意义。 Rank 6 ~1 概率排序显示, 康艾注射液+SOX (44%) >参芪扶正注射液+SOX (31%) >艾迪注射液+SOX(29%) >消癌平注射液+SOX (26%) >康莱特注射液+SOX (37%) >SOX (91%)。
3.4.4 恶心呕吐 12 项研究报道了恶心呕吐, 包括艾迪注射液、 参芪扶正注射液、 消癌平注射液、康艾注射液。 异质性检验(表2) 显示, 消癌平注射液+SOX 组内研究间异质性较大(P =0.11, I2=61%), 故采用不一致性模型进行网状Meta 分析(表3)。结果显示, 与单用SOX 化疗方案比较,艾迪注射液+SOX、 参芪扶正注射液+SOX、 康艾注射液+SOX 差异有统计学意义, 其余无统计学意义, 并且4 种联合用药两两比较差异也无统计学意义。
3.4.5 肝损伤 9 项研究报道了肝损伤, 包括艾迪注射液、 参芪扶正注射液、 消癌平注射液、 康莱特注射液、 康艾注射液。 异质性检验(表2) 显示, 中药注射液联合SOX 化疗方案较单用SOX 化疗方案的组内研究间具有同质性, 故采用一致性模型进行网状Meta 分析(表3)。结果显示, 与单用SOX 化疗方案比较, 艾迪注射液+SOX 差异有统计学意义, 其余无统计学意义, 并且5 种联合用药两两比较差异也无统计学意义。 Rank 6 ~1 概率排序显示, 康艾注射液+SOX (61%) >艾迪注射液+SOX (41%) >参芪扶正注射液+SOX (33%) >康莱特注射液+SOX (29%) >SOX (51%) >消癌平注射液+SOX (53%)。
3.4.6 周围神经毒性 15 项研究报道了周围神经毒性, 包括艾迪注射液、 参芪扶正注射液、 消癌平注射液、 康莱特注射液、 康艾注射液。 异质性检验(表2) 显示, 中药注射液联合SOX 化疗方案较单用SOX 化疗方案的组内研究间具有同质性, 故采用一致性模型进行网状Meta 分析(表3)。结果显示, 与单用SOX 化疗方案比较, 艾迪注射液+SOX、 参芪扶正注射液+SOX、 康艾注射液+SOX 差异有统计学意义, 其余无统计学意义; 艾迪注射液+SOX、 康艾注射液+SOX 显著优于消癌平注射液+SOX, 其余无统计学意义。 Rank 6 ~1 概率排序显示, 康艾注射液+SOX (85%) >艾迪注射液+SOX(59%) >参芪扶正注射液+SOX (36%) >康莱特注射液+SOX(36%)>消癌平注射液+SOX(52%) >SOX (72%)。
3.4.7 无进展生存期 5 项研究报道了无进展生存期, 包括艾迪注射液、 参芪扶正注射液、 消癌平注射液。 异质性检验(表2) 显示, 消癌平注射液+SOX 组内研究间异质性较大(P =0.11, I2=62%),其余异质性较小, 由于数据缺失, 联系作者后仍无法获取标准差, 故只能进行生存数据Meta 分析。结果显示, 艾迪注射液+SOX、 消癌平注射液+SOX、 参芪扶正注射液+SOX 的无进展生存期分别是对照组的1.184、 1.196、 1.422 倍, 差异有统计学意义[P =0.037, 95%CI (1.010, 1.388); P =0.024, 95%CI (1.024, 1.396); P =0.006, 95%CI (1.106, 1.828) ]。
3.4.8 中位生存期 7 项研究报道了中位生存期,包括艾迪注射液、 参芪扶正注射液、 消癌平注射液、 康艾注射液。 异质性检验(表2) 显示, 中药注射液联合SOX 化疗方案较单用SOX 化疗方案的组内研究间异质性较小, 由于数据缺失, 联系作者后仍无法获取标准差, 故只能进行生存数据Meta分析。结果显示, 艾迪注射液+SOX、 参芪扶正注射液+SOX、 康艾注射液+SOX 的中位生存期分别是对照组的1.224、 1.406、 1.467 倍, 差异有统计学意义[P =0.004, 95%CI (1.066, 1.404); P =0.001, 95%CI (1.145, 1.726); P =0.022, 95%CI (1.058, 2.033) ]; 消癌平注射液+SOX 的中位生存期是对照组的1.202 倍, 差异无统计学意义[P =0.141, 95%CI (0.941, 1.536) ]。
4 讨论
网状Meta 分析显示: ①有效率方面, 复方苦参注射液成为最佳措施的概率最大; ②生存质量方面, 参芪扶正注射液成为最佳措施的概率最大; ③白细胞减少、 肝损害、 周围神经毒性等不良反应方面, 康艾注射液成为最佳措施的概率最大; ④恶心呕吐方面, 艾迪注射液、 参芪扶正注射液、 康艾注射液能改善相关症状; ⑤两两比较方面, 艾迪注射液、 康艾注射液在改善周围神经毒性方面均优于消癌平注射液, 其余两两比较差异均无统计学意义。生存数据Meta 分析显示, 艾迪注射液、 参芪扶正注射液均能延长无进展生存期和中位生存期, 消癌平注射液能延长前者, 康艾注射液能延长后者。
然而, 本研究仅纳入6 种中药注射液, 尚未纳入其他品种, 无法将其联合SOX 化疗方案治疗胃癌的有效性及安全性进行间接比较。 仅有1 项研究[36]报道了复方苦参注射液; 在白细胞减少、 肝损害、 周围神经毒性、 中位生存期等结局指标下,康艾注射液均只有1 项研究[32]被纳入; 在无进展生存期方面, 仅有5 项研究[16-17,21,28,30]纳入, 包括3 种中药注射液。 纳入研究数量不足, 增加了偶然性, 从而降低最终结果的稳定性和可靠性。
质量评价结果显示, 纳入研究均属中低质量随机对照试验, 其中12 项未提及随机数列的产生方法, 19 项未对分配方法进行详细说明; 所有研究均未对参与者实施盲法, 在实施过程中容易受到干扰; 所有研究均未对评价者实施盲法, 容易受阳性结果易发表等观念的影响, 对结果评价缺乏客观性; 12 项研究未明确提及随访/失访, 不能排除结局数据缺失可能。 有效率为最主要的结局指标, 纳入研究中有2 项[19,22]未作报道, 不能排除选择性报道可能; 所有研究均在不同医疗中心进行, 患者身体素质、 医疗水平、 医生能力等方面存在不同程度差异, 均可能导致偏倚产生。
在恶心呕吐、 无进展生存期2 个结局指标中,消癌平注射液组内研究间异质性均较大, 涉及的3项研究[27-28,30]均采用相同评价标准和统计学方法,分析其异质性来源发现, 高明等[27,30]均为胃癌Ⅳ期, 刘威等[28]为胃癌Ⅲ~Ⅳ期; 高明等[27,30]均采用随机, 但具体方法未描述, 刘威等[28]采用随机数表法, 并描述了具体方法; 高明等[27,30]均为4个治疗周期, 刘威等[28]为2 个治疗周期; 高明等[27,30]均为80 mL/d 剂量, 刘威等[28]为60 mL/d剂量。 从目前所得资料来看, 肿瘤分期、 分配方法、 治疗周期、 剂量是异质性的主要来源, 但实际操作中参与者主观意识、 实验客观条件等方面也均有可能是其来源。
本研究发现, 消癌平注射液在肝损伤方面成为最佳措施的概率最小, 并低于单用SOX 化疗方案;消癌平注射液中有2 项研究[27-28]以肝损伤为结局指标, 其中高明等[27]研究表明2 组均无明显肝损伤的发生, 刘威等[28]发现治疗组和对照组肝损伤发生例数分别为4、 3 例, 且均为Ⅰ度。 检索文献发现, 消癌平注射液并不能增加肝损害发生率[37-39]; 但李妮等[40]报道消癌平注射液联合化疗在肝损伤方面优于单纯化疗。 异质性分析表明, 2项研究[27-28]可能是异质性主要来源, 加上纳入文献过少, 样本量小, 所得结果缺乏足够的稳定性及可靠性, 须谨慎对待。
综上所述, 6 种中药注射液联合SOX 化疗方案治疗胃癌时, 在提高有效率、 改善生存质量、 降低不良反应发生率、 延长中位生存期和无进展生存期等方面均能取得更好的临床疗效。 但限于本研究纳入文献偏少, 方法学质量不高, 今后有待更多前瞻性、 高质量、 大样本、 多中心随机对照试验证实。
