白花蛇舌草-半枝莲药对乙酸乙酯组分对破骨细胞分化的抑制作用
2019-01-25章丹丹
徐 元, 陈 龙, 章丹丹∗
(1. 上海中医药大学交叉科学研究院, 上海201203; 2. 上海中医药大学科技实验中心分析测试室, 上海
201203)
风湿性关节炎、 慢性病毒感染、 肿瘤等疾病的发展过程中都伴有骨密度减少、 破骨细胞异常活化[1-3], 同时乳腺癌、 肺癌、 前列腺癌晚期常见骨转移, 其一旦发生将伴发病理性骨折、 脊髓压迫、疼痛等, 降低患者生活质量, 甚至危及生命[4]。破骨细胞的分化依赖成骨细胞产生的核因子-κB 受体活化因子配体(RANKL) 与破骨细胞前体细胞膜上的核因子κB 受体活化因子(RANK) 相互作用活化, 两者结合后促进骨吸收, 并抑制破骨细胞凋亡[5]。
中医药在干预乳腺癌等肿瘤中, 不仅可抑制肿瘤生长, 在转移环节还具有延缓骨转移发生及减少溶骨性损伤的作用。 中医认为, 肿瘤属于“岩证”“恶核” “石瘕” “石疽” 等范畴, 清热解毒、 活血化瘀、 扶正祛邪、 软坚散结、 化痰祛湿等是中医治疗肿瘤的常用方法[6]。 白花蛇舌草味甘、 淡,性凉, 具有清热解毒、 利尿消肿、 活血止痛之功效[7]; 半枝莲味辛、 苦, 性寒, 具有清热解毒、散瘀活血之功效[8], 两者均为清热解毒药, 临床上常相须为用以治疗各种炎症、 肿瘤等。 现代药理研究表明, 两者提取物或所含成分对结直肠癌、 肝癌、 膀胱癌等均具有抑制作用[9-11], 也是乳腺癌治疗的核心药对[12], 但尚未开展其对破骨细胞分化及肿瘤骨转移的研究。 前期预实验对白花蛇舌草-半枝莲药对不同配比提取物及其不同极性组分进行活性导向的追踪分离, 发现等比提取的乙酸乙酯组分抑制体外破骨细胞分化活性最强, 故本实验基于RANKL 诱导RAW264.7 细胞分化作为破骨细胞模型, 探讨该组分抑制破骨细胞分化的机制, 为其临床治疗肿瘤骨转移或其他骨性疾病提供参考。
1 材料
1.1 试药 白花蛇舌草(批号050815)、 半枝莲(批号050621) 饮片购自上海养和堂药业连锁经营有限公司, 经上海市食品药品检验所专家鉴定为正品(报告书编号20080338、 20080337)。 对羟基苯乙酮、 野黄芩苷、 木犀草素、 芹菜素由上海中医药大学中药学院中药化学课题组提供, 含有量均>98%。 小鼠巨噬细胞株RAW264.7 购自美国ATCC公司; RPMI-1640 培养基干粉购自美国Gibco 公司; 胎牛血清购自美国HyClone 公司; 噻唑蓝(MTT)、 二甲基亚砜(DMSO)、 Trizol RNA 提取试 剂、 HighCapacity cDNA Reverse Transcription Kits、 miR-155 引 物 套 装 及 TaqMan Small RNA Assays 购自美国Life Technologies 公司; RealMaster-Mix SYBR Green 试剂盒购自美国罗氏公司;RANKL 购自美国Peprotech 公司; PVDF 膜购自美国Millipore 公司; BCA 蛋白浓度测定试剂盒、 抗酒石酸酸性磷酸酶检测试剂盒购自上海碧云天生物技术有限公司; 抗酒石酸酸性磷酸酶(TRAP) 染色试剂盒购自美国Sigma 公司; RANK、 肿瘤坏死因子受体相关因子6 (TRAF6)、 活化T 细胞核因子cl (NFATc1)、 组织蛋白酶K 抗体购自美国Santa Cruz 公司; 引物由生工生物工程(上海) 股份有限公司合成。 其他溶剂均为分析纯, 购自国药集团化学试剂有限公司。
1.2 仪器 Delta Series 生物安全柜 (美国Labconco 公司); CO2培养箱、 高分辨质谱仪(美国Thermo 公司); 倒置显微镜(日本Olympus 公司); Centrifuge 5810R 低温高速离心机(德国Eppendorf 公司); Cellometer Auto T4 全自动细胞计数仪(美国Nexcelom 公司); Spectra MAX190 酶标仪(美国MD 公司); QB-9006 恒温微孔板快速振荡器(海门市其林贝尔仪器有限公司); 7500Fast System荧光定量PCR 仪(美国Applied Biosystems 公司);PowerPacTMHC 电 泳仪 (美国Bio-Rad 公司);Tanon NIM2045 凝胶成像系统(上海天能科技有限公司); UPLC (美国Waters 公司)。
2 方法
2.1 白花蛇舌草-半枝莲药对乙酸乙酯组分(YDW11) 制备及成分鉴定 白花蛇舌草、 半枝莲以1 ∶1 比例加水提取, 取适量浸膏溶于蒸馏水中,乙酸乙酯萃取, 即得相应组分。
取适量YDW11 溶于DMSO 溶液中, 离子源喷雾电压正、 负离子模式下分别为3.5、 3.2 kV; 毛细管温度350 ℃; 鞘气、 辅助气体积流量35、15 arb (1 arb =0.3 L/min); 反 吹 气 体 积 流 量1 arb; 离子源雾化温度300 ℃。 S-Lens 级别60;离子检测方式全扫描(Full Scan), 分辨率60 000。二级采用10 个峰的DDA 检测模式(数据依赖分析模式); 分辨率15 000; 碰撞能35 eV; 动态排除时间10 s。
YDW11 以5 mg/mL 质量浓度溶于甲醇中进行UPLC 分析, 条件为Waters Acquity UPLC HSS T3色谱柱; 流动相乙腈-0.1%甲酸; 柱温40 ℃。
2.2 YDW11 对细胞活力的影响 RAW264.7 细胞以1×104/100 μL 密度接种于96 孔板中, 培养过夜, 设 置 对 照 组、 模 型 组、 YDW11 组 (25、50 μg/mL), 刺激处理24 h 后弃去上清, 每孔加入RPMI 1640 100 μL、 MTT (PBS 溶解为5 g/L)10 μL, 继续培养4 h 后弃去上清, 加入100 μL DMSO, 置于摇床上至结晶完全溶解, 酶标仪读取490 nm 下 吸 光 度, 以 对 照 组 为100%, 计 算YDW11 对细胞活力的影响。 每组设3 个复孔, 实验重复3 次。
2.3 YDW11 对阳性多核细胞数的影响 RAW264.7 细胞在10%FBS1640 条件下以10 000/孔培养于24 孔板中, 分组同“2.2” 项, 贴壁生长过夜, 第2 天在相同条件下加药物预处理24 h, 第3 天在相同条件下加入诱导剂RANKL (终质量浓度100 ng/mL), 再加入药物进行处理, 隔天换液并加入上述诱导剂和药物, RANKL 诱导处理7 d后根据TRAP 染色试剂盒说明书进行染色, 200 倍镜下随机选取5 个视野观察细胞分化情况, 具有3个及3 个以上细胞核的多核细胞认定为破骨样细胞, 对其进行计数, 并进行典型破骨样细胞图像采集。 实验重复3 次。
2.4 TRAP 活性检测 RAW264.7 细胞在10%FBS1640 条件下以10 000/孔培养于24 孔板中, 分组同“2.2” 项, 贴壁生长过夜, 第2 天在相同条件下加药物预处理24 h, 第3 天在相同条件加入诱导剂RANKL (终质量浓度100 ng/mL), 再加入药物进行处理, 隔天换液并加入上述诱导剂和药物,诱导处理7 d 后弃去上清, PBS 洗涤1 次后每孔加入100 μL PBS, 刮取细胞并收集细胞悬液, 150 W下超声3 次, 每3 s 间歇2 s, 超声后4 ℃、12 000 r/min下离心15 min, 取上清, 根据TRAP试剂盒说明书检测TRAP 活性, 同时采用BCA 蛋白测定试剂盒测定样品蛋白浓度。 实验重复3 次。
2.5 YDW11 对TRAP、 树突状细胞-特异性跨膜蛋白(DC-STAMP)、 NFATc1 基因表达的影响
RAW264.7 细胞在10%FBS1640 条件下以10 000/孔培养于24 孔板中, 分组同“2.2” 项, 贴壁生长过夜, 第2 天在洗脱条件下加药物预处理24 h, 第3 天在相同条件下加入诱导剂RANKL (终质量浓度100 ng/mL), 再加入药物进行处理, 隔天换液并加入上述诱导剂和药物, 诱导处理7 d 后收集RNA 样品, Trizol 法提取RNA, 根据样品吸光度计算RNA 浓度, 将其调整至500 ng/μL, 按RT 试剂盒说明书逆转成cDNA 样品后, 根据PCR 试剂盒说明书进行聚合酶链式反应。 实验重复3 次, 引物序列见表1。

表1 引物序列Tab.1 Primer sequences
2.6 YDW11 对RANK、 TRAF6、 NFATc1、 组织蛋白酶K 蛋白表达的影响 RAW264.7 细胞在10%FBS1640 条件下以10 000/孔培养于24 孔板中, 分组同“2.2” 项, 贴壁生长过夜, 第2 天在相同条件下加入药物预处理24 h, 第3 天在相同条件下加入诱导剂RANKL (终质量浓度100 ng/mL), 再加入药物进行处理, 隔天换液并加入上述诱导剂和药物, 诱导处理7 d 后收集蛋白, 100 W 下超声3次, 每3 s 间歇2 s, 超声后4 ℃、 12 000 r/min 下离心15 min, 取上清, BCA 蛋白测定试剂盒测定样品蛋白浓度, 每孔上样30 μg 蛋白, 在SDSPAGE 凝胶中电泳, 转膜后5% 牛奶封闭, 检测RANK、 TRAF6、 NFATc1、 cathepsin K 蛋白表达。实验重复3 次。
2.7 YDW11 对miR-155 表达的影响 RAW264.7细胞在10%FBS1640 条件下以10 000/孔培养于24孔板中, 分组同“2.2” 项, 贴壁生长过夜, 第2天在相同条件下加入药物预处理24 h, 第3 天在相同条件下加入诱导剂RANKL (终质量浓度100 ng/mL), 再加入药物进行处理, 隔天换液并加入上述诱导剂和药物, 诱导处理7 d 后收集RNA样品, 采用Trizol 法提取总RNA, 根据Taqman Small RNA 试剂盒说明书, 各样品取10 ng 总RNA, 逆转成cDNA 后进行PCR 反应, 检测miR-155 表达。 实验重复3 次。
2.8 统计学分析 通过SPSS21.0 软件进行处理,组间资料比较采用单因素方差分析, 计量资料以(±s) 表示。 P<0.05 表示差异有统计学意义。
3 结果
3.1 成分鉴定 YDW11 中可能含有16 种成分。通过比较YDW11 和各成分UPLC 色谱图(图1),鉴定出对羟基苯乙酮、 野黄芩苷、 木犀草素、 芹菜素。

图1 各成分UPLC 色谱图Fig.1 UPLC chromatogram of various constituents
3.2 YDW11 对细胞活力的影响 图2 显示, 与对照组比较, YDW11 组对细胞活力无明显影响(P>0.05)。
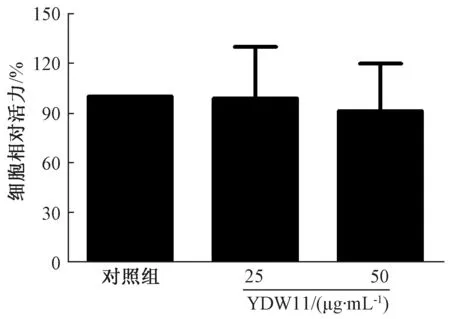
图2 YDW11 对细胞活力的影响Fig.2 Effect of YDW11 on cell viability
3.3 YDW11 对阳性多核细胞数的影响
RAW264.7 细胞体积较小, 镜下观察呈圆形、 多角形等, 一般只含有1 个细胞核, 极少数有2 个核,TRAP 染色阴性; 与单核巨噬细胞比较, 破骨细胞体积明显增大, 部分细胞质可见空泡状, 细胞核数≥3,TRAP 染色阳性。 图3 显示, 对照组无明显TRAP染色阳性多核细胞(细胞核≥3), 模型组显著增加(P<0.01), YDW11 组显著减少(P<0.01)。
3.4 YDW11 对TRAP 酶活性的影响 图4 显示,与对照组比较, 模型组酶活性显著升高 (P <0.05); 与模型组比较, YDW11 组酶活性有所降低, 以50 μg/mL 组更显著(P<0.05)。
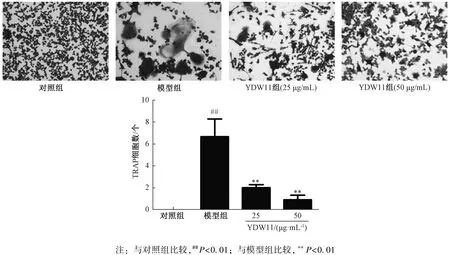
图3 YDW11 对阳性多核细胞数的影响(×200)Fig.3 Effect of YDW11 on positive polykaryocyte count (×200)

图4 YDW11 对TRAP 酶活性的影响Fig.4 Effect of YDW11 on TRAP enzyme activity
3.5 YDW11 对TRAP、 DC-STAMP、 NFATc1 基因表达的影响 图5 显示, 与对照组比较, 模型组TRAP、 DC-STAMP、 NFATc1 基因表达显著升高(P<0.01); 与模型组比较, YDW11 组三者基因表达有所降低, 以50 μg/mL 组更显著 (P <0.05,P<0.01)。
3.6 YDW11 对RANK、 TRAF6、 NFATc1、 组织蛋白酶K 蛋白表达的影响 图6 显示, 与对照组比较, 模型组RANK、 TRAF6、 NFATc1、 组织蛋白酶蛋白表达显著升高(P<0.05, P<0.01); 与模型组比较, YDW11 组三者蛋白表达显著降低(P<0.05, P<0.01), 并呈剂量依赖性。

图5 YDW11 对TRAP、 DC-STAMP、 NFATc1 基因表达的影响Fig.5 Effects of YDW11 on TRAP, DC-STAMP, NFATc1 gene expressions

图6 YDW11 对RANK、 TRAF6、 NFATc1、 组织蛋白酶K 蛋白表达的影响Fig.6 Effects of YDW11 on RANK, TRAF6, NFATc1, cathepsin K protein expressions
3.7 YDW11 对miR-155 表达的影响 图7 显示,与对照组比较, 模型组miR-155 表达显著下降(P<0.05); 与模型组比较, YDW11 组其表达有所升高, 以50 μg/mL 组更显著(P<0.01)。
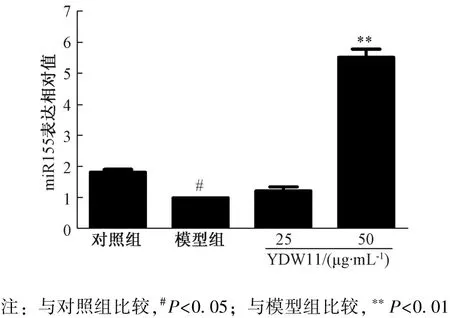
图7 YDW11 对miR-155 表达的影响Fig.7 Effect of YDW11 on miR-155 expression
4 讨论
骨是一个代谢活跃的器官, 在整个生命周期中都在进行不断的更新和改进。 正常情况下, 成骨细胞介导的骨基质合成、 破骨细胞介导的骨吸收维持着骨完整性的平衡, 数量与活性正常的两者对正常的骨转换至关重要, 若功能失调将导致骨骼形态结构异常, 如骨质疏松时骨量减少, 而骨硬化症时骨量增多, 当骨形成动态平衡被打破, 破骨细胞介导的骨吸收大于成骨细胞介导的骨形成时, 就会导致骨质疏松[13]。 由在肿瘤发生骨转移时, 常伴有骨密度减少及破骨细胞异常活化, 故防治骨质疏松最重要的方式之一就是抑制破骨细胞活性、 减少骨吸收。
酸性磷酸酶也称为酸性磷酸酯酶, 在酸性条件下可催化磷酸酯键水解, 其主要分为两类, 一类是抗酒石酸酸性磷酸酶(TRAP), 一类是抗氟离子酸性磷酸酶[14], 其中前者是一种糖基化的含金属蛋白酶, 主要存在于巨噬细胞、 破骨细胞、Gaucher 细胞、 红细胞、 血小板、 脾脏毛状细胞、单核吞噬细胞中, 但在肺泡巨噬细胞和破骨细胞中含有量最丰富, 而单核细胞的前体则不含该酶[15],它在细胞信号转导、 细胞增殖、 分化等方面起到重要作用[16]。 本实验发现, 经核因子-κB 受体活化因子配体(RANKL) 处理7 d 后, 模型组中存在大量破骨细胞(细胞质呈空泡状、 细胞核数目≥3、 体积明显增大、 TRAP 染色阳性), 但在白花蛇舌草-半枝莲药对乙酸乙酯组分(YDW11) 干预下破骨细胞明显减少, 同时TRAP 表达及酶活性也被显著抑制。
核因子-κB 受体活化因子(RANK) 是由其配体RANKL (TRANCE/OPGL/ODF) 激活的在树突细胞上鉴定的TNFR 家族成员, 可促进树突状细胞存活和破骨细胞分化[13]。 RANKL 促进破骨细胞前体分化的过程中, 能诱导活化T 细胞核因子cl(NFATcl)、 树突状细胞-特异性跨膜蛋白 (DCSTAMP) 表达, 而且前者可通过后者上调破骨细胞前体细胞间的融合, 从而促进破骨细胞分化[17]。肿瘤坏死因子受体相关因子6 (TRAF6) 是NF-κB受体活化因子(RANK) 的重要衔接分子, 它与RANK 的耦联对破骨细胞骨吸收功能的维持至关重要[18]; 组织蛋白酶K 是一种溶酶体半胱氨酸蛋白酶, 被认为在骨再吸收过程中由破骨细胞特异性表达[19]。 本实验证实, YDW11 可显著抑制破骨细胞分化重要蛋白和基因的表达, 抑制破骨细胞分化。
miRNA 是一种在细胞分化、 组织发育阶段特异性表达, 主要参与基因转录后调节的内源性非编码单链小分子RNA, 可通过与mRNA 配对调节转录后基因表达使得翻译抑制或mRNA 降解, 在许多生理或病理过程中发挥关键作用, 包括细胞分化、 免疫发展、 癌症转化等[20-21]。 研究表明, 多种miRNA 在破骨细胞分化的过程中发挥了重要作用,如miR-223、 miR-21、 miR-503、 miR-155 等[2], 其中miR-155 作为miRNAs 家族一员, 是一种炎症相关的多功能microRNA, 与免疫功能和细胞凋亡有关, 活化T 细胞、 B 细胞、 巨噬细胞可诱导其表达[20]。 研究表明, 在RAW264.7 向破骨细胞分化时, miR-155 表达显著下降, 而提升其表达可使破骨细胞分化受到抑制[22]。 本实验发现, 经RANKL处理7 d 后, 模型组中miR-155 表达显著降低, 而YDW11 在50 μg/mL 剂量下可大大提升其表达。
中药复方配伍灵活多变, 可依据症状种类及轻重辨证论治, 随证加减, 药对是中药诸多配伍形式中的一种, 为其最小单位[23]。 课题组前期对白花蛇舌草-半枝莲药对不同部位组分进行提取分离,寻找活性部位或成分, 并对其中的化学成分进行初步分析和质量控制, 有助于该药对药用价值的进一步开发。
综上所述, YDW11 可通过上调miR-155 表达、下调相关基因和蛋白表达抑制RANKL 诱导的破骨细胞分化, 提示其具有抑制肿瘤骨转移的潜能, 可为临床相关治疗提供一定参考。
