Alkalibacterium sp.SL3中α-半乳糖苷酶基因的克隆、表达和性质研究
2019-01-24邱聪花叶秀云王国增
邱聪花,罗 蒙,林 娟,叶秀云,王国增
(福州大学生物科学与工程学院,福建省海洋酶工程重点实验室,福建 福州 350108)
0 引言
α-半乳糖苷酶(EC 3.2.1.22)即蜜二糖酶,可特异性催化蜜二糖(Melibiose)、棉子糖(Raffinose)、水苏糖(Stachyose)和毛蕊花糖(Verbascose)等低聚半乳糖苷键,以及含有α-半乳糖苷键的杂多糖,如半乳甘露聚糖、糖蛋白、糖脂等[1].根据氨基酸序列相似性,可将α-半乳糖苷酶归分为糖苷水解酶的第4、27、36、57、97、110等6个家族(http://www.cazy.org/).现研究报道的α-半乳糖苷酶多为27和36家族糖苷水解酶,其中27家族的α-半乳糖苷酶研究最为深入[2].Dey[3]根据底物特异性把α-半乳糖苷酶分为两类: 第一类酶只能与小分子底物相结合,如合成底物PNP-α-Gal及天然低聚糖蜜二糖、棉籽糖和水苏糖; 第二类酶可水解高聚合度的半乳甘露聚糖和瓜尔豆胶.
α-半乳糖苷酶可水解底物末端的(α-1, 6)、(α-1, 4)或(α-1, 3)糖苷键,且该酶的底物在自然界分布十分广泛, 所以α-半乳糖苷酶在很多领域都有重要的应用.例如,在饲料工业领域,将α-半乳糖苷酶添加到牲畜日粮中,可提高饲料的利用率,增加经济效益[4]; 在医药领域,将α-半乳糖苷酶用于人类B→O血型的改造,可缓解血型不足[5],α-半乳糖苷酶还可以用于治疗安德森法布里疾病[6].
盐碱湖是自然界最稳定的碱性环境之一,具有高盐度、高碱性的特征.该环境微生物来源的酶与普通环境微生物来源的酶相比具有优良的性质[7-9].目前还未有盐碱湖分离菌来源的α-半乳糖苷酶基因克隆、表达和性质方面的研究.本实验室从吉林大布苏盐碱湖分离得到一株嗜盐嗜碱细菌Alkalibacteriumsp.SL3,并从该菌获得了耐盐耐碱的酯酶[10]和木聚糖酶[11].本研究从该菌克隆得到一个α-半乳糖苷酶基因,将其在大肠杆菌中成功表达,并对重组酶进行纯化和性质测定,为后续α-半乳糖苷酶的进一步研究奠定基础.
1 材料与方法
1.1 实验材料
Alkalibacteriumsp.SL3: 分离于吉林省乾安县大布苏盐碱湖底泥并由本实验室保存.
菌株和质粒: 大肠杆菌EscherichiacoliTop10和BL21(DE3)购于北京TransGen公司; 载体pMD19-T购于日本Takara公司; 载体pET-22b(+)购于马来西亚Novagen公司.
主要试剂: DNA凝胶回收试剂盒(E.Z.N.A.Gel Extraction Kit,D2500-01)及质粒小提试剂盒(OMEGA Plasmid Mini Kit)购于美国Omega公司; 对硝基苯基-α-D-吡喃半乳糖苷(PNPG)购于美国Sigma公司; 快切限制性内切酶(EcoR I、XbaI、PmeI)、T4 DNA Ligase、氨苄青霉素(Ampicillin)均购于美国Thermo Scientific公司; LA Taq DNA polymerase、dNTP mixtures、DL 5000 DNA Marker购于日本Takara公司.其他试剂均可通过商业购买.
1.2 实验方法
1.2.1α-半乳糖苷酶基因galSL3的克隆
在NCBI数据库下载Alkalibacterium属来源的第27家族的α-半乳糖苷酶氨基酸序列并进行序列比对,找到相应的保守区序列,根据保守区序列设计用于扩保守区片段的简并引物galSL3-GH27-F: 5’-TYGCNTCNTGGGANGTAGAYATC-3’和galSL3-GH27-R: 5’-ACNACNANCATRTCCATCTCRTT-3’.采用Touchdown-PCR,以Alkalibacteriumsp.SL3的基因组DNA为模版,扩增半乳糖苷酶基因的保守区序列.PCR扩增程序如下: 95 ℃预变性5 min; 94 ℃变性30 s,对应引物温度退火30 s,72 ℃延伸 30 s,共10个循环,每个循环降0.5 ℃; 94 ℃变性30 s,对应引物温度退火30 s,72 ℃延伸30 s,共30个循环; 72 ℃延伸10 min,4 ℃保存.PCR产物采用核酸电泳(10 mg·mL-1琼脂糖)进行检测,将与理论大小相同的目的片段切胶回收并纯化,连接到pMD19-T载体上,验证阳性克隆后送到Invitrogen公司测序.将测序后的序列在NCBI数据库中进行Blastx比对分析,结果发现该保守区序列与NCBI数据库中Alkalibacteriumpelagium来源的第27家族半乳糖苷酶蛋白序列(序列号为WP_091478460)相似性高达99%.因此,同源克隆方法获得了Alkalibacteriumsp.SL3的α-半乳糖苷酶基因.
1.2.2 半乳糖苷酶基因galSL3在大肠杆菌中的表达和重组酶的纯化
设计表达引物galSL3-m-F: 5’-CATGGATCCATGACACAACAAGAGCAACTGGG-3’及galSL3-m-R: 5’-CGTAAGCTTGCGGACGACCTTTGCTCTG-3’(分别引入酶切位点BamH I和Hind Ⅲ),以Alkalibacteriumsp.SL3的基因组DNA为模版进行PCR扩增.将PCR扩增产物与载体pET-22b(+)分别双酶切后,两者用T4连接酶连接,并转化至大肠杆菌E.coliBL21(DE3)感受态细胞中,涂在含有100 μg·mL-1氨苄西林的LB筛选板上.菌液PCR鉴定阳性重组子并测序.将测序正确的重组子挑到含有100 μg·mL-1氨苄西林的LB液体培养基中,37 ℃、200 r·min-1振荡培养至OD600为1.0左右,添加终浓度为1 mmol·L-1的IPTG在15 ℃进行诱导表达60 h.
为纯化带有组氨酸标记的重组蛋白rGalSL3,首先将诱导培养的菌液离心(4 ℃、12 000 r·min-1离心10 min),再用pH 值为7.6的Tris-HCl(0.2 mol·L-1Tris)重悬菌体,将菌液置于超声破碎仪中破碎20 min,4 ℃、12 000 r·min-1离心10 min,收集上清.将上清过镍柱,使用含终浓度20~300 mmol·L-1咪唑的Tris-HCl缓冲液(20 mmol·L-1Tris-HCl,500 mmol·L-1NaCl,100 mg·mL-1甘油,pH 值为7.6)进行洗脱.
采用SDS-PAGE电泳检测纯化后的重组α-半乳糖苷酶的纯度及相对分子质量.通过BCA蛋白定量方法测定α-半乳糖苷酶的蛋白浓度.
1.2.3α-半乳糖苷酶酶活的测定
α-半乳糖苷酶的酶活通过PNPG法[12]、葡萄糖氧化酶过氧化物酶(GOD-POD)法[13]、二硝基水杨酸(DNS)法[14]测定.酶活定义: 在最适反应条件下,每分钟酶液水解底物释放1 μmol PNP或葡萄糖为1个酶活单位(U).
PNPG法: 将PNPG溶于0.1 mol·L-1磷酸缓冲液(pH值为 5.5),配置成浓度为2 mmol·L-1的底物.向每个反应管中先加入360 μL 的2 mmol·L-1PNPG,于55 ℃水浴保温5 min,加入适当稀释好的酶液40 μL反应10 min,最后加入600 μL 的1 mol·L-1Na2CO3终止显色,在405 nm比色测定吸光值.利用PNP标准曲线,将吸光度转换成所释放的PNP含量.
GOD-POD法: 用0.1 mol·L-1磷酸缓冲液(pH 值为5.5)配置质量浓度为2.5 mg·mL-1的蜜二糖底物.取900 μL底物加入反应管,置于55 ℃水浴保温5 min,再加入100 μL纯酶液反应10 min,沸水浴5 min,用GOD-POD试剂盒测定葡萄糖含量.
DNS法: 取900 μL质量浓度为2.5 mg·mL-1的棉籽糖、瓜尔豆胶底物(pH值为 5.5)置于55 ℃水浴锅预热5 min,加入100 μL纯酶液反应10 min,再加入1.5 mL的DNS,沸水浴5 min,于540 nm测定吸光值,并依据半乳糖标准曲线计算出释放的半乳糖含量.
1.2.4 重组α-半乳糖苷酶rGalSL3性质的测定
1) 重组酶rGalSL3基本性质.
纯酶rGalSL3的最适pH值: 用pH值为3.0~9.0的缓冲液配置PNPG底物,加入适当稀释的纯酶液,在37 ℃下进行酶促反应.所使用的是pH 值3.0~8.0的0.2 mol·L-1磷酸缓冲液和pH值 9.0~11.0的0.1 mol·L-1Gly-NaOH缓冲液.
纯酶rGalSL3的pH稳定性: 将纯酶液置于不同的pH缓冲液,于37 ℃水浴保温1 h,取出酶液适当稀释后,在最适反应条件下测定剩余酶活力.
纯酶rGalSL3的最适温度: 用pH值为 5.5的磷酸缓冲液配置PNPG底物,加入适当稀释的纯酶液,在10~70 ℃温度范围进行酶促反应.
纯酶rGalSL3的热稳定性: 将酶液用pH 值为5.5的磷酸缓冲液适当稀释后,在50、55、60 ℃保温,于2、5、10、15、20、30、60 min时间点依次取样后置于冰上,在最适反应条件下测定剩余酶活力.
2) 金属离子对重组酶rGalSL3的影响.
在酶促反应中分别加入终浓度为5 mmol·L-1的金属离子及化学试剂,以未经任何处理的反应管作为空白对照,在最适反应条件下测定剩余酶活力.使用到的金属离子及化学试剂包括: FeCl3、CrCl3、FeSO4、Pb(CH3COO)2、MnSO4、MgSO4、NiSO4、CuSO4、CdCl2、ZnSO4、CaCl2、Co(NO3)2、Li2SO4、Na2SO4、KNO3、HgCl2、AgCl、SDS、EDTA、Triton-100、β-mercaptoethanol.
3) 不同浓度NaCl对重组酶rGalSL3活性和稳定性的影响.
NaCl对重组酶rGalSL3活性的影响: 用pH值为5.5的磷酸缓冲液配置含有不同浓度NaCl的2 mmol·L-1PNPG底物,在最适反应条件下测定重组酶的酶活.
NaCl对重组酶rGalSL3稳定性的影响: 取一定体积的重组酶纯酶液,加入NaCl,使NaCl终浓度分别为3.0、4.0、4.5 mol·L-1.将含有不同浓度NaCl的纯酶液置于37 ℃的水浴处理,在不同时间点(0、5、10、20、30、60 min)依次取样置于冰上,适当稀释后在最适反应条件下测定其剩余酶活力.
4) 重组酶rGalSL3的Km、vmax测定.
配置不同浓度(0.2、0.4、0.8、1.0、1.5、2.0、3.0、4.0 mmol·L-1)PNPG底物(pH值为 5.5),加入适当稀释的纯酶液,在55 ℃反应5 min测定酶活力.根据双倒数作图法(Lineweaver-Burk法),从回归方程计算得Km、vmax,并根据α-半乳糖苷酶rGalSL3的理论相对分子质量计算出kcat.
5) 重组α-半乳糖苷酶rGalSL3的TLC底物特异性分析.
以5 mg·mL-1蜜二糖、棉籽糖和瓜尔豆胶(pH值为 5.5)为底物,加入适量纯化的重组酶rGalSL3,放置55 ℃水浴震荡酶解.酶解2 h后取样,在100 ℃灭酶5 min.将酶解液点样于硅胶板置于层析缸展开.展开剂为正丁醇∶冰醋酸∶超纯水=2∶1∶1(体积比); 显色剂为二苯胺1 g、苯胺1 mL、丙酮50 mL、850 mg·mL-1磷酸5 mL.
2 结果与分析
2.1 重组酶rGalSL3的表达和纯化
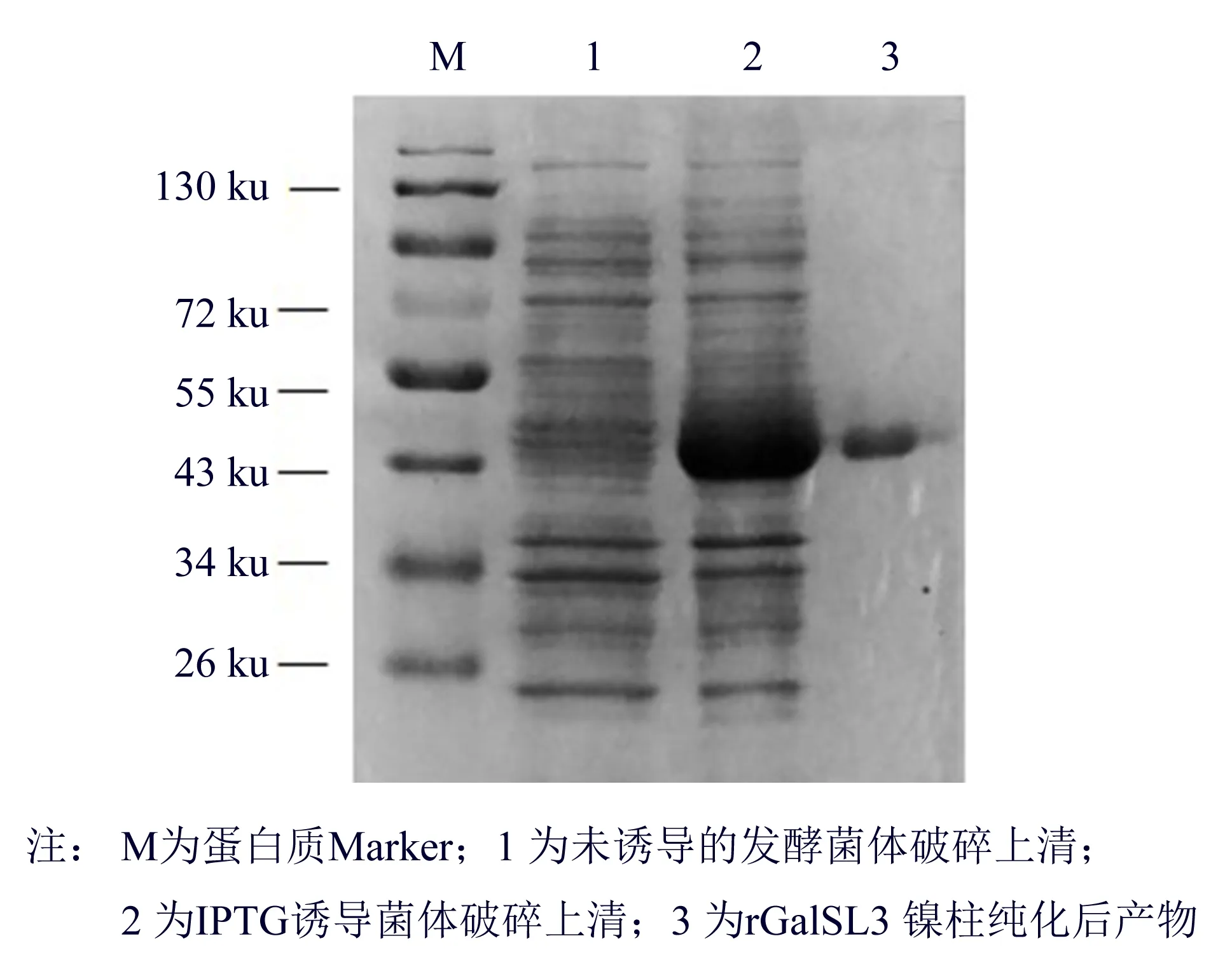
图1 重组rGalSL3的SDS-PAGE分析Fig.1 SDS-PAGE analyses of recombinant rGalSL3
将重组质粒pET-22b-galSL3转到大肠杆菌BL21(DE3)中,经IPTG诱导表达,重组大肠杆菌表达重组α-半乳糖苷酶的酶活为(10.63±0.02)U·mL-1,与野生型α-半乳糖苷酶的活力(0.39±0.02)U·mL-1相比,重组酶的酶活力提高了27倍.
PNPG法测得破碎菌体上清粗酶液总酶活为19 876 U,比活为(32.69±6.54)U·mg-1,通过镍柱亲和层析,收集各个洗脱峰的重组酶,得到了电泳纯的重组酶rGalSL3(见图 1).纯化后重组酶的总酶活为12 517 U,比活为(379.78±5.80)U·mg-1.纯化倍数和得率分别为11.62和62.97%.SDS-PAGE显示重组酶表观相对分子质量大小约为44 ku,与理论值44.19 ku相近.以上结果表明α-半乳糖苷酶基因galSL3在大肠杆菌中实现了异源表达.
2.2 重组酶rGalSL3的酶学性质
重组酶rGalSL3作用的pH值范围如图2(a)所示.在37 ℃时,重组酶水解PNPG最适反应pH值为5.5,属于弱酸性α-半乳糖苷酶,与Zhou等[15]研究报道的来源于黄杆菌属的α-半乳糖苷酶rGalA17相同.当pH值不等于5.5时,重组α-半乳糖苷酶rGalSL3酶活力快速下降,在pH值为3.0和10.0时几乎检测不到酶活力.
重组酶rGalSL3的pH稳定性如图2(b)所示.重组酶rGalSL3具有较为宽广的pH耐受范围,在pH值 5.0~10.0范围内保温1 h后,其剩余酶活力大于90%,且在pH 值为11.0这一强碱性条件下仍保持43%剩余酶活力.Akiba等[16]研究的嗜碱菌Micrococcussp.仅在pH 值6.0~8.5范围内有耐受性,而Zhou报道的重组酶GalA17在pH值为 11.0时其剩余酶活力几乎为零.目前,关于pH耐受性达到11.0时仍保持40%以上酶活力的研究较少.
重组酶rGalSL3最适反应温度为55 ℃,如图2(c)所示.当温度高于55 ℃时,重组酶的酶活急剧下降; 在45~55 ℃之间,酶活力大于80%; 在70 ℃时剩余酶活力为7%.
重组酶rGalSL3在50、55和60 ℃保温下剩余酶活力如图2(d)所示.重组酶在50 ℃保温1 h后其相对酶活为128%; 在55、60 ℃保温1 h后,其剩余酶活力分别为75%和7%.细菌来源α-半乳糖苷酶在最适温度方面差异较大,大多数α-半乳糖苷酶的最适温度范围在40~50 ℃[15-18],只有少数来源极端环境的α-半乳糖苷酶最适反应温度高于65 ℃,如Duffaud等[8]、Fridjonsson等[19]报道的α-半乳糖苷酶最适温度分别为100 ℃和93 ℃.

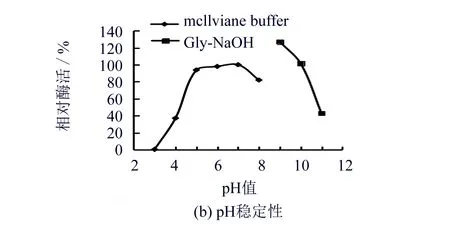
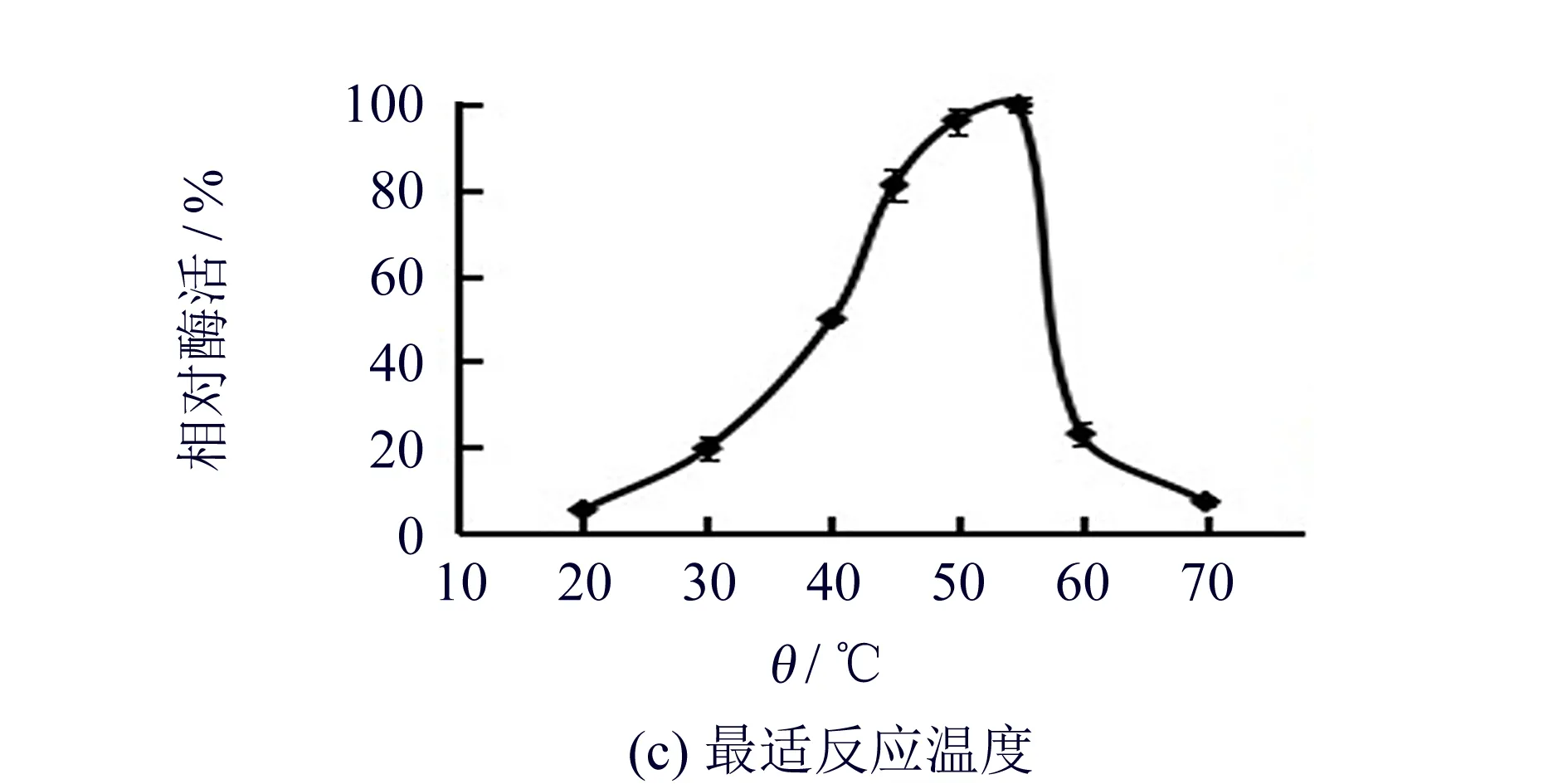

图2 重组酶rGalSL3的酶学性质
2.3 金属离子对重组酶rGalSL3的影响
表1为5 mmol·L-1不同金属离子及化学试剂对重组α-半乳糖苷酶rGalSL3的影响.结果表明,Ca2+、Pb2+、Co2+、Li+、Na+、K+、Triton-100、β-mercaptoethanol对重组酶的酶活有明显的促进作用.辛永平等[20]、毕云枫等[21]也曾报道Mg2+、Ca2+和K+可显著提高重组酶的活力; 而Ca2+、Li+、Na+、K+被多篇文献报道会抑制或不影响α-半乳糖苷酶的酶活力[4, 13, 17-18]; Cr3+、Cd2+对重组酶有一定的抑制作用(剩余酶活80%~90%); Ag+、Hg+、SDS和Mn2+则强烈抑制重组酶的酶活,与Gote 等[22]的报道一致; 其余离子如Fe2+、Mg2+、Ni2+、Cu2+、Zn2+及化学试剂EDTA对重组酶的活性影响不大.

表1 5 mmol·L-1金属离子及化学试剂对rGalSL3活性的影响
注: 表中数值表示相对于对照组中实验组的平均值±标准偏差(n=3)
2.4 NaCl对重组酶rGalSL3活性和稳定性的影响
研究NaCl对重组酶rGalSL3活性的影响,结果如图3(a)所示.由图3(a)可知,NaCl浓度在0~1.5 mol·L-1范围时,NaCl对重组酶rGalSL3活性的影响较小,其相对酶活力大于95%.当NaCl浓度大于1.5 mol·L-1时,重组酶的活力随NaCl浓度增大而逐步下降; 在NaCl浓度小于3.0 mol·L-1的条件下,重组酶剩余酶活力保持50%以上.当NaCl浓度达到4.5 mol·L-1时,该酶的剩余酶活力为20%.Zhou等[23]报道过一株来源于Pontibactersp.的重组酶, 受NaCl影响小,在30%的NaCl溶液中保持70%以上的剩余酶活力.
NaCl对重组酶rGalSL3稳定性的影响见图3(b).实验结果表明: 重组酶rGalSL3有很好的NaCl耐受性.该酶在3.0 mol·L-1NaCl溶液中保温1 h后,其剩余酶活力仍维持95%以上.在含有4.0和4.5 mol·L-1的NaCl溶液中保温,其剩余酶活力随着时间的增加开始缓慢下降,在保温1 h时后,其剩余酶活力大于45%.
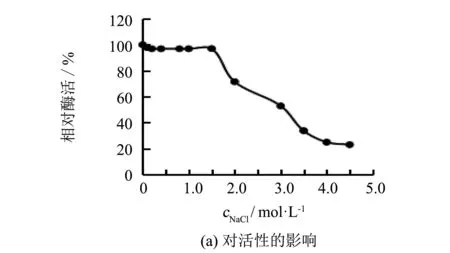

图3 不同浓度NaCl对重组酶rGalSL3活性和稳定性的影响
2.5 重组酶rGalSL3动力学常数及底物特异性分析
采用双倒数作图法制作重组酶rGalSL3的Lineweaver-Burk关系图(见图4).根据公式在两轴的截距及酶蛋白理论分子量,计算出重组酶rGalSL3对PNPG的Km、vmax和kcat值分别为(2.64±0.02)μmol·mL-1、(454.55±0.59)μmol·(mg·min)-1和(347.73±1.27)s-1.
纯化的重组酶rGalSL3水解PNPG的比活为(379.78±5.80)U·mg-1.GOD-POD法测得该酶对蜜二糖的比活为(0.013±0.001)U·mg-1.采用DNS法在10 min检测不到rGalSL3水解棉籽糖及瓜尔豆胶酶活力.
不同底物酶解2 h后, 进行TLC检测, 结果如图5所示.结果表明rGalSL3可以水解蜜二糖及棉籽糖产生半乳糖,而对瓜尔豆胶没有活性.
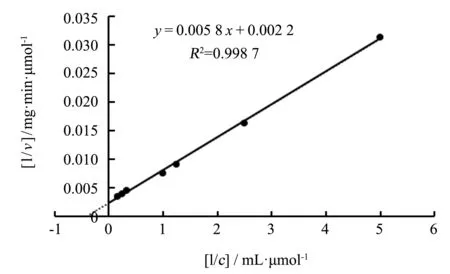
图4 重组酶rGalSL3的 Lineweaver-Burk关系图Fig.4 Lineweaver-Burk plot of recombinant rGalSL3

图5 TLC分析重组酶rGalSL3水解产物Fig.5 TLC analysis of recombinant rGalSL3 enzyme hydrolysis products
3 结语
研究从吉林省乾安县大布苏盐碱湖分离的嗜盐嗜碱菌Alkalibacteriumsp.SL3中克隆得到一个α-半乳糖苷酶基因galSL3,并在大肠杆菌中成功表达.纯化后的重组酶rGalSL3具有广泛的pH稳定性、较好的热稳定性、耐盐性及较好的离子抗性等特性,使得其在食品、饲料等领域中具有较大的应用潜力.
