泾阳茯茶生产环境中冠突散囊菌多样性检测
2019-01-24孟令缘施东妮盛焕精葛武鹏贺玉锋毛敏辉杨保伟
孟令缘,施东妮,盛焕精,葛武鹏, 贺玉锋,毛敏辉 ,杨保伟
(1.西北农林科技大学 食品科学与工程学院,陕西杨凌 712100; 2.西咸新区市场服务与监督管理局泾河新城分局, 陕西泾阳 713700; 3.西咸新区泾河新城城乡管理局,陕西泾阳 713700)
泾阳茯茶是一种全发酵茶,长期饮用能有效调节人体新陈代谢、促进消化,并有一定程度的疾病预防和保健作用[1-3],在中国西北和蒙古等游牧民族活动地区深受消费者喜爱[4-6]。
茯茶生产中的“发花”工序实际是“金花菌”在茶叶中生长繁殖,产生淀粉酶、纤维素酶和果胶酶等有益成分,从而改善茶叶口感、风味和品质的过程[7-8]。因此,“金花菌”的数量常作为茯茶品质评价的一项重要指标。然而,关于茯茶中“金花菌”的多样性研究结果并不一致,对“金花菌”的分类鉴定尚存在分歧[9-13]。陕西泾阳是中国茯茶的发源地及现存主要产地之一,茯茶生产领域也比较认可“金花菌”为冠突散囊菌,但未见对泾阳茯茶产区“金花菌”多样性进行研究的报道。
本研究对采集自陕西泾阳茯茶厂部分样品中的“金花菌”进行分离,并对其进行形态学和分子生物学鉴定,旨在阐明泾阳地区不同茯茶生产厂区、工段和环境中冠突散囊菌的多样性,以期为茯茶工业化和标准化生产提供依据。
1 材料与方法
1.1 试验材料
茶叶和茯茶生产环境样品分别采集自陕西泾阳泾砖茶业(贾根社)有限公司(生产方式为传统手工生产)和泾阳泾普茶业有限公司(生产方式为现代化、机械化工业生产)。采集的样品和数量具体为:茶叶样品 15份(原料茶5份,渥堆茶3份,“金花菌”发花期半成品茯茶2份,成品茯茶5份),生产环境空气沉降样34份,“金花菌”发花室窗台和地板涂抹样4份,土壤样品5份,工厂墙壁涂抹样2份,茶釉样品3份。
1.2 培养基
PDA培养基、察氏培养基和BPW肉汤购自北京陆桥生物科技有限公司,按使用说明配制,121 ℃灭菌20 min后,PDA和察氏培养基倒入一次性无菌培养皿制备平板,凝固后密封保存,备用。
1.3 试验方法
1.3.1 样品采集 茶叶样品采集:戴上一次性无菌手套,分别从混合均匀的原料茶和渥堆茶不同位置随机采集约250 g,装入无菌均质袋,密封保存,备用。发花半成品茯茶和成品茯茶各随机采集3块茶饼,实验室无菌条件下打散、混匀后取样。空气沉降样品采集:培养皿做好标记后,打开PDA与察氏培养基皿盖,将培养基置于茶厂的发花室内、成品储藏室、厂区院落和走廊等地,暴露15 min后,盖上皿盖, 28 ℃培养5~8 d。
涂抹样品采集:使用无菌BPW润湿3~5根无菌棉签,分别擦取生产车间的窗台、走廊和墙角等位置的浮尘,每样品采样面积约10 cm×10 cm。采样后使用无菌剪刀剪下棉签头部,装入50 mL无菌离心管,密封保存,备用。
1.3.2 冠突散囊菌分离 茶叶中冠突散囊菌分离。方法一:用无菌镊子夹取茶叶少许,分别置于PDA与察氏培养基表面,轻压使茶叶和培养基充分接触,28 ℃培养5~8 d。
方法二:称取茶叶25 g,置于装有225 mL无菌蒸馏水的三角瓶中,充分振荡,即为10-1样品稀释液。倍比稀释,依次得到10-2、10-3、10-4、10-5和10-6浓度样品稀释液。分别取10-1、10-2和10-3稀释液在PDA和察氏培养基上连续划线,28 ℃培养5~8 d。疑似菌单菌落在PDA平板多次纯化后转接PDA斜面,28 ℃培养7 d后用无菌石蜡密封,4 ℃冰箱保存,备用。
为了尽可能分离出茶叶中的冠突散囊菌,研究同时采用涂布法,将1 mL 10-2、10-4和10-6样品稀释液分别滴加于PDA和察氏培养基,涂布均匀,28 ℃培养5~8 d,挑取典型菌落,纯化后石蜡密封保存,备用。
空气沉降样品中冠突散囊菌分离。空气沉降样品于28 ℃培养5~7 d,挑取典型菌落,纯化后石蜡密封,4 ℃保存,备用。
土壤中冠突散囊菌分离。具体方法同茶叶中冠突散囊菌的分离。
涂抹样品中冠突散囊菌分离。向保存棉签头的离心管中加入10 mL无菌BPW,充分振荡后,取悬液分别划线于PDA和察氏培养基,28 ℃培养5~8 d,挑取典型菌落,纯化后保存。
1.3.3 形态学鉴定 疑似冠突散囊菌划线接种于PDA培养基,28 ℃培养5~7 d。将适量无菌水加到PDA培养基表面,用无菌刮铲轻刮菌落(苔),得到菌悬液。吸取0.5 mL菌悬液涂布于另一PDA培养基后,将无菌盖玻片以45°斜角插入培养基,28 ℃培养6~8 h后取出4~6片,于盖玻片上滴加少许石炭酸棉兰染液进行染色,显微镜下观察孢子萌发和菌丝分化情况。之后,每隔6~8 h,取出4~6片盖玻片,用吸水纸擦去生长相对较差玻片一面的菌丝后,石炭酸棉兰染色。染色标本在自动摄像显微镜下观察,选取代表性菌丝及相应结构,拍照记录。
1.3.4 分子生物学鉴定 使用TAKARA真菌基因组提取试剂盒(No.9768;TAKARA MiniBEST Plant Genomic DNA Extraction Kit)提取疑似菌的总DNA,参照TAKARA真菌鉴定试剂盒(No.RR178,Fungi Identification PCR Kit)说明,对疑似菌的26S rDNA D1/D2区和ITS序列进行PCR扩增,扩增产物经琼脂糖凝胶电泳检测后,低温条件下送北京奥科生物科技有限公司测序。将测得的26S rDNA D1/D2区和ITS序列提交NCBI基因库(http://www.ncbi.nlm.nih.gov/BLAST/),通过Blast进行同源检索,下载同源序列。使用Mega 6.0软件对菌株的26S rDNA D1/D2区及ITS序列和下载的同源序列进行比对,采用邻接法(Neighbor-joining,NJ)构建系统发育树,通过自举(Bootstrap)1 000次重复对系统发育树进行检验以鉴定菌株。
2 结果与分析
2.1 菌株分离及形态学鉴定
共分离得到26株疑似冠突散囊菌(图1中米粒状黄色菌落即为疑似冠突散囊菌)。菌丝不发达,呈匍匐状生长,PDA培养基上生长较快。5 d后PDA培养基上菌落直径为11~16 mm,圆形,结构致密。菌落边缘的新生菌丝生长旺盛,乳白至浅黄色,中央呈金黄色至深褐色,有少量褐色渗出液,菌落背面呈深褐色。在察氏培养基上生长较慢,7 d后培养基颜色在渗出物的影响下逐渐变深(图2)。
光学显微镜(10×40倍)检测发现:培养12 h后孢子萌发,分化出一级菌丝;24~48 h可见菌丝横隔膜;48~72 h部分菌丝末端出现卷曲,进一步分化;72 h后可见球状闭囊壳,内有大量金黄色孢子。闭囊壳成熟后破裂,孢子释放,完成一个生长期(图3)。依据孢子萌发、菌丝分化、分生孢子梗和子囊形成等结果,结合菌落特征、菌丝形态及生长状况,参考《真菌鉴定手册》与文献资料描述,初步鉴定分离菌株为子囊菌纲-真子囊菌亚纲-球壳菌目-冠囊菌科-冠散囊菌属。

图1 工厂环境中“冠突散囊菌”和其他真菌菌落Fig.1 Colonies of Eurotium amstelodam and other fungi in the factory environment
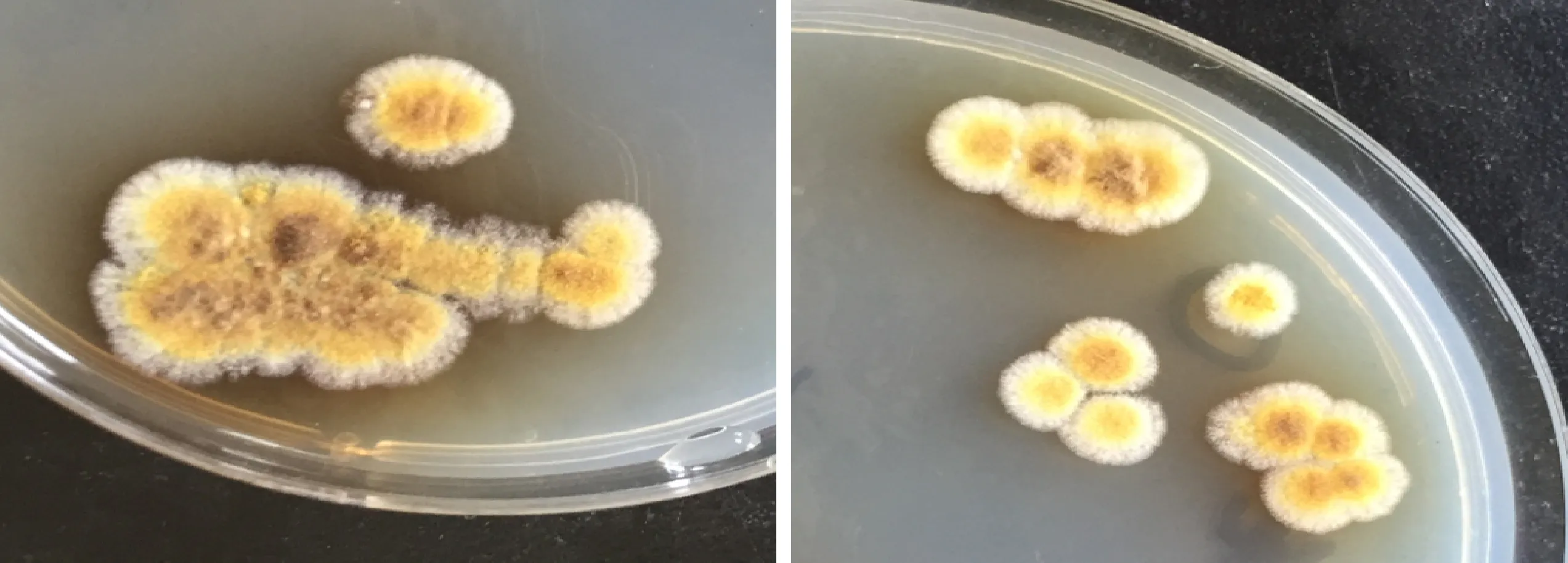
图2 “冠突散囊菌”在察氏培养基上培养5 d的菌落Fig.2 Colony morphology of Eurotium amstelodam in Czapek’s culture after 5 days incubation

A.冠突散囊菌孢子萌发 Spore germination ofEurotiumcristatum;B.有隔菌丝及子囊果形成前期 The formation of hyphae and ascocarp in early stage ;C.子囊果形成前的菌丝卷曲 Hyphae curling before ascocarp formation;D.曲霉孢子形成 The formation ofAspergillusspore;E.闭囊壳及金黄色孢子 Closed capsule and golden spore;F.闭囊壳破裂释放孢子 Spores are released by rupture of the capsule
图3冠突散囊菌生长状况
Fig.3ThegrowthcycleofEurotiumcristatum
2.2 分子生物学鉴定
对照测序色谱图,确定PCR扩增产物碱基序列无误后,用Mega 6.0软件对26株菌的26S rDNA D1/D2区序列进行多重比对,相似度为100%。系统发育树聚类结果表明,26株供试菌株的26S rDNA D1/D2区序列与登录号为JN938912.1、U29549.1、JF922030.1和AY213699.1的Eurotiumamstelodami序列聚在同一簇,同源性100%,确定研究中分离得到的菌株为冠突散囊菌(图4)。
将测序得到的ITS序列多次校对编辑后,使用Mega 6.0软件,选用PenicilliumrestrictumAY354256.1相应序列作为外群(Outgroup)构建系统发育树,结果表明26株分离菌的ITS序列与GenBank中登录号为KC466532.1的Eurotiumamstelodami的ITS序列聚在同簇(图5),同源性99%,鉴定分离株为冠突散囊菌。

图4 26株菌种的26S rDNA的D1/D2区序列进化树分析Fig.4 Phylogenetic tree of 26 strains based on D1/D2 region of 26S rDNA
3 讨 论
近年来,很多学者对湖南发酵茶中的微生物进行分离鉴定,结果均表明湖南发酵茶中的主要微生物为冠突散囊菌[14-17]。另有学者对茯茶中微生物、化学成分及保健功能研究后,所得结果并不一致,存在分歧[18-21]。
Mao等[22]、周绍琴[23]和Hong等[24]分别在六堡茶、传统发酵豆瓣酱和韩国豆酱中也检出冠突散囊菌,表明冠突散囊菌不仅存在茯茶之中,还可能在许多对人体健康有益的食品中存在。
在陕西泾阳,人们几百年来一直通过手工方式自然发酵生产茯茶,但其规模都不大,产品质量良莠不齐。近年来,随着市场需求的增加及食品生产规模化、安全化和标准化的驱动,泾阳茯茶的生产规模和质量越发受到当地政府重视。可以肯定的是,在泾阳,从古到今人们能够自然发酵生产茯茶,表明该地区的环境中肯定广泛存在能够发酵茶叶生产茯茶的冠突散囊菌。然而,此前并没有相关研究揭示该地区茯茶及茯茶生产环境中的“金花菌”、流行状况和多样性,并对之进行分类鉴定。本研究通过对茯茶及茯茶生产环境中“金花菌”进行分离鉴定,明确该地区茯茶及其生产环境中的“金花菌”为冠突散囊菌,且在两个不同厂区和不同工段的冠突散囊菌属同一种。
本研究还表明冠突散囊菌在察氏培养基和PDA培养基上生长状况略有不同。相对察氏培养基,冠突散囊菌在PDA上更容易生成褐色类物质,这可能与培养基成分不同有关。该菌代谢产生的褐色物质及其含量可能与茯茶的汤色深浅间存在一定关系。

图5 26株菌的ITS序列进化树Fig.5 Phylogenetic tree of 26 strains based on Internal Transcribed Spacer (ITS) sequence
