不同胡麻品种TAG合成途径关键基因表达与含油量、脂肪酸组分的相关性分析
2019-01-23李闻娟齐燕妮王利民党照赵利赵玮谢亚萍王斌张建平李淑洁
李闻娟,齐燕妮,王利民,党照,赵利, 赵玮,谢亚萍,王斌,张建平*,李淑洁
(1.甘肃省农业科学院作物研究所,甘肃 兰州 730070;2.甘肃省农业科学院生物技术研究所,甘肃 兰州 730070)
胡麻(Linumusitatissimum)是一年生的二倍体自花授粉植物,属于亚麻科亚麻属[1]。胡麻是全球非常重要的油料作物,主要种植于印度,加拿大和中国[2]。胡麻籽一般含有40%~50%的油脂[3],被用来作为食品原料有很高的营养价值。胡麻籽中含有多种脂肪酸,主要由棕榈酸(palmitic acid,PAL,C16∶0,约6%)、硬脂酸(stearic acid,STE,C18∶0,约4.4%)、油酸(oleic acid,OLE,C18∶1,约24.2%)、亚油酸(linoleic acid,LIO,C18∶2,约15.3%)和亚麻酸(linolenic acid,LIN,C18∶3,约50.1%)组成[4],其中大约有73%的脂肪酸是多不饱和脂肪酸,而α-亚麻酸(α-linolenic acid,ALA,C18∶3)大约占了50%[5]。胡麻油是含有α-亚麻酸最丰富的农产品,很多研究表明亚麻酸对人的身体健康有很多的益处,它能够预防心血管疾病、高血压和癌症[6-8]。近年来,由于胡麻种子含有丰富的亚麻酸,已经越来越多地应用于营养食品的加工。
在很多植物中,种子中的油脂主要以三酰甘油(TAG,triacylglycerol)的形式储存,作为种子中碳和能量的来源。在种子里,TAG在内质网中合成,积聚在油体中[9]。TAG的合成有两条途径,一条是依赖于脂酰-CoA的途径。首先,脂酰-CoA通过甘油-3-三磷酸酰基转移酶(GPAT,glycerol-3-phosphate acyltransferase)对sn-1的位置酰基化,GPAT是这条途径中的限速酶[10]。在拟南芥(Arabidopsisthaliana)中过表达GPAT基因可以增加种子的含油率和种子重量[11]。在拟南芥中,GPATs家族有10多个同源基因,只有GPAT9 (At5g60620)定位于内质网膜上,参与TAG生物合成时甘油碳链骨架sn-1位置的酰基化反应[12-13]。最后通过二酰甘油酰基转移酶(DGAT, acyl-CoA: diacylglycerol acyltransferase)的催化在sn-3位置酰基化产生TAG。DGAT也被认为是植物中油脂储存的限速酶[14-16]。在不同的植物种类中,DGATs酶的类型也不同。在大部分生物中,DGAT1和DGAT2是TAG合成途径中的两种重要酶,它们定位于内质网不同的区域,在TAG的合成中有不同的功能[17-18]。DGAT1在许多油料种子中对TAG的积聚和脂肪酸的组分有非常重要的影响[19],DGAT2主要在很多特殊脂肪酸含量较高的植物中对油脂的积聚和组分有很重要的影响。在这些植物种子中,DGAT2的表达远远高于DGAT1[20-22]。另一条是不依赖于脂酰-CoA的途径[23],TAG还可以被不依赖于脂酰-CoA的磷脂酰胆碱:二酰基甘油酰基转移酶(PDAT,phospholipid: diacylglycerol acyltransferase)催化合成,从磷脂的sn-2转移酰基到 sn-1,2-甘油二脂(DAG, diacylglycerol)的sn-3位置[24-25]。从拟南芥中分离出两个同源的PDAT基因,PDAT1(At5g13640)和PDAT2(At3g4480)。PDAT1是TAG的生物合成中主要的酶之一[26]。在油桐(Verniciafordii)[24]和蓖麻(Ricinuscommunis)[21]中,发现DGAT1、DGAT2和PDAT对TAG的合成有重要的作用,特别是DGAT2和PDAT在这些种子里有很高的表达,这两种酶可能参与油脂中特殊脂肪酸的生成[22]。
在植物中影响多不饱和脂肪酸的合成还有两个关键酶—脂肪酸去饱和酶FAD2和FAD3,生成亚油酸和亚麻酸。FAD2被认为是脂肪酸合成通路的限速酶[27],是油酸脱氢形成亚油酸的关键酶[28]。FAD3是亚油酸去饱和生成亚麻酸的关键酶[29]。在啤酒酵母(Saccharomycescerevisiae)中表达拟南芥的FAD2基因能使亚油酸含量增高[30]。Yadav等[31]报道了拟南芥FAD3的突变体与野生型相比亚麻酸含量降低了3%。
本研究以含油量和亚麻酸含量有显著差异的3个胡麻品种(系)为材料,分析了张亚2号、R2-17和陇亚10号中油脂和脂肪酸组分的动态积累模式,以及在不同发育阶段的不同组织中TAG合成途径中7个关键基因 (GPAT9、DGAT1 &DGAT2、PDAT1 &PDAT2、FAD2A&FAD3A) 的动态表达模式及相关性,以期筛选鉴定出与胡麻含油量及脂肪酸组分显著相关的基因,为进一步通过分子育种培育高油、高亚麻酸含量胡麻新品种奠定基础。
1 材料与方法
1.1 试验材料
3个胡麻品种张亚2号、R2-17和陇亚10号作为试验材料(由甘肃省农业科学院作物研究所胡麻课题组提供),于2017年3月种植于甘肃省农业科学院兰州实验基地(36° N,103°40′ E,海拔1500 m)。每个材料种植50行,行长2 m,行距0.2 m,每行200株,按照常规种植管理方式进行田间管理。在花开时标记花,花开2~3朵时作为开花初期,从开花初期到开花后10、20、30、40和 50 d收集不同阶段的根、茎、叶(50 d时叶已凋落,未取50 d的叶)、花和种子(图1),所有材料用无菌剪刀和镊子完整的分离开,每份样品至少取15株混合。所有的样品从田间取样并用蒸馏水冲洗干净,各个组织用液氮速冻并于-80 ℃保存备用。不同发育阶段的种子于75 ℃的烘箱中烘干至恒重。

图1 3个胡麻品种开花后不同发育阶段的种子Fig.1 Seeds of three linseed varieties in five seed developmental stages A:张亚2号开花后10~50 d的烘干种子;B:陇亚10号开花后10~50 d的烘干种子;C: R2-17开花后10~50 d的烘干种子;D:陇亚10号开花后10~50 d的新鲜种子。标尺=10 mm.A: Dried seeds in 10th-50th day after flowering of Zhangya 2; B: Dried seeds in 10th-50th day after flowering of Longya 10; C: Dried seeds in 10th-50th day after flowering of R2-17; D: Fresh seeds in 10th-50th day after flowering of Longya 10. Scale bars=10 mm.
1.2 RNA的提取及cDNA第一条链合成
总RNA参考RNA提取试剂盒(Qiagen)说明书提取。用Nanodrop 2000测定RNA的浓度和质量,样品的260/280 nm为1.8~2.0。用1.5%的琼脂糖凝胶电泳检测RNA的完整性,没有降解。用Prime-Script II试剂盒(TaKaRa)合成cDNA第一条链。每个不同发育阶段的cDNA样品储存于-20 ℃。所有标准样和有机溶剂采购于Introvigen或Takara公司。
1.3 引物合成
胡麻GPAT9基因序列由本实验室测序比对得到,荧光定量引物用Primer 5.0设计。PDAT1/PDAT2、DGAT1/DGAT2、FAD2A/FAD3A从已经报道过的引物中选取[10,28]。甘油醛-3-磷酸(GAPDH,glyceraldehyde-3-phosphate dehydrogenase)用做内参基因[2]。所有引物由上海生物化工公司合成(表1)。荧光定量的引物用Premix Ex Taq DNA polymerase试剂盒 (TaKaRa)经标准PCR扩增基因片段检测。扩增程序如下:94 ℃ 3 min;然后 94 ℃ 30 s,60 ℃ 30 s,72 ℃ 45 s,扩增32个循环;72 ℃ 后延伸5 min。PCR产物用GelRed染料染色,通过1.2 %的琼脂糖凝胶电泳检测。

表1 实时荧光定量PCR引物Table 1 Primers used for real time-PCR analysis
1.4 实时荧光定量PCR
采用Eco(illumina公司)荧光定量PCR仪,2×SYBR荧光定量试剂盒(Biomiga)。每50 μL的体系里包含100 ng·μL-1cDNA模板2 μL,SYBR染料25 μL,上下游引物各1 μL (10 μmol·L-1),ddH2O 21 μL。扩增条件如下:50 ℃ 2 min;95 ℃ 10 min;95 ℃ 15 s;60 ℃ 1 min,40个循环。每个反应绘制融解曲线,为了确保扩增的特异性。每份样品重复3次,用GAPDH作为内参,由2-ΔΔCt方法计算得出[32]。
1.5 油脂和脂肪酸的测定
用Soxtec 8000(FOSS公司)提取油脂,方法遵照仪器说明书。脂肪酸的分析使用脂肪酸甲酯化方法[33]。用安捷伦7820A气相色谱仪分析脂肪酸组分,使用30 m×0.32 mm×0.33 μm的AT.KD-FFAP柱子。每个样品重复3次(测定脂肪含量采用国家标准GB/T 14772-2008;测定脂肪酸组分采用气相色谱法)。
1.6 数据分析
采用SPSS 20.0统计分析软件进行数据整理、单因素方差分析及显著性差异比较,用Excel 2010进行原始数据的整理。
2 结果与分析
2.1 胡麻发育阶段油脂的积累规律
试验结果表明,3个参试品种(系)张亚2号、R2-17和陇亚10号的含油量和脂肪酸组分存在极显著的差异(P≤0.01)。张亚2号成熟种子的含油量最高,R2-17的最低,陇亚10号居中(表2)。

表2 3个品种(系)在种子成熟期时的含油量和5种脂肪酸组分Table 2 Oil content and average contents of five FAs in three flax varieties (%)
注:同列不同小写字母表示差异显著,采用Duncan’s 多重比较法分析 (P≤0.01,n=3)。
Note: Duncan’s multiple range test, different small letters in the same column indicate significant difference (P≤0.01,n=3).
种子不同发育阶段含油量的积累动态表明,不同品种开花后10~20 d,种子油脂快速积累,种子含油量大约增加了30%,张亚2号的油脂积累速率明显高于R2-17和陇亚10号。开花后20 d到成熟期,油脂的积累速率变化不大,但是不同品种存在明显差异。张亚2号的油脂积累速率一直呈现增加趋势,而陇亚10号油脂积累速率呈现先增加后降低的趋势,含油量较低的R2-17油脂积累速率呈现下降趋势(图2A)。
2.2 种子发育阶段脂肪酸组分的变化
胡麻的5种主要脂肪酸组分结果见图1B~F。在3个品种(系)中,硬脂酸和油酸的积累规律不同(图2C, D)。棕榈酸、亚油酸和亚麻酸的积累规律相似(图2B,E,F)。棕榈酸随着种子的发育含量逐渐减少,开花后20 d下降较明显(图2B)。亚油酸从开花后10~20 d下降较明显,之后R2-17中的亚油酸含量变化幅度不大,张亚2号中的亚油酸含量从开花后40~50 d下降较明显,陇亚10号中的亚油酸含量持续下降直至种子成熟。成熟期亚油酸的含量与发育早期存在差异(图2E),且成熟期时,张亚2号的亚油酸含量最低。亚麻酸是胡麻油中最重要的脂肪酸,从胡麻开花后10~20 d含量增高较明显,且张亚2号和R2-17的亚麻酸增长趋势高于陇亚10号。在张亚2号中,亚麻酸含量随着种子发育阶段持续增高直至种子成熟。在R2-17中,亚麻酸含量随着种子发育缓慢下降。在陇亚10号中,亚麻酸含量从开花后20~40 d含量缓慢增高,到成熟期时略有下降,成熟期时,张亚2号的亚麻酸含量最高,R2-17次之,陇亚10号最低(图2F)。
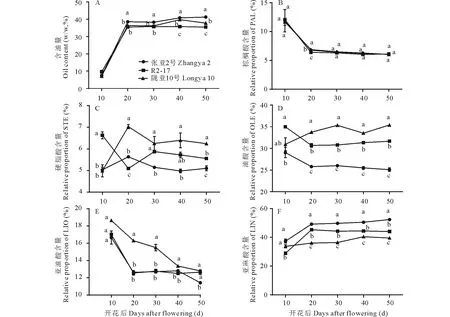
图2 3个胡麻品种在种子发育阶段的含油量和脂肪酸组分的积累模式Fig.2 Changes in total oil content and fatty acid profiles of three flax varieties in five seed developmental stages A:3个胡麻品种种子发育阶段中含油量的积累模式;B~F:种子发育阶段中5种脂肪酸[棕榈酸(PAL),硬脂酸(STE),油酸(OLE),亚油酸(LIO),亚麻酸(LIN)]的积累模式。图中不同小写字母表示差异显著 (P≤0.05, n=3)。A: Total oil content in developing seeds of three flax varieties; B-F: Five fatty acids [palmitic (PAL), stearic (STE), oleic (OLE), linoleic (LIO) and linolenic (LIN)] were analyzed from five seed developmental stages of three flax varieties. Different lowercases indicate significant difference (P≤0.05, n=3).
2.3 胡麻各个组织的不同发育阶段与油脂代谢相关基因的表达分析
胡麻不同组织中的不同发育阶段与TAG合成和脂肪酸去饱和相关的7个酶基因的瞬时表达分析结果见图3~9。
2.3.1GPAT9基因表达分析GPAT9基因在胡麻的根、茎、叶、花和种子中均有表达,主要在发育后期的茎和发育早期的叶中表达最高,发育中期的根和种子中次之。在根中的表达量是先增高后降低;在茎中表达量逐渐增高;在叶中表达量逐渐降低。在种子中,3个材料中GPAT9的表达都是先增高后降低。开花后20 d时表达量达到高峰,其中张亚2号中的表达量最高,陇亚10号次之,R2-17最低。在成熟期时,张亚2号中的表达量依然大于陇亚10号和R2-17(图3)。

图3 GPAT9基因在3个胡麻品种不同发育阶段的根、茎、叶、花和种子中的相对表达量Fig. 3 Relative expression level of GPAT9 gene in different developing roots, stems, leaves, flower and seeds stages of three flax varieties R,开花初期的根;R1,开花后10 d的根;R2,开花后20 d的根;R3,开花后30 d的根;R4,开花后40 d的根;R5,开花后50 d的根;S,开花初期的茎;S1,开花后10 d的茎;S2,开花后20 d的茎;S3,开花后30 d的茎;S4,开花后40 d的茎;S5,开花后50 d的茎;L,开花初期的叶;L1,开花后10 d的叶;L2,开花后20 d的叶;L3,开花后30 d的叶;L4,开花后40 d的叶;F,开花初期的花;10D~50D,开花后10~50 d种子的发育阶段。图中种子不同发育阶段基因的相对表达量以张亚2号开花初期的根为对照,表达量设为“1”。竖线表示标准误(SE,n=3)。下同。R, root in early flowering; R1, root in 10th day after flowering; R2, root in 20th day after flowering; R3, root in 30th day after flowering; R4, root in 40th day after flowering; R5, root in 50th day after flowering; S, stem in early flowering; S1, stem in 10th day after flowering; S2, stem in 20th day after flowering; S3, stem in 30th day after flowering; S4, stem in 40th day after flowering; S5, stem in 50th day after flowering; L, leaves in early flowering; L1, leaves in 10th day after flowering; L2, leaves in 20th day after flowering; L3, leaves in 30th day after flowering; L4, leaves in 40th day after flowering; F, flowers in early flowering; 10D-50D, seeds developing stages. Results are shown as the relative expression of genes at different developing stages by comparing to root expression of Zhangya 2, which was set as “1”. Bars represent standard error (SE, n=3). The same below.
2.3.2DGAT1和DGAT2基因表达分析DGAT1基因在各个组织中均有表达,主要在发育后期的种子中表达量最高,在根、茎、叶中表达量不高。在种子中,张亚2号DGAT1基因的表达逐渐增高,R2-17和陇亚10号中先增高,到成熟期时又下降(图4)。DGAT2和DGAT1的表达模式大致相同。张亚2号中,DGAT2的表达量是逐渐增高;R2-17的表达量是先增高,到成熟期时迅速降低;陇亚10号的表达量是先增高,到开花后40 d下降,持续下降到成熟期(图5)。到成熟期时,DGAT1和DGAT2在张亚2号的表达量最高,陇亚10号次之,R2-17最低。
2.3.3PDAT1和PDAT2基因表达分析PDAT1基因在各个组织中均有表达,主要在开花后30 d的根中和开花后20 d的种子中表达量高。在根中,PDAT1基因在开花后30 d表达量达到最高,随后开始下降;在茎中,张亚2号的表达是先增高后降低,R2-17和陇亚10号逐渐增高;在叶中,表达逐渐增高。在种子中,在开花后20 d表达量达到最高,张亚2号最高,R2-17次之,陇亚10号最低,随后开始下降;到成熟期时,张亚2号中的表达量依然高于R2-17和陇亚10号(图6)。PDAT2基因的表达模式和PDAT1截然不同。PDAT2基因在开花初期的叶中表达量达到最高,在根和茎中次之,在种子中最低。在叶中,开花初期的表达量最高,然后逐渐下降(图7)。

图4 DGAT1基因在3个胡麻品种不同发育阶段的根、茎、叶、花和种子中的相对表达量Fig.4 Relative expression level of DGAT1 gene in different developing roots, stems, leaves, flower and seeds stages of three flax varieties
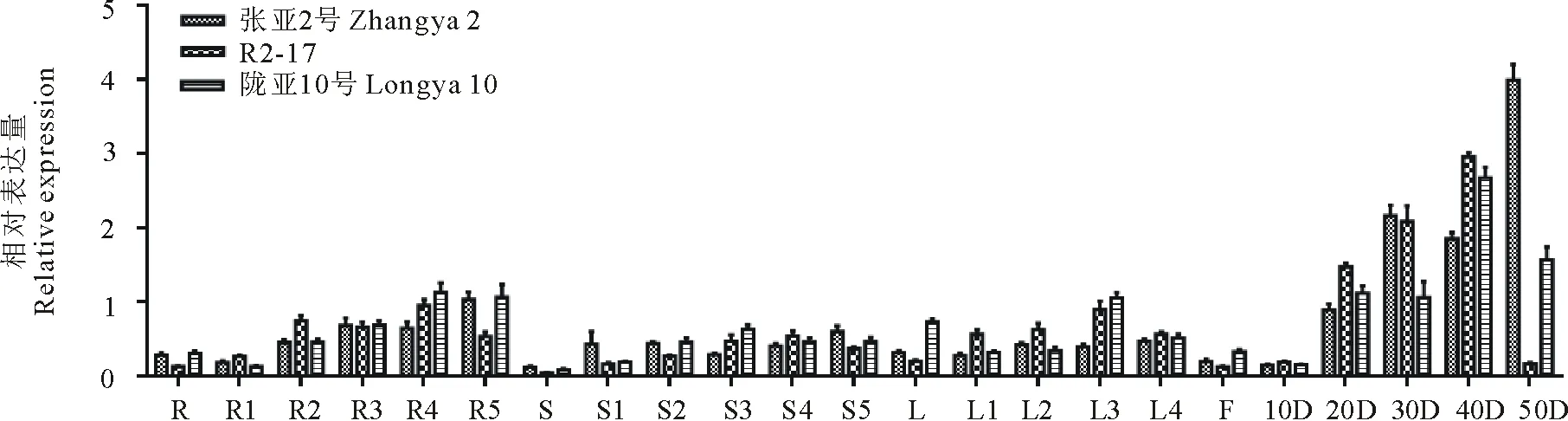
图5 DGAT2基因在3个胡麻品种不同发育阶段的根、茎、叶、花和种子中的相对表达量Fig.5 Relative expression level of DGAT2 gene in different developing roots, stems, leaves, flower and seeds stages of three flax varieties
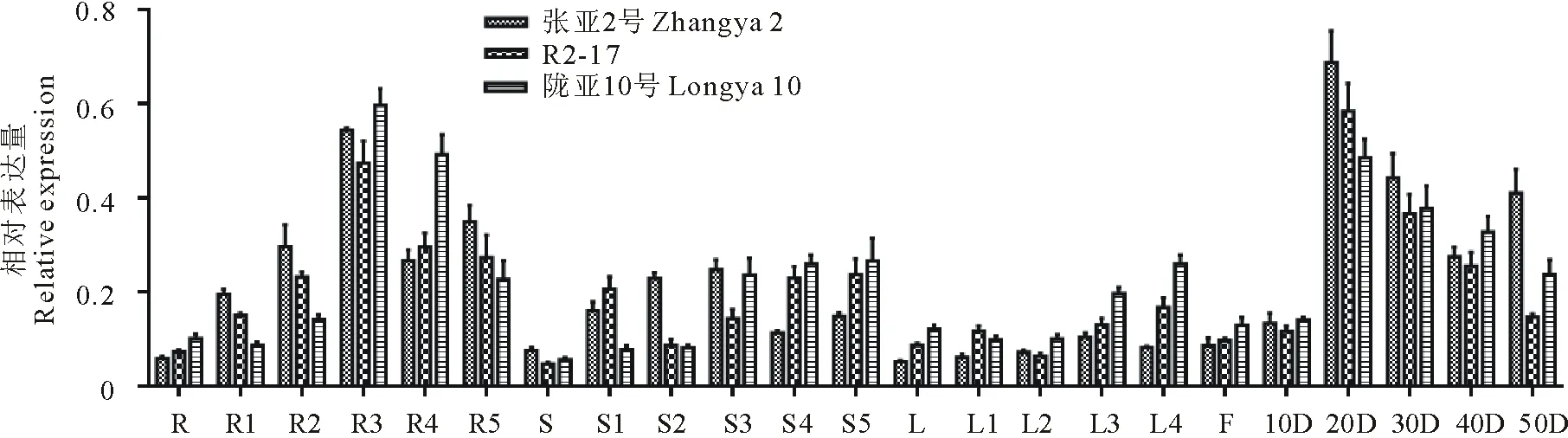
图6 PDAT1基因在3个胡麻品种不同发育阶段的根、茎、叶、花和种子中的相对表达量Fig.6 Relative expression level of PDAT1 gene in different developing roots, stems, leaves, flower and seeds stages of three flax varieties
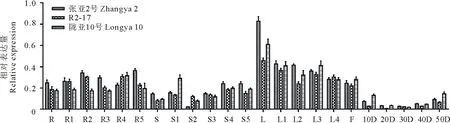
图7 PDAT2基因在3个胡麻品种不同发育阶段的根、茎、叶、花和种子中的相对表达量Fig.7 Relative expression level of PDAT2 gene in different developing roots, stems, leaves, flower and seeds stages of three flax varieties
2.3.4FAD2A和FAD3A基因表达分析FAD2A基因在各个组织中均有表达,开花后20 d的种子中表达量最高,在根、茎和叶中表达量很低。在种子中,开花后20 d,张亚2号中的表达量最高,陇亚10号次之,R2-17中最低(图8)。FAD3A基因的表达模式与FAD2A大致相同,但是在开花后20 d,张亚2号中的表达量最高,R2-17次之,陇亚10号中最低(图9)。
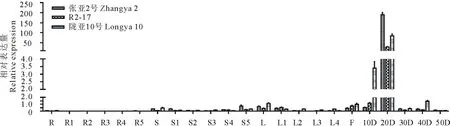
图8 FAD2A基因在3个胡麻品种不同发育阶段的根、茎、叶、花和种子中的相对表达量Fig.8 Relative expression level of FAD2A gene in different developing roots, stems, leaves, flower and seeds stages of three flax varieties
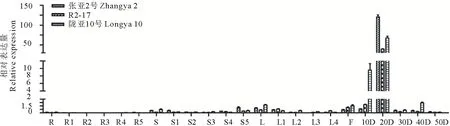
图9 FAD3A基因在3个胡麻品种不同发育阶段的根、茎、叶、花和种子中的相对表达量Fig.9 Relative expression level of FAD3A gene in different developing roots, stems, leaves, flower and seeds stages of three flax varieties
2.4 含油量和脂肪酸组分与相关基因表达量相关性分析
含油量、不饱和脂肪酸含量与相关基因表达量的关系如表3所示。含油量与亚麻酸含量呈极显著正相关(P≤0.01)。与含油量呈显著正相关的基因是DGAT1、DGAT2、PDAT1(P≤0.05),与亚麻酸呈显著正相关的基因是PDAT1(P≤0.05)。与含油量和亚麻酸都呈显著正相关的基因是PDAT1(P≤0.05)。DGAT1、DGAT2和PDAT1在张亚2号种子不同发育阶段的累积表达量显著高于R2-17和陇亚10号(图10和图11)。与PDAT1基因呈极显著正相关的是基因GPAT9和FAD2A(P≤0.01),与PDAT1呈显著相关的基因是FAD3A(P≤0.05)。油酸、亚油酸与亚麻酸呈负相关,PDAT1与油酸和亚油酸也呈负相关。
3 讨论
胡麻是中国尤其是北方非常重要的一种油料作物,也是亚麻酸含量很高的油料作物。研究表明,不同品种(系)的胡麻,其含油量和亚麻酸含量差异很显著。本研究结果表明,胡麻种子发育过程中,在开花后10~20 d,种子内油脂快速积累,高油材料张亚2号的油脂积累速率高于低油材料,且随着种子发育一直在升高。低油材料的种子发育后期,油脂的含量会有一定幅度的下降,表明了不同品种的油脂积累模式可能不同。低油材料在种子发育后期,可能由于脂肪降解酶表达量增高,脂肪快速降解用于植物种子的萌发,从而导致了含油量的小幅下降,这种现象在油料种子中是非常普遍的。在海甘蓝(Crambeabyssinica),烟草(Nicotianatabacum)和拟南芥种子成熟过程中也有类似的报道[34]。胡麻种子发育过程中各脂肪酸组分随着种子发育呈现一定变化规律,3个材料的亚油酸的积累呈下降趋势,亚麻酸的积累呈上升趋势。3个材料的亚麻酸含量同油脂积累的模式一样,都在开花后10~20 d增长迅速,高亚麻酸材料的积累一直在持续增高直到成熟期,低亚麻酸材料的积累在持续下降或在发育后期下降。由此可见,胡麻开花后10~20 d是油脂和亚麻酸积累的关键时期,不同品系的油脂和亚麻酸积累模式不相同,高油高亚麻酸品系中油脂和亚麻酸含量都在持续增高,低油低亚麻酸品系油脂和亚麻酸的积累在发育后期降低。

表3 含油量、脂肪酸组分与相关基因表达量相关性分析Table 3 Pearson’s correlation analysis between oil content, fatty acid and expression levels of related genes
注:“*”表示显著相关 (P≤0.05),“**”表示极显著相关 (P≤0.01)。表中,LIN:亚麻酸;LIO:亚油酸;OLE:油酸;GPAT:甘油-3-磷酸酰基转移酶;DGAT:酰基辅酶A:二酰基甘油酰基转移酶;PDAT:磷脂二酰基甘油酰基转移酶;FAD:脂肪酸去饱和酶。
Note:“*” indicates significant correlation (P≤0.05), “**” indicates extremely significant correlation (P≤0.01). LIN: linolenic acid; LIO: linoleic acid; OLE: oleic acid; GPAT: glycerol-3-phosphate acyltransferase; DGAT: acyl-CoA: diacylglycerol acyltransferase; PDAT: phospholipid: diacylglycerol acyltransferase; FAD: fatty acid desaturase.

图10 3个胡麻品种在种子成熟期的含油量及与含油量相关基因在种子发育阶段的累积表达量Fig.10 Total oil content and cumulative expression level of correlative genes of three flax varieties in seeds developing stage
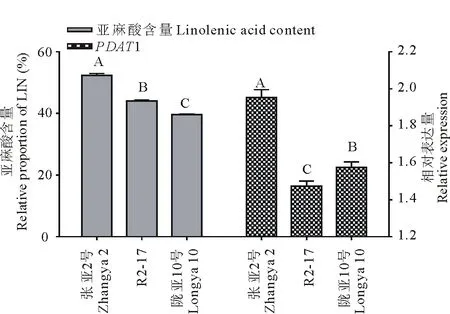
图11 3个胡麻品种在种子成熟期的亚麻酸及与亚麻酸相关基因PDAT1在种子发育阶段的累积表达量Fig.11 Linolenic acid content and cumulative expression level of correlative gene PDAT1 of three flax varieties in seeds mature stage
竖线表示标准误(SE,n=3)。不同大写字母代表不同材料间含油量与相关基因表达量的差异极显著(P≤0.01)。Bars represent standard error (SE,n=3). The different uppercase letters denote significance at 0.01 level.
对胡麻TAG合成代谢途径中关键基因表达分析结果表明,GPAT9、DGAT1&DGAT2、PDAT1&PDAT2和FAD2A&FAD3A从胡麻开花初期到成熟期的根、茎、叶、花和种子中都有表达,但表达模式有显著差异。除了PDAT2和GPAT9之外,其他基因在种子中的表达量都是很高的。通过相关性分析表明,与含油量和亚麻酸都呈显著正相关的基因是PDAT1(P≤0.05),这与Pan等[10]的研究结果一致。PDAT被认为是DGAT功能的补充,PDAT和DGAT共同发挥作用来催化合成TAG。DGAT1、DGAT2、PDAT1和PDAT2重组在酵母缺失突变体中表达时,都能恢复TAG的合成;外源添加ALA时,能刺激PDAT1和PDAT2的酶活性。胡麻中的PDATs具有将ALA装配到TAG中的独特功能,它能促进包含ALA酰基部分的TAG合成[10]。本研究中,PDAT1的表达模式与油脂和亚麻酸的积累模式一致,在高油高亚麻酸材料中,无论是在油脂和亚麻酸积累的快速期或成熟期,PDAT1的表达量都高于低油低亚麻酸材料。由此可见,PDAT1可能是影响胡麻不同品种(系)油脂和亚麻酸积累的关键基因。
与含油量呈显著正相关的基因还有DGAT1和DGAT2(P≤0.05)。有研究发现DGAT1基因突变体可限制野生型拟南芥的TAG合成,而过量表达DGAT1基因可增加种子含油率11%~28%[35]。在某些高油脂含量和特殊脂肪酸含量高的植物如油桐、蓖麻等中,DGAT2在植物油脂合成积累过程中呈现很高的表达量,在这些植物中DGAT2可能对于种子中TAG的积累作用比DGAT1更为重要。我们的研究结果也显示,DGAT2的表达量远远高于DGAT1和其他基因。DGAT1和DGAT2的表达模式一致,但在不同材料中表达模式差异显著。在高油高亚麻酸材料中,DGAT1和DGAT2的表达一直持续增高到成熟期;在低油低亚麻酸材料中,DGAT1和DGAT2的表达都是先增高,在发育后期降低。我们把3个品种(系)中与含油量和亚麻酸呈显著正相关的DGAT1、DGAT2和PDAT1基因在种子5个发育阶段的表达量累积起来比较,发现高油高亚麻酸材料中DGAT1、DGAT2和PDAT1的累积表达量显著高于低油低亚麻酸材料。
与PDAT1呈极显著正相关的基因有GPAT9和FAD2A(P≤0.01),呈显著正相关的基因有FAD3A(P≤0.05)。Shockey等[36]利用人工合成的miRNA使拟南芥GPAT9 (At5g60620)基因沉默,结果发现拟南芥种子含油量较野生型下降了26%~44%。我们发现GPAT9在开花初期的叶和发育后期的茎中含量最高,这与Kuo等[37]研究结果相似,该研究发现GPAT主要集中在叶片、形成和发育中的种子中表达。GPAT9在种子中的表达模式与PDAT1相似,在油脂的快速积累期有明显的表达量高峰,且高油材料中GPAT9的表达显著高于低油材料。与GPAT9的表达模式相似,PDAT2在开花初期的叶中表达最高,在整个种子发育阶段表达量都不高,远远低于其他基因的表达量,可能GPAT9和PDAT2在植物营养组织里有不同的生理功能。FAD2A和FAD3A在种子中的表达量远远高于其他基因,在亚麻酸的快速积累期表达量最高,且高亚麻酸材料中的表达量显著高于低亚麻酸材料。
4 结论
胡麻开花后10~20 d是油脂和亚麻酸的快速积累期,但不同品种(系)的油脂和亚麻酸的动态积累模式差异显著。高油高亚麻酸材料中油脂和亚麻酸的积累趋势在整个种子发育阶段都在持续增高;低油材料中油脂和亚麻酸的积累趋势在开花后20 d呈缓慢下降趋势;低亚麻酸材料中油脂和亚麻酸的积累趋势先增高,后下降。PDAT1、DGAT1和DGAT2这3个基因的动态表达模式与含油量的动态积累模式呈显著正相关,PDAT1的动态表达模式与亚麻酸含量的动态积累模式呈显著正相关, 且在高油高亚麻酸材料的种子动态发育阶段中PDAT1基因的累积表达量也显著高于低油低亚麻酸材料。PDAT1可能是影响胡麻不同品种(系)中含油量和亚麻酸含量的关键基因。
