羊痘病毒属病毒多重TaqMan MGB荧光定量PCR检测方法的建立
2019-01-22聂福平刘念源唐昌杰韩雪清王国民候长军李应国
聂福平,王 昱,刘念源,杨 俊,唐昌杰,韩雪清,王国民,陈 军,候长军,李应国*
(1.重庆出入境检验检疫局 检验检疫技术中心/国家牛病重点实验室/重庆市进境陆生动物疫病防控研究工程中心,重庆 江北 400020;2.重庆大学 生物工程学院, 重庆 沙坪坝 400030;3.中国检验检疫科学研究院,北京 100176;4.重庆市农业委员会,重庆 渝北 401120)
羊痘病毒属病毒(Capripoxvirus,CaPV)包括牛结节性皮肤病病毒(Lumpy skin disease virus,LSDV)、山羊痘病毒(Goatpoxvirus,GTPV)和绵羊痘病毒(Sheeppoxvirus,SPPV)3个成员,主要引起牛结节性皮肤病(Lumpy skin disease)。山羊痘(Goatpox)和绵羊痘(Sheeppox),是急性、热性、接触性的牛、羊等反刍动物重要传染病[1]。山羊痘和绵羊痘合称羊痘,是所有动物痘病中最为严重的一种,主要表现发热,无毛或少毛部位的皮肤或黏膜发生红斑、丘疹、疱疹、水泡等,发病后成年羊死亡率约40%,羔羊死亡率可达100%。LSDV引起牛结节性皮肤病(LSD),患牛主要表现皮肤、黏膜、器官表面广泛性结节,动物消瘦、流产、产乳急剧降低,严重时导致死亡,发病率3%~85%不等。CaPV极高的传染性及发病率,导致发病动物产奶量下降、消瘦、流产,甚至影响到羊毛和皮革,引起严重的经济损失。因此,羊痘和LSD均被世界动物卫生组织(OIE)将其列为必须申报名录疾病[2-3]。
LSD于1929年在赞比亚地区首次被发现,之后的50年在非洲广泛传播[4]。1989年在以色列暴发,证明该病已不局限于非洲[5]。2006年~2016年,该病已在亚洲、欧洲、北美洲等国家或地区迅猛传播,如俄罗斯、塞尔维亚、希腊、科威特、梦特内哥罗、哈萨克斯坦、纳米比亚等[6-11],造成了严重的经济损失。目前中国尚无LSD发病报道,但国内许多地方有羊痘发病的报道[12]。随着进口贸易的需要,各国迫切要求牛羊及其产品的输华,鉴于目前LSDV的流行趋势,我国急需储备相应的检测技术。
LSDV、GTPV和SPPV三者之间关系紧密,同源性高,由于该类病毒感染主要引起细胞免疫,对于再次感染或中和抗体水平低的动物,血清学方法较难确诊。痘病毒产生的抗体与牛丘疹性口炎、伪LSD等之间存在交叉反应,因此琼脂凝胶免疫扩散试验和免疫荧光抗体试验特异性较低。蛋白免疫印迹用于检测痘病毒具有较好的敏感性和特异性,但费时费力和操作困难使其实际应用中存在一定的局限性。因此血清学方法尚不能较好的鉴别LSDV、GTPV和SPPV。多重荧光定量PCR是一种特异性、敏感性和重复性均非常高的基因检测方法。由于CaPVs基因组A+T含量非常高,因此采用新型Taq-Man-MGB探针,MGB修饰基团能够将Tm值提高10℃左右,使在碱基组成不理想的条件下,较大提高探针的杂交特异性与稳定性。
本研究基于LSDV、GTPV和SPPV的两端反向末端重复序列区(ITR),设计特异的引物和探针,首次建立了基于TaqMan MGB荧光定量PCR技术的CaPV多重荧光定量PCR方法,该方法操作简单、快速、特异、敏感、重复性好,可同步鉴别检测CaPV,为CaPVs的高通量鉴别检测奠定了基础。
1 材料与方法
1.1 病毒株LSDV野毒株(NI-2490)核酸由法国Emmanuel Albina博士惠赠;LSDV疫苗株(LW-1959)购自南非(Bio Onderstepoort);GTPV疫苗株(CVCC AV41)、SPPV疫苗株(CVCC AV42)购自中国兽医药品监察所;牛痘病毒(CPV)、猪痘病毒(SPV)均购自美国ATCC。蓝舌病病毒(BTV)RNA和小反刍兽疫病毒(PPRV)RNA由云南出入境检验检疫局技术中心艾军博士惠赠。
1.2 主要试剂Min BEST Viral RNA/DNA Extraction Kit、2×PremixExTaqTM(Probe qPCR)、pMD19-T载体、DNA Marker(DL2000)、胶回收试剂盒均购自TaKaRa公司;E.Z.N.A.RBacterial DNA Kit购自OMEGA公司;Regular Agarose G-10购自Biowest公司。
1.3 引物和探针的设计与合成根据GenBank中登录的LSDV、GTPV、SPPV等痘病毒的全基因序列,分析比对,设计扩增其ITR区域,构建阳性重组质粒标准品的通用引物(F:5'-TTGTCAGAAACG AGG-3'/R:5'-ATGCCTCACTTGTATTTGG-3')、荧光检测通用引物(P1:5'-CCACCCCAATATTCTGCTG C-3/P2:5'-ACATTAGGGAATCATGTGCAGTGA-3')和特异的检测探针(LSDV:5'-(VIC)-TCTTGCTA AAATGCCA-MGB-3'、GTPV:5'-(FAM)TCTTGCTA AAATACC-MGB-3'和 SPPV:5'-(NED)CTTGCTAA AATTCCA-MGB-3')。引物和探针均由上海英维捷基生物有限公司合成。
1.4 重组质粒标准品的构建按照Mini BEST ViralRNA/DNA Extraction Kit说明提取 LSDV、GTPV、SPPV疫苗DNA,PCR扩增目的基因。按照DNA Purification Kit说明书步骤,回收纯化PCR产物,将其克隆于pMD19-T载体中,构建重组质粒标准品。利用分光光度计测定重组质粒的OD260nm/OD280nm比值和浓度,根据公式:阳性质粒拷贝数(拷贝/μL)=(质粒浓度×10-9×稀释倍数×6.02×1023)/(660 道尔顿 /碱基×碱基数),计算重组质粒拷贝数并作为荧光定量PCR阳性标准品。
1.5 反应条件的优化及标准曲线的建立采用Premix ExTaqTM(Probe qPCR)推荐的 20 μL体系。在已建立的单一荧光定量PCR基础上,采用正交试验的方法,分别对引物、探针浓度、退火温度(58℃、60℃、62℃)等进行优化。分别以10倍连续稀释后的阳性标准品质粒为模板,利用优化后的多重荧光定量PCR方法,建立标准曲线。
1.6 特异性试验根据试剂盒说明书提取LSDV、GTPV、SPPV、CPV、SPV的基因组DNA和 BTV、PRV的总RNA,以提取的上述病毒基因组DNA以及BTV、PPRV总RNA反转录的cDNA为模板,利用建立的CaPV多重荧光定量PCR方法进行PCR扩增,同时设立阴性对照,验证该方法的特异性。
1.7 敏感性试验将构建的阳性质粒标准品进行10倍倍比稀释,100拷贝 /μL~107拷贝 /μL共稀释8个梯度,将其作为模板,进行荧光定量PCR检测,验证该方法的敏感性。
1.8 重复性试验选取 104拷贝 /μL、105拷贝 /μL、106拷贝/μL、107拷贝/μL 4个浓度的标准品,分别进行荧光定量PCR反应,每个浓度重复3次,评价该方法的稳定性与重复性,并计算组内变异系数。将该阳性标准品质粒置于-20℃保存,每隔1周进行上述重复试验,计算其组间变异系数。根据变异系数判断该方法的可重复性。
1.9 临床样品的检测采用建立的多重荧光定量方法、OIE推荐常规PCR和病毒分离鉴定方法,对185份疑似发病羊病变组织和67份模拟临床样品进行检测,比较3种方法的检测准确性。67份模拟临床样品的制备:取52份牛血清样品,15份羊抗凝血,每份含1 mL牛血清或羊抗凝血,分别添加相同浓度不同体积的LSDV、GTPV、SPPV弱毒疫苗液,其中40份为阳性,27份为模拟阴性,混匀后提取核酸,对病毒核酸进行检测。
2 结果
2.1 重组质粒标准品的制备以设计的通用引物对LSDV、GTPV、SPPV核酸 DNA进行普通 PCR扩增,结果显示,扩增产物大小约250 bp,与预期大小(247 bp)相符(图1)。将目的基因克隆于pMD19-T载体中,构建重组质粒标准品pMD-LSDV、pMDGTPV和pMD-SPPV,经紫外分光光度计测定,LSDV 浓度为 4.7 μg/mL,拷贝数为 1.48×109拷贝 /μL;GPPV浓度为 10.6 μg/mL,拷贝数为 3.29×109拷贝/μL;SPPV 浓度为 8.6 μg/mL,拷贝数为 2.67×109拷贝 /μL。

图1 LSDV、GTPV和SPPV的PCR扩增产物Fig.1 Amplifications of the specific fragments from LSDV,GTPV,and SPPV by PCR
2.2 多重荧光定量PCR反应体系和条件优化结果利用 Premix ExTaqTM(Probe qPCR)试剂盒进行荧光定量PCR反应,采用正交试验的方法得出最适的引物和探针浓度,最佳退火温度。优化后的反应体系为 20 μL:2×Premix ExTaqTM8 μL,LSDV 探针(10 μM)0.6 μL,GTPV 探针(10 μM)0.3 μL,SPPV探针(10 μM)3.0 μL,P1(10 μM)、P2(10 μM)各1.6 μL,DNA模板各 1 μL,其余 ddH2O补齐。最佳反应条件为:95℃ 30 s;95℃ 5 s,60℃ 34 s LSDV(VIC),GTPV(FAM),SPPV(NED),40 个循环。
2.3 多重荧光定量PCR标准曲线的建立以不同浓度不同病毒的质粒标准品为模板,利用优化后的反应条件进行扩增,以Ct值为纵坐标,不同标准品梯度稀释的拷贝数的对数为横坐标获得标准曲线,标准曲线的相关系数均大于0.999(R2>0.999),LSDV标准曲线方程为:Y=-3.32+29.61,R2=0.99937;GTPV标准曲线方程为:Y=-3.23+32.6,R2=0.99902;SPPV标准曲线方程为:Y=-3.24+33.03,R2=0.99907(图2)。结果显示:荧光定量PCR在梯度稀释度范围内(102拷贝 /μL~107拷贝 /μL)呈现良好的线性关系,依据标准曲线可以从样品扩增的Ct值即可推算出对应模板DNA的精确拷贝数,进而对样品DNA进行定量分析。

图2 多重荧光定量PCR的标准曲线Fig.2 The standard curves of the real-time PCR
2.4 特异性试验结果应用建立的多重荧光定量PCR方法对相关病毒的核酸进行扩增,结果显示:该方法仅对LSDV、GTPV和SPPV的核酸有特异性扩增,对CPV、SPV、BTV、PPRV等病毒核酸均无扩增荧光信号(图3),表明该方法具有良好的特异性。
2.5 敏感性试验结果将构建的3种阳性质粒标准品进行 10倍倍比稀释,100拷贝 /μL~107拷贝 /μL共稀释8个梯度,将其作为模板,进行多重荧光定量PCR的敏感性检测,结果显示:本研究建立的多重荧光定量PCR方法对LSDV、GTPV及SPPV核酸的最低检测限分别为 1.48×101拷贝 /μL、3.29×101拷贝 /μL 和 2.67×101拷贝 /μL(图 4)。

图3 多重荧光定量PCR特异性试验结果Fig.3 Specificity test of the multiplex real-time PCR
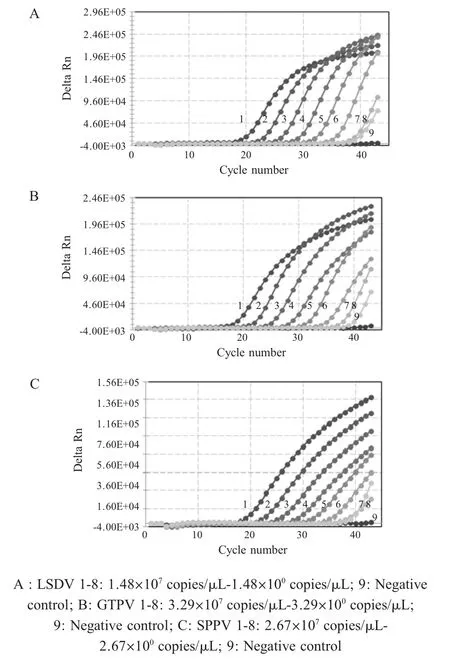
图4 多重荧光定量PCR的敏感性试验结果Fig.4 The sensitivity test of the real-time PCR for the detection of LSDV,GTPV and SPPV
2.6 重复性试验结果对不同浓度和批次的阳性质粒标准品进行荧光定量PCR检测。结果显示,组内变异系数为0.22%~0.67%,组间变异系数为0.62%~1.27%(表1),表明该检测方法重复性良好。
2.7 临床及模拟样品检测对185份临床样品和67份模拟临床样品进行不同方法比对检测,结果显示:本研究建立的多重荧光定量PCR法、OIE推荐的普通PCR法和病毒分离均未从185份临床样本中检出LSDV、GTPV和SPPV阳性样品。从模拟的多重病原混合样品中,多重荧光定量PCR方法检出40份阳性,与预期结果一致;OIE常规PCR检出36份阳性,有4份添加低浓度的3种病原混合样品未检出(表2)。同时,将检出的阳性样品进行测序,测序结果与荧光定量PCR检测结果的阳性率完全符合,表明该方法可以有效避免普通PCR检测中的假阴性结果,适用于CaPV的临床样品鉴别检测,且敏感性较高。

表1 多重荧光定量PCR批内和批间重复性试验结果Table 1 The Reproducibility test of intra-and inter-assay of the real-time PCR
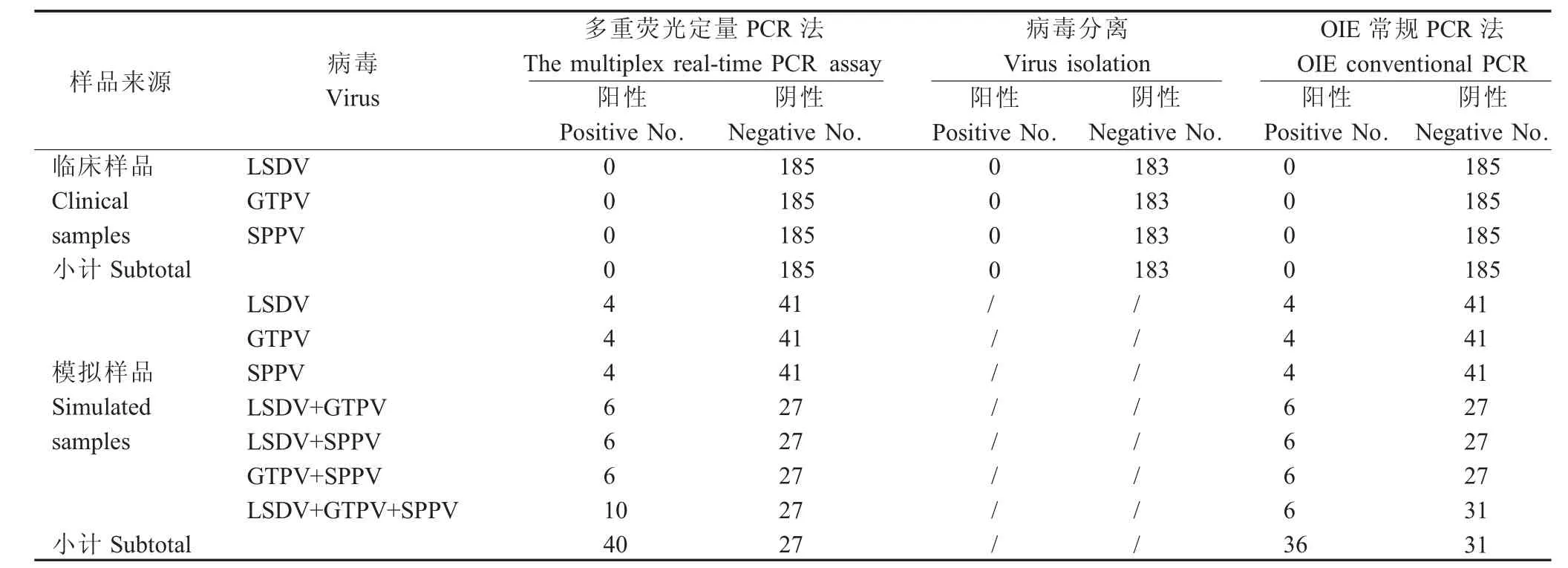
表2 临床及模拟样品方法比对检测结果Table 2 Comparative analysis of clinical samples and simulated samples
3 讨论
山羊痘、绵羊痘和LSD是牛羊重要的烈性传染病,分别由羊痘病毒属的GTPV、SPPV和LSDV引起。LSDV、GTPV和SPPV三者之间关系紧密,同源性极高,LSDV全基因核苷酸序列与SPPV和GTPV的同源性可高达95%~97%,SPPV与GTPV同源性为97%。无论是病毒形态、理化特性、血清学和抗原性均难以区分这3种病毒,因此有学者将LSDV、GTPV和SPPV通称为“羊痘病毒”。SPPV和GTPV基因组大小为143 kb~147 kb,含有 147个开放阅读框(ORFs),包含中间编码区(CCR)和两端相同的 ITR。LSDV基因组约 151 kb,有 156个ORFs,包括SPPV和GTPV全部基因组,但LSDV还有一个额外基因,该基因在SPPV和GTPV是非功能性的,可能与LSDV的宿主特异性有关[13-15]。Kotwal研究表明CCR是痘病毒科保守区;ITR在羊痘病毒属中同源性高,但与其他痘病毒相似性低[16]。因此,本研究选择引物设计区域为ITR,特异性好。
多重荧光定量PCR是一种特异性、敏感性和重复性均非常高的基因检测方法。但由于CaPVs基因组A+T含量非常高,因此采用新型TaqMan-MGB探针,MGB基团能有效增加探针的解链温度,将Tm值提高10℃左右,较大提高探针的杂交特异性与稳定性,解决了普通TaqMan探针需要设计较长的探针、有时特异性不强的弊端。本研究采用MGB探针原理,通过对引物浓度、探针浓度、反应条件的优化,保证了最佳扩增效果。通过对185份临床样本和67份模拟样本的检测,检测结果的准确性比普通PCR高,操作比病毒分离简便。本研究建立的多重荧光定量PCR方法可快速的鉴别检测羊痘病毒属的3种痘病毒,OIE陆生动物诊断(2017)手册推荐的普通PCR方法仅适用于羊痘病毒通用检测,不能直接鉴别LSDV、GTPV和SPPV,需通过再次测序分析比较。因此,本研究建立的多重TaqMan-MGB荧光定量PCR方法可同步鉴别检测CaPV,具有特异、敏感、简便、快速的特点。
本研究首次建立了单管同步鉴别检测CaPV的多重荧光定量PCR方法,为国内监测CaPV,口岸防控LSD入侵和对CaPV的研究提供了特异、敏感、简便快速的技术手段。
