术前新辅助化疗对宫颈癌患者手术切除病灶内恶性分子表达的影响
2019-01-22刘志文冯慧芳夏丽伟吴又明林晓岚
刘志文,冯慧芳,夏丽伟,吴又明,林晓岚
随着近年来健康体检的推广及普及、宫颈癌的早期诊断率得到了较大提高,临床分期≤Ⅱa期的宫颈癌预后较好。在临床分期≤Ⅱa期的宫颈癌中,Ⅰb2和Ⅱa2属于局部晚期肿瘤,相比Ⅰb1期和Ⅱa1期80%以上的5年生存率,局部晚期宫颈癌手术切除后的复发率和转移率较高[1]。宫颈癌细胞增殖和侵袭所造成的癌细胞局部浸润是导致手术切除后微病灶残留的重要因素,也直接增加了术后转移及复发的风险。新辅助化疗是针对中晚期恶性肿瘤提出的治疗策略,通过术前全身或局部应用化疗药物来杀伤肿瘤细胞、降低肿瘤分期,进而为手术切除病灶创造有利条件。近年来,也有研究报道了新辅助化疗用于局部晚期宫颈癌的价值,在手术切除的基础上使用新辅助化疗能够有效延长患者的无瘤生存时间[2],但关于新辅助化疗对局部晚期宫颈癌病灶内癌细胞恶性生物学特征的影响尚未明确。在本研究中,笔者具体分析了术前新辅助化疗对局部晚期宫颈癌患者手术切除病灶内恶性分子表达的影响,报道如下。
1 资料与方法
1.1 临床资料 选择2015年3月—2017年6月期间在南方医科大学附属小榄医院妇产科诊断为Ⅰb2和Ⅱa2期宫颈癌的患者作为研究对象,所有患者均经病理学活检诊断为宫颈鳞癌,结合影像学检查判断FIGO分期为Ⅰb2和Ⅱa2期;排除既往有其他恶性肿瘤病史、入组前接受过放化疗的患者。共纳入118例患者,采用随机数字表法分为试验组和对照组,每组各59例。试验组在接受新辅助化疗后进行手术切除,年龄39~49(42.8±5.2)岁;Ⅰb2期32例,Ⅱa2期27例;病灶直径2.7~5.5( 4.2±0.6)cm。对照组患者直接进行手术切除,年龄37~47(43.2±5.5)岁;Ⅰb2期34例,Ⅱa2期25例;病灶直径2.5~5.3(4.5±0.7)cm。2组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审查批准,患者及家属知情同意并签署知情同意书。
1.2 治疗方法 试验组患者按照紫杉醇+顺铂的方案进行新辅助化疗,化疗前6 h和12 h均给予地塞米松10 mg肌肉注射,而后给予紫杉醇175 mg/m2,d 1,静脉滴注,顺铂100 mg/m2,d 1~3,静脉滴注,21 d为1个周期,共进行2个周期。化疗结束后2~3周,复查肝肾功能排除手术禁忌证后进行手术切除治疗。对照组患者不行新辅助化疗,直接进行手术切除治疗。
1.3 病灶恶性分子表达量的测定 取2组患者手术切除的肿瘤病灶适量送深圳华大基因科技有限公司,采用RNA提取试剂盒分离病灶内RNA,采用cDNA合成试剂盒将RNA样本反转录为cDNA,最后用PCR试剂盒配置反应体系:cDNA 2 μl、反应混合液10 μl、引物混合液0.8 μl、去离子水7.2 μl。将配置好的反应体系放置在PCR仪上进行反应,得到反应曲线后自动生成循环阈值(Ct),根据公式2-ΔΔCt计算促增殖分子[Ki-67、人细胞周期相关激酶(CCRK)、细胞周期蛋白B1(CyclinD1)、细胞周期蛋白依赖性激酶1(CDK1)、Polo样激酶1(Plk1)、生成素(Survivin)]、抑癌基因[多亮氨酸重复区免疫球蛋白样蛋白1(LRIG1)、p16基因、真核起始因子4E3(eIF4E3)、N-myc下游调节基因4(NDRG4)、Ras相关结构域因子2A(RASSF2A)、增强子结合蛋白1(Ebp1)]及侵袭基因[β-连环蛋白(β-catenin)、基质金属蛋白酶-8(MMP-8)、解聚素—金属蛋白酶19(ADAM19)、金属蛋白酶组织抑制剂1(TIMP1)、E-钙黏蛋白(E-cadherin)]的表达量。
2 结 果
2.1 促增殖分子表达量的比较 结果显示,试验组患者的宫颈癌病灶内Ki-67、CCRK、CyclinB1、CDK1、Plk1、Survivin的mRNA表达量显著低于对照组,2组间比较差异有统计学意义(P<0.01),见表1。
2.2 抑癌基因表达量的比较 结果显示,试验组患者的宫颈癌病灶内LRIG1、p16、eIF4E3、NDRG4、RASSF2A、Ebp1的mRNA表达量显著高于对照组,2组间比较差异有统计学意义(P<0.01),见表2。
2.3 侵袭基因表达量的比较 结果显示,试验组患者的宫颈癌病灶内β-catenin、MMP-8、ADAM19的mRNA表达量显著低于对照组,TIMP1、E-cadherin的mRNA表达量显著高于对照组,2组间比较差有统计学意义(P<0.01),见表3。

表1 2组宫颈癌病灶内Ki-67、CCRK、CyclinB1、CDK1、Plk1、Survivin表达量的比较
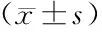
表2 2组宫颈癌病灶内LRIG1、p16、eIF4E3、NDRG4、RASSF2A、Ebp1表达量的比较

表3 2组宫颈癌病灶内β-catenin、MMP-8、ADAM19、TIMP1、E-cadherin表达量的比较
3 讨 论
Ⅰb2和Ⅱa2期宫颈癌被定义为局部晚期宫颈癌,Ⅰb2期是指肿瘤病灶局限于宫颈且病灶最大直径超过4 cm,Ⅱa2期是指肿瘤病灶超出子宫颈并累及阴道、但未达到阴道下1/3且无宫旁浸润。相比Ⅰb1及Ⅱa1宫颈癌,Ⅰb2和Ⅱa2期宫颈癌病灶内癌细胞的增殖和侵袭能力较强,存在较为显著的局部微浸润,手术切除后容易残留微病灶并增加局部复发及远处转移的风险,Ⅰb2和Ⅱa2期宫颈癌的预后也相对较差。近年来,新辅助化疗被越来越多地用于恶性肿瘤的辅助治疗,术前通过全身或局部使用化疗药物来杀伤癌细胞,进而能够缩小肿瘤体积及微浸润范围,同时也能在一定程度上减轻盆腔充血程度、松动肿瘤邻近的宫旁组织,有利于手术对病灶的彻底切除[3-4]。已有研究报道,新辅助化疗用于局部晚期宫颈癌能够提高总生存率、延长无瘤生存时间[5],但关于新辅助化疗对局部晚期宫颈癌病灶内增殖、侵袭等恶性生物学行为的影响尚未明确。
宫颈癌病灶的生长与病灶内癌细胞活跃的增殖密切相关,而癌细胞的增殖又受到了多种促增殖分子的调控。Ki-67是细胞核内与细胞增殖活力直接相关的抗原,参与了细胞增殖过程中DNA复制的调控[6]。CCRK是参与细胞周期正性调控的上游分子,能够催化下游信号分子的磷酸化并增加多种细胞周期蛋白的活化。CyclinB1及其激酶CDK1受到细胞周期相关激酶(CCRK)的调控,在CCRK作用下发生活化的CyclinB1及CDK1能够形成复合体,进而加速细胞周期通过G2/M检查点并进入有丝分裂阶段,有助于促进细胞增殖[7]。Plk1是新发现的一类丝氨酸/苏氨酸激酶,同样能够促进CyclinB1/CDK1复合体的形成,进而加速细胞周期、促进细胞增殖。Survivin是抗凋亡蛋白家族中活性最强的成员,能够与凋亡级联激活通路中的多种Caspase分子结合并拮抗其活性,进而阻碍细胞凋亡过程的进展并为细胞增殖创造有利条件[8]。笔者通过分析宫颈癌病灶内以上促增殖分子表达量的改变发现:与对照组比较,试验组患者的宫颈癌病灶内Ki-67、CCRK、CyclinB1、CDK1、Plk1、Survivin的mRNA表达量显著降低。这就说明新辅助化疗能够减少局部晚期宫颈癌病灶内多种促增殖分子的表达,进而抑制癌细胞的增殖。
宫颈癌病灶内癌细胞的增殖不仅与促增殖分子表达的上调有关,同时还与多种具有促凋亡及增殖抑制效应的抑癌基因的低表达或表达缺失有关。LRIG1是新发现的宫颈癌相关抑癌基因,其编码产物是一类跨膜蛋白,能够对多种生长因子所介导的细胞生长效应产生抑制作用,进而诱导细胞发生凋亡[9]。p16又称为MTS1,在细胞周期中能够使多种细胞周期蛋白相关激酶的活性发生抑制,进而限制细胞周期的发展并诱导细胞发生凋亡[10-11]。eIF4E3是一类真核细胞内的翻译起始因子,具有潜在的抑癌活性,主要通过阻碍细胞周期来产生抑癌作用[12-13]。NDRG4是N-myc调控通路的下游分子,能够对PI3K/AKT通路的激活产生抑制作用,进而减弱由该通路所介导的细胞增殖。RASSF2A是RAS信号转导过程中的负性调控分子,具有RAS相关结构域,能够阻碍RAS所介导的增殖效应并促进细胞发生凋亡[14]。Ebp1是一类ErbB-3胞内结合蛋白,在外界理化因素的刺激下会与ErbB-3分离并向细胞核内移位,进而对细胞的增殖产生抑制作用[15-16]。笔者通过分析宫颈癌病灶内以上抑癌基因表达量的改变发现:与对照组比较,试验组患者的宫颈癌病灶内LRIG1、p16、eIF4E3、NDRG4、RASSF2A、Ebp1的mRNA表达量显著降低。这就说明新辅助化疗能够增加局部晚期宫颈癌病灶内多种抑癌基因的表达,进而促进癌细胞的凋亡。
宫颈癌细胞在增殖的基础上向邻近组织及脉管系统的侵袭是造成肿瘤局部浸润及远处转移的重要生物学行为,多种侵袭调控分子与之密切相关。Wnt通路是细胞内调控蛋白酶表达、影响细胞侵袭活力的重要信号通路,在Wnt通路处于静息状态时,下游分子Frizzled蛋白、GSK-3β以及β-catenin形成复合体并对β-catenin产生水解作用;当Wnt通路发生激活时,β-catenin复合体解离、其受到的水解作用也相应减弱,进而造成β-catenin在细胞内聚集并不断向细胞核内转位[17-18]。在β-catenin进入细胞核后,能够启动MMP-8、ADAM19等多种蛋白酶的表达。MMP-8是重要的基质金属蛋白酶,而ADAM19则兼具解聚素及金属蛋白酶活性,两者对细胞外基质内的多种成分具有水解作用,进而能够促进细胞突破细胞外基质的限制并呈浸润性生成的态势。TIMP1是蛋白酶活性的直接抑制分子,能够使蛋白酶的水解活性减弱并抑制细胞的侵袭;E-cadherin则是上皮细胞的标志分子,有助于细胞间形成紧密连接并阻碍细胞的运动及侵袭[19-20]。笔者通过分析宫颈癌病灶内以上侵袭基因表达量的改变发现:与对照组比较,试验组宫颈癌病灶内β-catenin、MMP-8、ADAM19的mRNA表达量显著降低,TIMP1、E-cadherin的mRNA表达量显著升高。这就说明新辅助化疗能够调节局部晚期宫颈癌病灶内多种侵袭基因的表达,减少促侵袭基因表达、增殖侵袭抑制基因表达并阻碍癌细胞的侵袭过程。
综上所述,术前新辅助化疗能够抑制宫颈癌病灶内促增殖分子及促侵袭基因的表达,促进抑癌基因及侵袭抑制基因的表达,具有积极的临床应用价值。
利益冲突:无
作者贡献声明
刘志文、冯慧芳:研究方案设计,论文撰写,实施研究;夏丽伟:论文审核;吴又明、林晓岚:统计学分析
