LncRNA H19对脂多糖诱导的脓毒症中microRNA-107表达的影响
2019-01-21马成龙刘波黄柯冰
马成龙,刘波,黄柯冰
(1.汉中市人民医院重症医学科;2.汉中市人民医院麻醉科;3.汉中市中心医院麻醉科,陕西 汉中 723000)
脓毒症是机体经严重创伤、烧伤、感染以及大手术后出现的全身炎症性疾病,并常常伴随多器官衰竭[1]。脓毒症诱导的过度炎症反应、免疫抑制或过度组织损伤可增加对继发感染的易感性[2],因此,探讨与脓毒症诱导的炎症反应相关分子及机制至关重要。研究表明,长链非编码RNA(lncRNAs)在炎症反应、类风湿性关节炎、血管衰老和癌症等发生发展中具有重要调控作用[3-4],lncRNA IL-17R参与细菌内毒素脂多糖(LPS)诱导的炎症反应[5],lncRNA HOTAIR促进LPS诱导的脓毒症小鼠中TNF-α的产生[1]。LncRNA H19作为致癌基因,通过与miRNA相互作用促进癌症的发生和转移[6-7]。H19可促进上皮细胞向间充质细胞转变,lncRNA H19可和miRNA相互作用,H19可能是水通道蛋白3(AQP3)上miRNA的一种竞争性内源RNA(ceRNA)[8],而此机制在免疫系统中起重要作用。然而,关于AQP、miRNA和H19的相互作用机制,及其在脓毒症中的作用报道甚少。本研究旨在探讨AQP1,miR-107和H19在LPS脓毒症和炎症反应中的潜在机制。
1 材料与方法
1.1 患者和血清样本
经本院伦理委员会批准,选取2017年1月至2018年1月汉中市人民医院收治的15例脓毒症患者作为脓毒症患者组,其中女性6例,男性9例,平均年龄(69.3±9.7)岁。所有脓毒症患者均经临床及体液病原体培养确诊。选取同期同医院的健康体检者15名为健康对照组,其中男性10名,女性5名,平均年龄(61.2±10.4)岁。所有受试者均签订知情同意书。脓毒症患者于确诊后第2天采取空腹静脉血,离心后收集血浆和血清样本以备后续实时定量PCR和ELISA分析。
1.2 细胞培养及LPS干预
人293T细胞系购自美国ATCC公司。将细胞培养在含有10%的胎牛血清(美国Sigma公司)的DMEM培养基(美国Sigma公司)中,在37 ℃、5%CO2的条件下预培养24 h。对一部分细胞进行LPS干预,将细胞种植于6孔板并培养48 h后,于培养基中添加1 g/mL的LPS,对照组添加生理盐水,相同条件下培养12 h。收获细胞用于后续实验。
1.3 细胞转染
严格按照说明书进行操作,构建pcDNA3.1/H19过表达质粒。采用脂质体3000(美国Invitrogen公司)将pcDNA3.1/H19(pc-H19)与其阴性对照(pc-NC)转染入LPS诱导的293T细胞中。转染后48 h收集细胞,实时定量PCR检测转染效率。
1.4 实时定量PCR
按照说明书,采用Trizol试剂(美国Invitrogen公司)从血浆样本或者细胞中分离总RNA。随后用反转录试剂盒(美国Invitrogen公司)将RNA反转录为cDNA。LightCycler 480 SYBR Green I Master Mix(美国Invitrogen公司)检测mRNA的表达。2-ΔΔCt方法进行数据分析。Primer Designing Tool在线软件设计引物,见表1。

表1 引物设计
1.5 ELISA检测
按照说明书,采用TNF-α、IL-1β和IL-6的ELISA试剂盒(上海酶联公司)检测血清样本和细胞中TNF-α、IL-1β和IL-6的水平。
1.6 荧光素酶报告分析
采用Diana LncBase (www.microrna.gr/LncBase)和StarBase(http://starbase.sysu.edu.cn/)在线预测软件预测lncRNA靶向miRNA。采用TargetScan (http://www.targetscan.org/)和miRDB (http://mirdb.org) 在线预测软件预测miRNA靶基因。采用双荧光素酶报告分析试剂盒(美国Promega公司)检测lncRNA H19-miR-107-AQP1级联反应的相互作用。采用脂质体3000(美国Invitrogen公司)将miR-107类似物及其阴性对照(miR-NC)、H19-wt/mut、pc-H19与其阴性对照(pc-NC)、Pgl3-AQP1-3′-UTR-wt转染入人293T细胞中,转染后48 h检测荧光素酶活性。
1.7 统计学分析
2 结果
2.1 血浆H19、miR-107和AQP1的表达比较
取健康对照组血浆H19、miR-107和AQP1的mRNA的相对表达值为1,脓毒症患者组血浆中H19,miR-107和miR-107的相对表达则分别为(0.234±0.035)、(2.906±0.151)和(0.419±0.045),两组间比较,差异均有统计学意义(均P<0.01)。相关性分析结果显示,H19与miR-107的表达呈负相关(r2=0.757 2,图1A),H19和AQP1的表达呈正相关(r2=0.839 5,图1B),miR-107和AQP1的表达呈负相关(r2=0.760 4,图1C),见图1。

2.2 血清促炎因子比较
与健康对照组比较,TNF-α、IL-6和IL-1在脓毒症患者血清中的水平显著升高(均P<0.01),见表2。

表2 两组血清中TNF-α、IL-6和IL-1水平比较(pg/mg)
*P<0.01,与健康体检者比较。
2.3 体外研究lncRNA H19对LPS诱导的炎症反应的调控
与空白对照组相比,LPS降低H19和AQP1的表达(均P<0.05),增加miR-107的表达(P<0.01),提高促炎症因子TNF-α、IL-6和IL-1的水平(均P<0.01)。与pc-NC转染入LPS诱导的293T细胞组对比,pc-H19增加LPS诱导的H19和AQP1的表达(P值均<0.01),降低LPS诱导的miR-107的表达(P<0.01),降低LPS诱导的TNF-α、IL-6和IL-1的水平(均P<0.01),见图2。
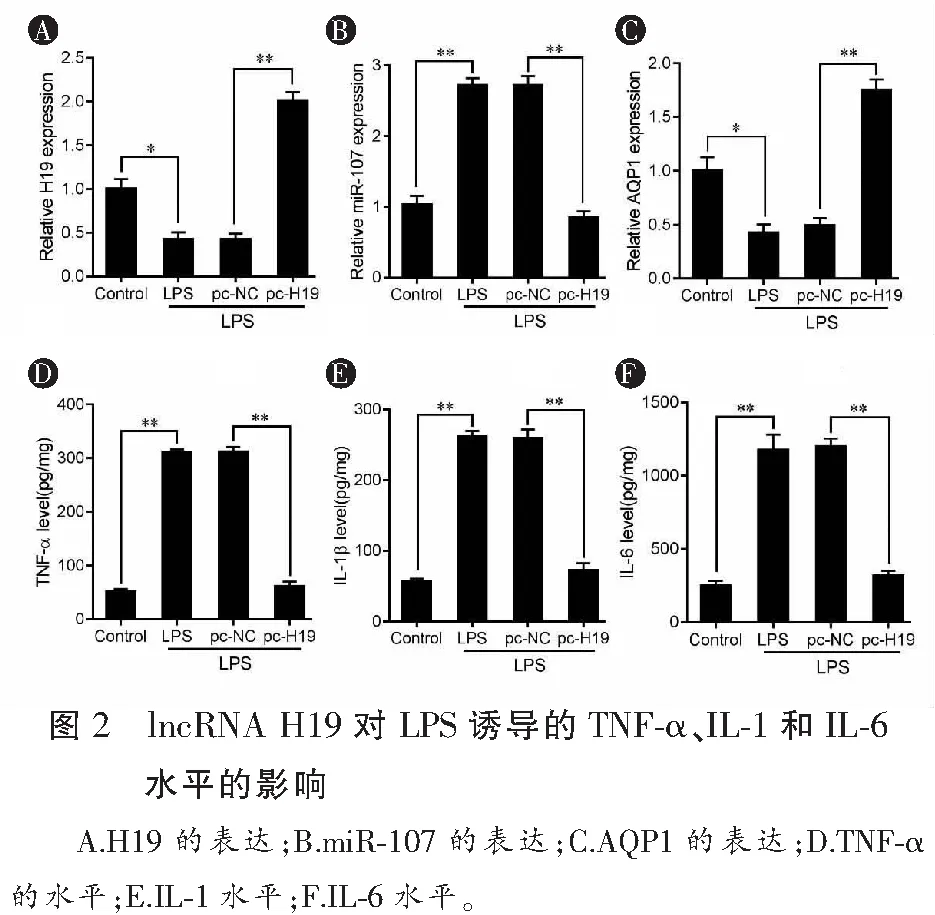
2.4 H19-miR-107-AQP1级联反应的相互作用
经lncRNA靶向miRNA在线软件预测分析,lncRNA H19与miR-107有2个结合位点(图3A中只列出一个),且荧光素酶报告分析显示,miR-107与lncRNA H19 wt结合时的荧光素酶活性显著低于miR-107与lncRNA H19 mut结合时(P<0.01)。与单独转染AQP1-3’UTR相比,AQP1-3’UTR和miR-107共转染显著抑制荧光素酶活性(P<0.01)。在AQP1-3’UTR和miR-107共转染的细胞中,同时转染入pc-NC对荧光素酶的活性无影响,但是转染入pc-H19可显著提高荧光素酶的活性(P<0.05),见图3-图4。


3 讨论
本研究采用临床样品和体外细胞模型研究LncRNA H19在脓毒症炎症反应中的表达和作用机制。实验证实脓毒症患者血浆中H19表达减少,并伴有miR-107表达上调和AQP1表达下调,以及血清促炎症因子释放增加。在LPS诱导的人293T细胞中检测到类似的结果。然而,H19过表达显著逆转LPS诱导的miR-107和AQP1表达失调,下调LPS诱导的促炎症因子的水平。
由于脓毒症常常伴随多器官衰竭以及炎症反应失调,因此探讨miR-107在炎症反应中的作用有助于了解脓毒症的发病机制[9],可为脓毒症的预防和治疗提供新思路。研究表明,miR-107在LPS的小鼠血液样本中上调[10],且其抑制剂可下调感染性急性肾损伤患者原代循环内皮细胞中TNF-水平[11],提示miR-107在脓毒症诱导的炎症反应中起调节作用。研究证实miR-107及其预测的靶基因AQP1分别在脓毒症患者血浆和LPS诱导的细胞中显著上调和下调,在脓毒症患者中显示出明显的负相关。AQP1在新生儿毒性红斑、类风湿性关节炎以及肺水肿引发的炎症反应中发挥重要的调节作用[12-14],证明AQP1可调控炎症反应。临床结果显示,脓毒症患者血清中TNF-α,IL-6和IL-1β的分泌显著增高。结合体外研究,TNF-α,IL-6和IL-1β的分泌与miR-107表达有一致性,与AQP1的表达相反,提示miR-107可通过靶向AQP1促进炎症反应。而H19过表达质粒转染入LPS诱导的细胞后,AQP1表达增加,促炎因子水平降低,提示H19与miR-107拮抗性的调节AQP1表达和炎症反应,H19对脓毒症诱导的炎症反应的保护作用。
本研究通过预测并鉴定出AQP1是miR-107的直接靶标之一。此外,AQP1在内毒素休克引起的急性肺损伤中发挥重要作用,其可通过Wnt、MAPK、ERK1/2和NF-kB信号通路延缓肾囊肿、急性肺脑损伤[15-16]。本研究显示,miR-107和AQP1表达、脓毒症诱导的炎症因子的分泌均受H19表达调节,提示H19、miR-107和AQP1在诱导和预防脓毒症炎症反应中的关键作用。
研究表明,在脓毒症调控中,H19和AQP1在与miR-107结合时存在竞争关系[17-18]。LncRNA H19是一种致癌基因,可促进上皮间质转化,也常常作为miRNA海绵促进癌细胞增殖和癌症发展[7,17-19]。研究已经证实,lncRNA H19和miRNAs之间存在相互作用。在肠粘膜屏障功能中,H19可能是AQP3上miR-874的ceRNA[8]。研究中发现,H19可能也是AQP1上miR-107的ceRNA。H19表达可促进AQP1上调,而H19表达也可逆转AQP1-3’UTR和miR-107共转染的细胞中降低的荧光素酶活性,提示H19可能作为AQP1的ceRNA调节miR-107的表达。其他研究还表示,H19作为miRNA/RNA的ceRNA在疾病的发病机理中起重要作用[20-21]。这些结果表明H19作为分子海绵,可与miRNA/mRNA相互作用,调节脓毒症的发生发展。
本研究的局限性在于,缺乏体内和体外相关机制的探讨,缺乏LPS诱导炎症反应、AQP1,H19和miR-107表达的信号通路的探讨。但本研究也证实H19对脓毒症炎症反应的保护作用及AQP1,H19和miR-107三者的相互作用。
总之,在脓毒症患者、LPS诱导的细胞中H19和AQP1表达降低,miR-107表达增加且与其呈负相关。促炎因子TNF-α,IL-6和IL-1β在脓毒症患者和LPS诱导的细胞中显著升高。而H19过表达可逆转LPS诱导的miR-107、AQP1及促炎因子的水平。H19为AQP1上miR-107的ceRNA。进一步的研究应着重于探讨其调控炎症反应的机制及信号通路,以及H19是否为脓毒症和并发症的潜在治疗靶点。
