锡类散对骨髓源性树突状细胞的作用研究
2019-01-21张涛周晓晴杜宗汉陈龙张彦胡小三彭利红李凤于意文何琴莉
张涛,周晓晴,杜宗汉,陈龙,张彦,胡小三,彭利红,李凤,于意文,何琴莉
(南充市中心医院消化内科,四川 南充 637000)
炎症性肠病(inflammatory bowel disease,IBD)包括克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC),是一组慢性复发性肠道炎症性疾病[1]。近 20年来,我国炎症性肠病的发生率不断增加,已成为危害人民健康的常见和难治性的肠道疾病。由于该病病因及发病机制至今尚未完全清楚,治疗上缺乏特异有效的药物。锡类散作为一种传统的中医药复方制剂,由青黛、硼砂、西瓜霜、寒水石、牛黄、珍珠、硇砂、冰片组成,具有清热解毒、消肿止痛之功,主治咽喉肿痛、溃疡,近年来逐渐用于治疗溃疡性结肠炎。四川大学华西医院欧阳钦教授研究团队在 2014 年发表的1篇临床随机对照研究表明:锡类散灌肠治疗轻、中度活动性溃疡性结肠炎安全有效,且疗效优于激素(氢化可的松)灌肠[2]。马熙淼等[3]的一项系统评价研究也表明:锡类散灌肠或联合其他治疗药物如:激素、5-ASA等治疗溃疡性结肠炎总有效率和治愈率都优于单独其他药物治疗以及药物联合甲硝唑或氢化可的松灌肠等,且锡类散灌肠副作用更小,安全性更好。
然而,到目前为止,尚无关于锡类散对结肠树突状细胞作用的报道。本研究旨在从细胞学层面深入探讨锡类散对结肠树突状细胞的影响,为研究锡类散治疗IBD的机制提供依据。
1 研究方法
1.1 Balb/c小鼠骨髓源性树突状细胞(BMDC)的分离、诱导及鉴定
1.1.1 BMDC原代细胞的分离培养 参照Lutz等[4]的方法,采用粒细胞-集落刺激因子(GM-CSF)刺激法分离培养BMDC,具体步骤如下:(1)配制培养基:全培养基100 mL=RPMI-1640 90 mL+10 mL FBS+1 mL青链双抗;DC培养基=全培养基+GM-CSF 2 μg。(2)动物准备:先将130 g左右的SD大鼠采用脱颈法处死,放入75%的酒精中浸泡3 min,灭菌处理。(3)培养皿标记:在动物房超净台中取出4个10 cm培养皿,分别标注0、1、2、3。在0号培养皿中加入4 ℃ 75%酒精8 mL,在1、2、3号培养皿中分别加入8 mL 4 ℃ PBS。(4)分离股骨和胫骨:在膝关节处剪断分离出股骨和胫骨,采用无菌纱布揉捏股骨和胫骨,以进一步剥脱肌肉。(5)股骨和胫骨灭菌:将双下肢股骨和胫骨置于0号培养皿75%酒精中浸泡3 min消毒。将股骨和胫骨依次转移至1、2、3号PBS培养皿中,洗净酒精后,将装有股骨和胫骨PBS的培养皿转移至细胞房超净台。(6) 提取骨髓干细胞:在细胞房超净台中,分别将股骨和胫骨两端用无菌剪刀剪去后,用10 mL注射器配上1 mL的针头,吸取PBS冲击骨髓腔,将骨髓干细胞冲入50 mL离心管中。将装有骨髓干细胞的PBS悬液以1 500 rpm,10 min离心。用大移液管吸除上清液,得到细胞沉淀,加入全培养基 3 mL,然后用枪头进行吹打,使沉淀细胞吹打均匀。(7)过滤:将3 mL细胞悬液用枪头吸出,用200的滤网进行过滤后,再取7 mL的的全培养基冲洗滤网,一共在培养皿中得到10 mL的细胞悬液。(8)离心:将细胞悬液以1 500 rpm,10 min离心。(9)去除红细胞:去上清,加入2 mL红细胞裂解液,采用1 mL枪头吹打均匀后,静置3 min。(10) 离心:将加有红细胞裂解液的细胞悬液以1 500 rpm离心10 min后去上清,两次加入5 mL全培养基吹匀后离心去除红细胞悬液。(11)种板:将离心后的细胞悬液采用DC培养基重悬后,接种至6孔板。
1.1.2 首次换液 (1)观察细胞状态:分化48 h后观察细胞是否贴壁;(2)离心:将原细胞培养液吸入15 mL离心管中,1 500 rpm×10 min离心;(3)清洗:培养皿中加入4 ℃PBS进行清洗2遍;(4)半量换液:原培养液离心后取半量上清液加入10 cm培养皿中,再取新鲜的DC培养基加入到培养皿中,继续5% CO237 ℃培养箱进行培养。
1.1.3 常规换液 (1)半量换液:继续培养2 d后半量换液;(2)去除淋巴细胞:如果换液过程中发现细胞数目过多,混杂有大量的淋巴细胞,采用离心分离法去除淋巴细胞后继续培养;(3)收集细胞检测:一般培养7 d的时候细胞分化完全,称为树突状细胞,收集悬浮和贴壁细胞。一部分细胞直接用于流式检测细胞表型;另一部分细胞采用脂多糖(lipopolysaccharides,LPS) 1 μg/mL干预24 h后进行流式细胞检测。
1.2 BMDC表型测定
1.2.1 收集细胞 (1)去上清:在分离培养的第7天,吸取BMDC和LPS干预后的BMDC的上清液;(2)清洗:采用4 ℃ PBS×2次冲洗两组培养皿,并收集PBS;(3)消化:每个直径为10 cm的培养皿中加入2 mL胰酶,反复吹打,放置于37 ℃孵育箱中孵育5 min,镜下观察细胞是否全部脱落;(4)中止消化:每个培养皿中加入4 mL全培养基中止胰酶消化;(5)收集细胞:收集所有细胞至离心管中,以1 500 rpm,离心10 min;(6)流式标记:去净上清,每个培养皿加入4 ℃ PBS 5 mL,吹匀,以1 500 rpm,离心10 min,洗2次后,采用PBS重悬,每组细胞转移至4个流式管中备用。BMDC的流式管标记为:DCC(BMDC control组)、DCO(BMDC染CD11c-FITC管)、DC80(BMDC染CD80-PE管)、DCX(BMDC染CD86-PE+CD40-FITC+MHCII-PerCP管);LPS刺激后的BMDC流式管标记为:LDCC、LDCO、LDC80、LDCX(染色同前)。
1.2.2 DC表型(CD11c,CD80、CD86、CD40和MHC-II)测定 (1)离心:将8个流式管以1 500 rpm,离心10 min,去净PBS;(2)加液:每管中加入100 μL流式缓冲液(含1%血清的PBS),采用枪头吹打均匀;(3)流抗孵育:在暗室,4 ℃条件下,在DCO和LDCO中加入10 μL CD11c-FITC的流式抗体。在DC80和LDC80中加入10 μL CD80-PE的流式抗体。在DCX和LDCX中分别加入CD86-PE、CD40-FITC和MHCII-PerCP各10 μL。各流式管振荡,吹打均匀,静置孵育30 min;(4)清洗:在除了DCC和LDCC管外的6个流式管中加入2 mL流式缓冲液,振荡,吹打均匀。在暗室条件下,各流式管以1 500 rpm,离心10 min;(5)上机:离心后去上清液,在暗室条件下,每管加入300 μL流式缓冲液,振荡,吹打均匀后上机。
1.3 实验分组
取小鼠骨髓源性树突状细胞(2×106/孔)接种于六孔板上,予以 RPMI-1640完全培养基培养,分为4组:锡类散+DC组、锡类散+DC+LPS组、DC组和DC+LPS组。锡类散+DC组和锡类散+DC+LPS组指DC加入粒细胞集落刺激因子(GM-CSF)刺激,同时加入无菌锡类散悬液刺激。DC组,指GM-CSF刺激骨髓干细胞6 d后的未成熟DC(iDC);DC+LPS组指iDC在第6天加LPS(1 μg/mL)刺激24 h后形成的成熟DC(mDC);锡类散+DC组指GM-CSF+锡类散共同刺激骨髓干细胞6 d后的DC;锡类散+DC+LPS组指GM-CSF+锡类散共同刺激骨髓干细胞6 d后,经LPS(1 μg/mL)刺激24 h后的DC。
上述4组细胞在培养 6 d后,锡类散+DC组收集疏松贴壁细胞,即为锡类散干预后的树突状细胞;锡类散+C+LPS组加入 LPS(1 μg/mL)刺激诱导 24 h;DC组和DC+LPS组加入GM-CSF 刺激,DC组收集疏松贴壁细胞; DC+LPS组加 入 LPS(1 μg/mL)刺激诱导24 h。
1.4 锡类散对树突状细胞表型和分泌的细胞因子的影响
采用流式细胞术检测四组细胞表面共刺激分子(CD80、CD86、 CD40)和MHC-II,并比较,以评价4组树突状细胞的成熟度和耐受性。采用 ELISA 技术检测4组树突状细胞上清液中IL-10 的浓度。
2 结果
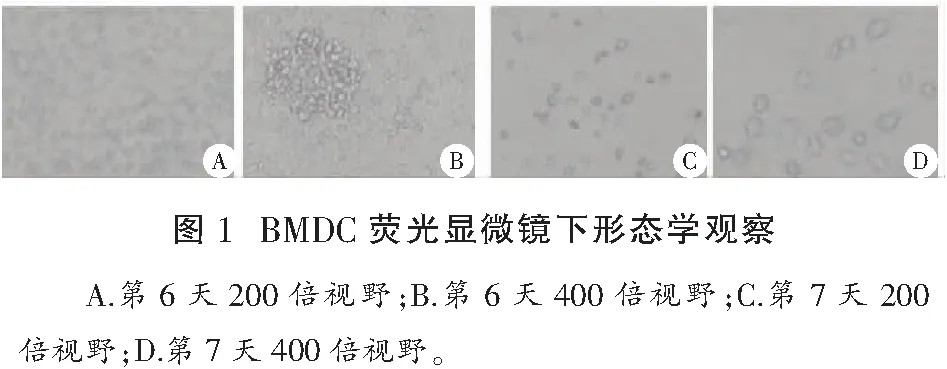
2.1 小鼠BMDC形态学观察
如图1所示,第6天BMDC为幼稚或者不成熟DC,DC形态呈圆形或类圆形,细胞周围没有毛刺,有些细胞呈成簇聚集的悬浮状态。在加用LPS刺激后的第7天变为成熟DC,成熟DC形态为毛球状,圆形或类圆形细胞表面可见较多小的毛刺样突起。
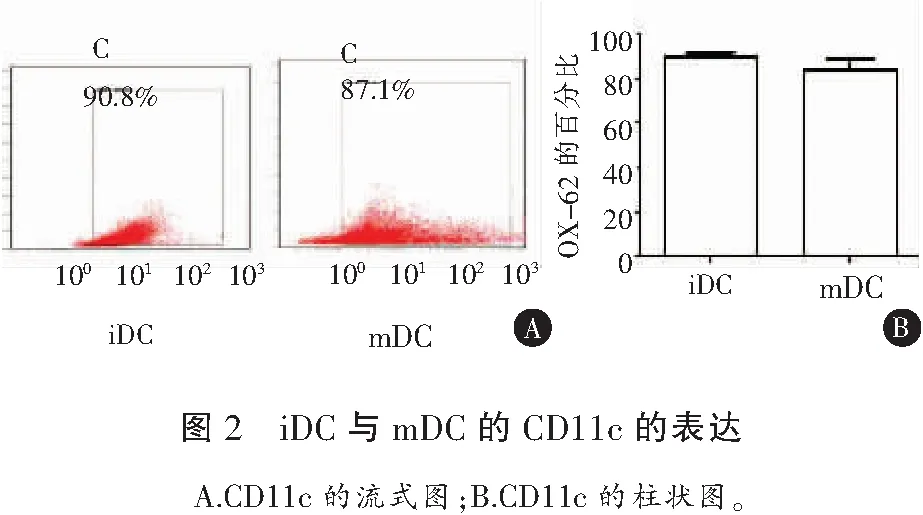
2.2 BMDC的表型测定
如图2所示:在iDC组中,86%~90%的细胞表达CD11c;mDC组中,有85%~89%的细胞表达CD11c。
2.3 iDC与mDC表面共刺激分子和MHC-II的表达差异
如图3-图6及表1所示:与iDC组比较,成熟树突状细胞(mDC)组的表面共刺激分子CD80、CD86、CD40和MHC-II表达明显增加(P<0.05)。
表1 iDC与mDC表面共刺激分子的表达比较±s)
*P<0.05,与iDC组比较。




2.4 锡类散对BMDC表型的影响
如表2所示:与mDC相比,锡类散作用后的DC(锡类散+DC组和锡类散+DC+LPS组)表面共刺激分子CD80、CD86、CD40和MHC-II的表达明显降低(P<0.05),与iDC比较无明显差异(P>0.05)。

组别CD80CD86CD40MHCIIiDC40.57±13.7849.43±21.9516.87±5.015.33±2.81mDC86.93±9.8978.10±12.6530.68±3.2539.4±12.6锡类散+DC38.97±5.8538.70±19.5510.70±5.0916.57±3.52锡类散+DC+LPS41.76±17.6558.50±16.1012.17±1.1717.27±2.80
2.5 锡类散对BMDC的IL-10分泌的影响
由图7可见,与iDC组比较,锡类散诱导的DC组(锡类散+DC组和锡类散+DC+LPS组),IL-10的分泌明显增加(P<0.05);而mDC组IL-10的分泌明显减少(P<0.05)。

3 讨论
树突状细胞(DC)是机体功能最强的专职抗原呈递细胞(APC),能高效地摄取、加工处理和呈递抗原,从而启动免疫应答。DC启动免疫应答具有双重作用,一方面能促进适应性免疫应答的激活;另一方面又能诱导免疫耐受的产生,这种免疫激活和免疫耐受之间的平衡在维持肠道稳态中起着极其重要的作用[5]。
骨髓来源的iDC是DC中的一个亚型,在IBD的发生发展过程中起着至关重要的作用。因此,研究者们在研究IBD与DC的关系时,常常把这种骨髓源性DC作为研究对象[6]。这也是本研究中我们选择骨髓源性DC的原因。
骨髓源性DC起源于骨髓间充质干细胞(mesenchymal stem cells,MSCs),需要诱导才能产生。目前国内外公认的体外诱导骨髓MSCs向骨髓源性DC分化的方法,是粒细胞集落刺激因子(GM-CSF)法[4]。本研究也采用了这一方法成功地用GM-CSF诱导骨髓MSCs转化为BMDC。研究发现:GM-CSF刺激后,6 d就可诱导MSCs分化为未成熟DC。然而,要形成成熟DC还需要抗原或其他物质的刺激。目前公认的在体外刺激未成熟DC向成熟DC转化的刺激物质是LPS。本研究也使用LPS刺激成功地使iDC转变成了mDC。
在BMDC分化成熟过程中,它的状态经历了悬浮-贴壁-半悬浮的过程[7];形态逐渐由未成熟DC呈圆形或类圆形,细胞周围没有毛刺,有些细胞呈成簇聚集的悬浮状态,转变成成熟DC,成熟DC呈毛球状,圆形或类圆形,其细胞表面可见较多小的毛刺样突起[8]。在本研究中,我们也观察到了如上所述的DC分化成熟的整个形态学变化过程。
众所周知,GM-CSF在诱导MSCs分化为树突状细胞时,经历了从前体细胞至未成熟DC(iDC)再到成熟DC(mDC)的过程。一般情况下,在摄取抗原之前,DC处于未成熟阶段,称为未成熟DC(iDC),其特征是表面表达低水平的MHCII和共刺激分子(CD80、CD86和CD40)等激活T细胞所必须的辅助分子。相反,成熟DC则高表达T细胞激活所必须的共刺激分子和MHC-II。因此,DC表面共刺激分子(CD80、CD86、CD40)和MHC-II的表达被作为判定其成熟或未成熟的标志[9-10]。本研究发现,iDC的共刺激分子(CD80、CD86、CD40)和MHC-II呈低表达,mDC的共刺激分子(CD80、CD86、CD40)和MHC-II呈高表达。这表明:从骨髓中分离诱导出iDC,经LPS刺激后,变成了mDC。
鉴定诱导分化的DC是否就是树突状细胞,可通过鉴定其表面特异性标志物来确定。目前的研究认为,在DC的特异性标志物上,不同种属的DC,其特异性标志物是不同的:小鼠和人的BMDC,通常采用CD11c作为特异性标志物[8];而在小鼠的BMDC中,公认的特异性标志物是CD11c。本研究发现:在iDC组中,86%~90%的细胞表达CD11c;mDC组中,有85%~89%的细胞表达CD11c,这表明:分离培养的骨髓细胞中,有85%~90%的细胞是BMDC。
IL-10是一种抑炎细胞因子,能抑制免疫,诱导免疫耐受[11-12]。在炎症性肠病发生发展过程中,肠道IL-10的分泌不足,从而加重了肠道炎症反应。而IL-10的分泌不足被认为与炎症性肠病中肠道耐受性树突状细胞减少有关[13]。与iDC和mDC不同,tDC能分泌大量IL-10,从而抑制免疫,诱导免疫耐受。IL-10也被作为鉴别tDC与iDC和mDC的标志[14]。本研究通过ELISA方法检测各组细胞上清液中IL-10的浓度以鉴别iDC,mDC和tDC。
锡类散治疗溃疡性结肠炎不仅在临床治疗方面作用得到了国内外的广泛认可[15],在锡类散治疗炎症性肠病的动物学研究方面,研究者们也做了一些研究,发 现锡类散对结肠炎模型小鼠有治疗作用。2010年欧阳钦教授研究团队研究发 现:锡类散灌肠可改善恶唑酮结肠炎模型小鼠结肠组织炎症[2]。2016 年 Wen等[16]的研究表明:锡类散灌肠可使葡聚糖硫酸钠结肠炎小鼠结肠组织炎症程度减轻。尽管锡类散灌肠治疗溃疡性结肠炎的临床和动物实验都取得了较好的疗效,然而研究多集中在锡类散减轻结肠炎症,减少炎症因子等方面。关于锡类散是否对结肠免疫细胞特别是重要的抗原呈递细胞-树突状细胞的作用,到目前为止尚未见报道。
本研究通过将锡类散作用于BMDC,通过对树突状细胞表型进行流式检查及上清液进行IL-10的ELISA检测,发现:与iDC比较,锡类散作用后的树突状细胞(锡类散+DC组)表面共刺激分子(CD80、CD86、CD40)和MHC-II无明显变化。在LPS刺激后,锡类散作用后的树突状细胞表面共刺激分子(CD80、CD86、CD40)和MHC-II无明显变化,而iDC在LPS刺激变为mDC后,表面共刺激分子(CD80、CD86、CD40)和MHC-II明显增加。而且,锡类散作用后的DC(锡类散+DC组和锡类散+DC+LPS组)IL-10的分泌明显增加。这说明锡类散作用后的DC能保持表面共刺激分子不变的状态即免疫耐受状态,这与血管活性肠肽(VIP)和维生素D3诱导的树突状细胞产生耐受相似[17-18]。
本研究从细胞学层面证实了中药复方制剂-锡类散能诱导树突状细胞产生耐受,促进树突状细胞产生的IL-10增加。这为进一步研究锡类散治疗结肠炎的动物学机制及锡类散作用靶点和有效成分的开发提供了依据。
