髓系触发受体-1的拮抗剂对大鼠肠巨噬细胞超微结构的影响
2019-01-21盛竹鸽郭剑梁爱玲王宇晖朱浪潮王莹刘利平
盛竹鸽,郭剑,梁爱玲,王宇晖,朱浪潮,王莹,刘利平
(渭南市中心医院消化内科,陕西 渭南 714000)
肠道是人体中最大的内毒素、细菌贮存库,可通过体液免疫和细胞免疫共同防御各种有害因素对机体的侵犯,特别是肠黏膜屏障可有效防止肠腔内多种有害物质穿越肠黏膜进入血液循环,引起其他组织器官损伤[1-2]。肠道巨噬细胞是肠黏膜屏障重要的组成部分,源于骨髓中造血干细胞,主要存在于肠上皮下的固有层中,可参与机体固有免疫反应,具有杀伤及吞噬功能[3-4]。在病理状态下,肠道巨噬细胞可释放大量的炎症因子,可以进入血循环,作用于肝、肺、肾等器官组织并引起损伤[5]。特别是脂多糖(LPS)可以与细胞表面受体结合而激活这一途径,影响肠黏膜屏障通透性,造成肠屏障功能障碍[6-7]。髓系细胞触发受体-1(triggering receptor expressed on myeloid cells-1,TREM-1)是当前发现的细胞表面分子,是选择性表达在CD14+单核细胞及中性粒细胞等髓系细胞表面的炎症受体,可参与促炎因子的合成释放,能够放大炎症的级联反应[8-9]。17个氨基酸组成的多肽(LP17)是TREM-1拮抗剂,含有TREM-1天然的CDR2、CDR3序列的至少3个氨基酸,可减少炎症介质的释放[10-11]。本研究采用LPS体外刺激肠巨噬细胞,应用TREM-1拮抗剂-LP17来干预肠巨噬细胞内TREM-1的表达,探讨TREM-1的拮抗剂对大鼠肠巨噬细胞超微结构的影响,现报告如下。
1 材料与方法
1.1 实验材料
健康雄性SD大鼠由本院动物实验动心提供,质量0.2~0.25 kg,实验符合动物伦理要求,批准号:[SCXK()2012-0004],9周龄,实验前予以禁食12 h、禁水4 h,保持肠道清洁。 LP17多肽由上海洁而生化合成,LPS购自美国sigma公司。RPMI-1640培养基、FBS购自美国Hyelone公司;细胞培养板购自美国Corning公司。
1.2 大鼠肠巨噬细胞的分离培养与鉴定
大鼠用尾静脉注射0.3%戊巴比妥钠麻醉。选择腹部正中切口,显露全部小肠,沿系膜快速切取全部小肠,PBS冲洗肠管,沿小肠系膜纵向分段剖开,用Hanks平衡盐溶液,振荡培养60 min后采用用胶原酶Ⅳ继续消化2 h,不锈钢400目筛网进行过滤,1 500 rpm 4 ℃ 离心20 min收集细胞。 计数大肠巨噬细胞,以RPMI1 640培养基进行分离培养。采用一抗Rabbit polyclonal to CD14(1∶300)进行鉴定分析,二抗为Goat anti—Rabbit IgG(H+L),于荧光显微镜下观察并拍照,阳性信号为绿色荧光。
1.3 大鼠肠巨噬细胞的分组处理
大鼠肠巨噬细胞分为3组,对照组:未加LPS 和LP17;LPS组:LPS给药浓度为1 mg/L;治疗组:LPS给药浓度为1 mg/L,LP17给药浓度为0.1 mg/L。
1.4 MTT法检测细胞活力
将分离好的大鼠肠巨噬细胞按照2×104个细胞的接种密度接种至96孔板中,生长到对数生长期进行上述处理,每个浓度3个复孔。培养48 h后每孔加入20 μL MTT溶液,继续培养4 h,加入二甲基亚砜后进行震荡10 min,采用酶标仪在490 nm处测定各孔的吸光值(OD值),计算细胞活力。
1.5 流式细胞仪检测细胞凋亡
收集处理48 h后的大鼠肠巨噬细胞,采用预冰冷70%的乙醇固定,使用PBS重悬5 min,400目筛网过滤。然后4 ℃避光30 min,流式细胞仪检测与计算细胞凋亡情况。
1.6 Western blot检测细胞TREM-1和TNF-α表达
收集处理48 h后的大鼠肠巨噬细胞,提出总蛋白,用Western blot检测TREM-1和TNF-α 蛋白表达。
1.7 电镜观察细胞超微结构
收集处理48 h后的大鼠肠巨噬细胞,经2.5% 戊二醛前固定2 h,再经常规脱水、透明、树脂浸透包埋,制成70 nm切片组织,经柠檬酸铅染色后在透射电镜上观察拍照。
1.8 统计学分析

2 结果
2.1 细胞分离培养、鉴定及活力比较
大鼠肠巨噬细胞生长状态良好,免疫荧光显示为绿色荧光,CD14表达阳性,细胞分布较均匀,见图1。治疗组与对照组的细胞活力指数显著高于LPS组(P<0.05),治疗组与对照组对比,差异无统计学意义(P>0.05)。见表1。
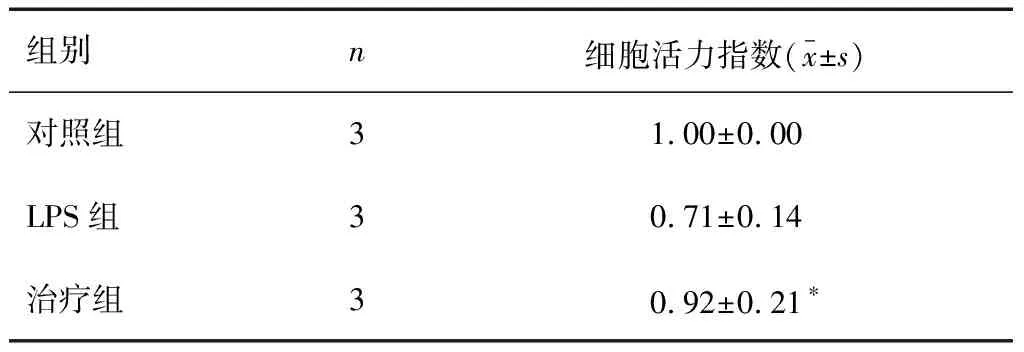
表1 3组大鼠肠巨噬细胞活力指数比较
*P<0.05,与LPS组比较。
2.2 细胞凋亡指数比较
治疗组与对照组的细胞凋亡指数显著低于LPS组(P<0.05),治疗组与对照组对比差异无统计学意义(P>0.05)。见表2。

表2 3组大鼠肠巨噬细胞凋亡指数对比

组别n细胞凋亡指数(x-±s)对照组32.19±0.22LPS组321.43±1.83治疗组33.28±0.84
*P<0.05,与LPS组比较。
2.3 TREM-1、TNF-α的表达
治疗组与对照组的TREM-1、TNF-α相对表达量显著低于LPS组(P<0.05),治疗组与对照组对比差异无统计学意义(P>0.05)。见图2。
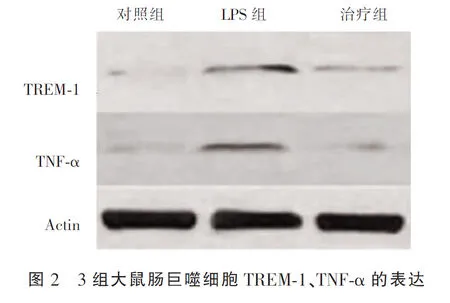
2.4 细胞超微结构对比
电镜下观察对照组肠微绒毛整齐排列,巨噬细胞形态规则;LPS组发现肠巨噬细胞内出现大量凋亡小体,巨噬细胞体积增大,突起,胞间连接紊乱断裂;治疗组发现肠巨噬细胞内出现邵爱玲凋亡小体,肠上皮细胞间隙恢复正常,巨噬细胞表面突起、伪足少。见图3。

3 讨论
肠黏膜中肠巨噬细胞、树突状细胞构成了肠道防止感染的重要防线,在肠黏膜屏障中占重要作用,确保保护性免疫反应[12]。在机体损伤与发生感染时,可出现肠黏膜上皮水肿,产生大量酸性代谢产物,细胞间连接断裂,使肠黏膜血管舒缩紊乱,进一步损伤肠黏膜上皮。特别是肠巨噬细胞的活化可产生大量促炎因子,形成炎症级联放大反应,引起肠黏膜通透性增加[13]。
巨噬细胞在先天性免疫、肿瘤、炎症中发挥重要作用,其在炎症反应早期阶段可起到吞噬细菌及杀灭抗原的作用,也在肿瘤的形成中有一定促进作用[14]。LPS可引起黏膜下水肿,肠上皮绒毛出现坏死,通透性增加,血流量减少,并可诱导炎症因子等释放,引起肠黏膜屏障损伤[15]。LP17为TREM-1特异性拮抗剂,可有效阻断感染性休克模型大鼠TREM-1通路,并显著减轻肠屏障的通透性[16]。本研究显示治疗组与对照组的细胞活力指数显著高于LPS组(P<0.05),细胞凋亡指数显著低于LPS组(P<0.05),治疗组与对照组对比差异无统计学意义(P>0.05),表明大量过度激活的肠巨噬细胞对肠黏膜屏障是有害的,LP17的应用能促进恢复细胞活力,降低细胞凋亡水平。不过也有研究表明LP17并不能完全阻断细胞因子的产生,不影响其他免疫系统的能力[17-18]。但大部分研究已经证明LP17 是与TREM-1结构相似的合成肽,可竞争性阻断TREM-1信号,提高脓毒血症模型小鼠的生存率,一定程度上减少肠巨噬细胞凋亡,降低在炎症环境下肠黏膜损害的程度,发挥肠道保护作用[19]。
肠道巨噬细胞是肠道保护性免疫的重要组成部分,具有维持肠道微生物稳定等作用;其在不同的条件下表现出不同的免疫表型,具有分泌、吞噬细胞因子等功能,并能放大炎症反应[20]。活化后的巨噬细胞可以合成分泌包括TNF-α素在内的多种细胞因子,并可循环促进炎症反应的发生,形成级联反应[21]。TREM-1为跨膜糖蛋白,由 234 个氨基酸组成,相对分子量为30 KD。TREM-1能进一步增强Toll样受体所介导的炎症反应,同时增加炎性细胞的细胞因子。TREM-1也可识别到不同病原微生物或宿主所产生的危险信号,并引起机体产生免疫应答,诱导细胞因子、趋化因子等的产生,在代谢、炎症、病原体反应及组织损伤和修复中发挥重要作用,也可进一步清除病原微生物[22]。TREM-1在中性粒细胞表达与脓毒症的严重程度有关,TREM-1+中性粒细胞计数分别与SAP大鼠病理评分、血清淀粉酶的水平和促炎性细胞因子的水平正相关。本研究显示治疗组与对照组的TREM-1、TNF-α相对表达量显著低于LPS组(P<0.05),治疗组与对照组对比差异无统计学意义(P>0.05)。相关研究也表明LP17在大鼠脓毒症模型可通过阻断与TREM-1诱饵受体相互作用,可减少炎症介质的释放,可防止大鼠器官功能衰竭;LP17也能能够减轻结肠的炎症反应,从而降低小鼠结肠炎的严重性[23]。
虽然对于TREM-1阻断可降低炎症的研究已经逐步涉及,但对于TREM-1分子的上下游信号通路及其调控机制的研究还不够清楚。TREM-1和TREM 受体表达在各种髓系细胞中,能够诱导多种炎症介质产生。通过对抗TREM-1抗体在单核细胞上的竞争性抑制,可诱发细胞内钙离子转移,使促炎性细胞因子及共同刺激因子的产生,放大阳性反应[24]。不过TREM-1激活后的信号通路并未完全明确,目前研究表明TREM-1可活化下游信号通路,促进细胞合成促炎因子[25]。因此关于TREM-1激活在巨噬细胞炎症中的作用机制还有待进一步研究。
总之,TREM-1特异性拮抗剂LP17能有效提高细胞活力,减少巨噬细胞凋亡,抑制巨噬细胞TREM-1与TNF-α的表达,有望成为治疗肠屏障功能障碍的新靶点。
