复合乳酸菌发酵果蔬乳饮料的研制
2019-01-21关成冉蒋欣容马雁陈大卫张臣臣印伯星李启明顾瑞霞
关成冉,蒋欣容,马雁,陈大卫,张臣臣,印伯星,李启明,顾瑞霞,*
(1.扬州大学江苏省乳品生物技术与安全控制重点实验室,江苏扬州225127;2.新希望乳业控股有限公司,四川成都610000)
随着现代社会生活节奏加快及饮食结构的变化,慢性便秘的发生率呈逐渐上升趋势,严重影响人们的生活质量,并可能诱发其他疾病,饮食习惯、精神压力、年龄等因素都能诱发便秘[1]。传统药物治疗如服用泻药,虽然能很快缓解便秘症状,但不能从根本上解决问题。长期使用泻药还易造成肠道菌群失衡,一些刺激性泻药甚至会损害肠道神经,导致更为严重的便秘[2-3]。因此,找寻一种安全有效的饮食或保健干预措施进行便秘防治显得非常必要。
研究显示,利用益生菌和膳食纤维可治疗便秘。乳酸菌代谢产生多种有机酸,刺激肠道分泌肠液,促进肠道蠕动;抑制肠道内病原菌,改善肠道微环境,缓解便秘症状[4-5]。膳食纤维能够提高粪便持水能力或促进肠道蠕动,改善便秘[6-7]。本文利用具有益生特性的乳酸菌混合发酵,通过添加香蕉浆、红薯浆和低聚果糖,拟开发一款具有润肠通便功效的发酵乳饮料。
1 材料与方法
1.1 材料与设备
中性蛋白酶(50 U/mg):美国sigma公司;脱脂乳粉:新西兰恒天然集团;Luria-Bertani、Reinforced Clostridium Medium液体培养基:广东环凯微生物科技有限公司;乳清粉:上海昊岳实业有限公司;低聚果糖:洪昌生物科技有限公司;食品级Ca(OH)2:上海江沪钛白化工制品有限公司;香蕉、红薯:市售。
ZHJH-C1209B超净工作台:上海智城分析仪器制造有限公司;SPX-150BS-Ⅱ生化培养箱:上海新苗医疗器械制造有限公司;Millipore Direct 8超纯水仪:美国Millipore公司;JYB60-08高压均质机:上海东华高压均质机厂;JM 60B胶体磨:上海帅发包装印刷设备。
1.2 试验菌株及发酵剂制备
Lactobacillus rhamnosus grx19、Lactobacillus casei g9、Lactobacillus plantarum s7、Lactobacillus acidophilus ss、Bifidobacterium animal BLC、Streptococcus thermophilus 90-57,均由江苏省乳品生物技术与安全控制重点实验室分离保藏。按活菌数1∶1∶1∶1∶1∶1比例制备而成的混合乳酸菌发酵剂,按照4%接种量,接种发酵。
大肠杆菌、金黄色葡萄球菌、枯草杆菌、假单胞菌:购于中国工业微生物菌种保藏中心。
1.3 果蔬培养基制备
乳清粉处理液的制备:将75%乳糖含量的脱盐乳清粉加水溶解,制备成质量分数为15%乳清粉溶液,添加乳清粉溶液量0.225%的食品级Ca(OH)2,95℃加热3 h,冷却备用。
香蕉浆的制备:香蕉去皮,沸水热烫8 min护色处理,按照体积比1∶1加水打浆,经热处理后冷却备用。
红薯浆的制备:红薯去皮,蒸煮8 min,按照体积比1∶1加水打浆,经热处理后冷却备用。
1.4 香蕉浆、红薯浆和低聚果糖添加量的单因素试验
依次改变发酵温度、发酵时间、香蕉浆、红薯浆和低聚果糖添加量做单因素试验,以发酵果蔬的pH值、酸度、抑菌能力作为考核指标。发酵过程中以乳清粉处理物和脱脂乳为发酵基质,接种量为4%,每隔4 h取样,每次保持4个量不变,只改变考察量。
1.4.1 发酵温度
固定香蕉浆、红薯浆和低聚果糖的添加量为15%、5%及 5%,培养时间 24 h,分别在 34、36、38、40、42 ℃条件下发酵,取样测定考核指标。
1.4.2 发酵时间
固定香蕉浆、红薯浆和低聚果糖的添加量为15%、5%及 5%,38℃分别发酵 12、18、24、30、36 h时,取样测定考核指标。
1.4.3 香蕉浆添加量
固定红薯浆和低聚果糖的添加量为5%及5%,38℃,发酵24h,香蕉浆添加量分别为5%、10%、15%、20%、25%,取样测定考核指标。
1.4.4 红薯浆添加量
固定低聚果糖及香蕉浆添加量为5%及15%,38℃发酵24h,红薯浆添加量分别为5%、10%、15%、20%、25%,取样测定考核指标。
1.4.5 低聚果糖添加量
香蕉浆及红薯浆添加量为15%及10%,38℃,发酵24 h,低聚果糖添加量分别为1%、2%、3%、4%、5%,取样测定考核指标。
1.5 试验数据测定
活菌数测定:按GB 4789.35-2016《食品安全国家标准 食品微生物学检验乳酸菌检验》[8],采用平板计数法测定。
酸度测定:按GB5009.239-2016《食品安全国家标准食品酸度的测定》,采用0.1 mol/L的NaOH溶液测定。
抑菌活性测定:以酶解脱脂乳培养基为空白对照,采用双层琼脂扩散打孔法,37℃培养12 h后测定乳酸菌抑菌活性。
1.6 数据整理和分析
采用SPSS20、Design Expert软件对数据进行处理。
2 结果与分析
2.1 最适发酵温度的确定
温度可影响复合乳酸菌发酵果蔬乳饮料的产酸速率、活菌数及抑菌能力,见图1A、图1B和图1C。
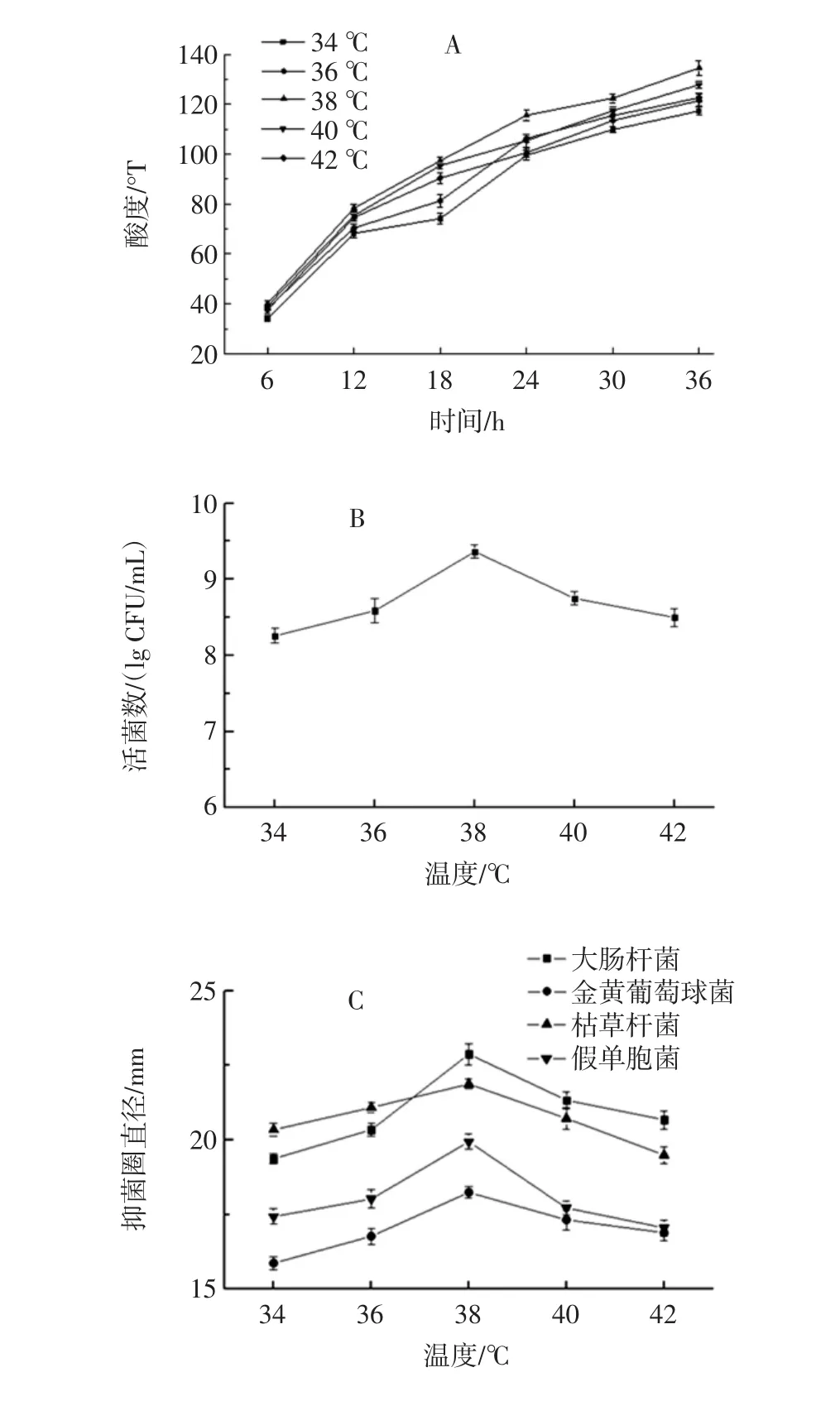
图1 发酵温度对发酵乳饮料的影响Fig.1 The effect of fermentation temperature on the beverage
低于38℃,产酸速率随温度增加而加快,高于38℃产酸速率减慢;在38℃培养,复合乳酸菌发酵果蔬乳饮料含有最高活菌数并对4株病原菌的抑制能力最强。因此,选择38℃为复合乳酸菌发酵果蔬乳饮料的最适发酵温度。
2.2 最适发酵时间的确定
发酵时间影响复合乳酸菌发酵果蔬乳饮料产酸速率、活菌数及抑菌能力,见图2A、图2B和图2C。
结果显示:酸度在发酵过程中一直上升,在6 h~24 h内上升较快,24 h后上升速度变慢;活菌数在发酵6 h~24 h快速增加,24 h之后活菌数快速下降;而抑菌能力在发酵过程中逐渐增强,24 h后增加趋势平缓。综上,选择24 h为最适发酵时间。
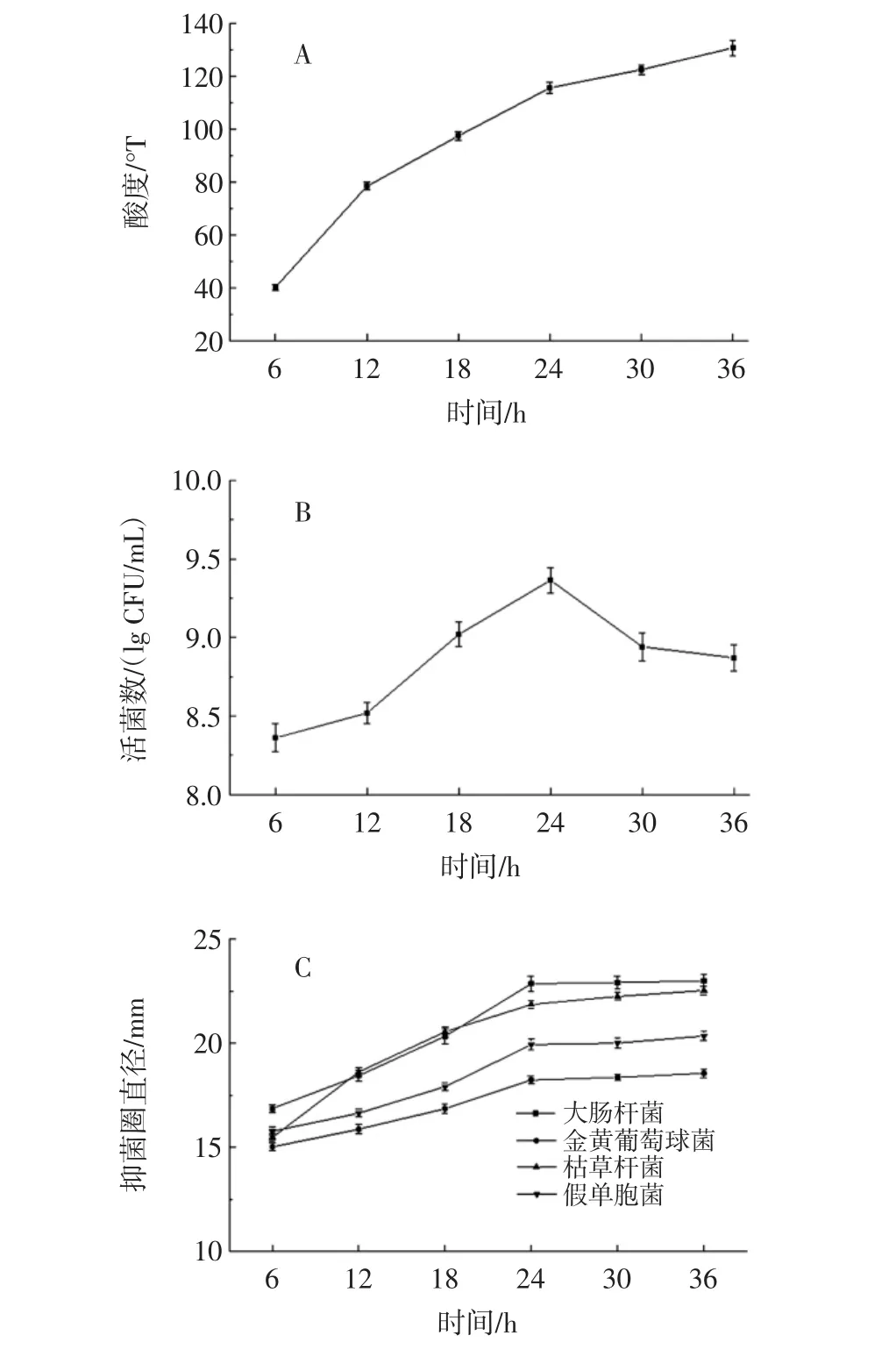
图2 发酵时间对对发酵乳饮料的影响Fig.2 The effect of fermentation time on the beverage
2.3 混合乳酸菌发酵果蔬乳饮料中香蕉浆、红薯浆、低聚果糖添加量的确定
在所确定的发酵条件下,通过单因素试验,研究香蕉浆添加量、红薯浆添加量、低聚果糖对乳酸菌饮料的影响。
2.3.1 最适香蕉浆添加量的确定
香蕉浆添加量对发酵乳饮料的影响见图3。
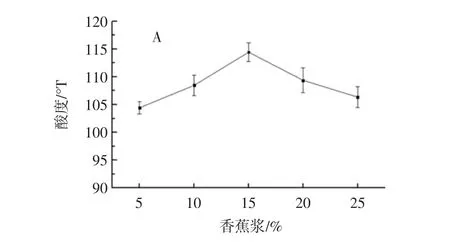

图3 香蕉浆添加量对发酵乳饮料的影响Fig.3 The effect of banana on the beverage
香蕉浆添加量低于15%时,混合乳酸菌发酵果蔬乳饮料的产酸速率(图3A)、活菌数(图3B)及抑菌能力(图3C)均呈快速上升趋势;高于15%时则相反。因此,香蕉浆适宜添加量为15%。
2.3.2 红薯浆添加量的确定
红薯浆添加量对发酵乳饮料的影响见图4。
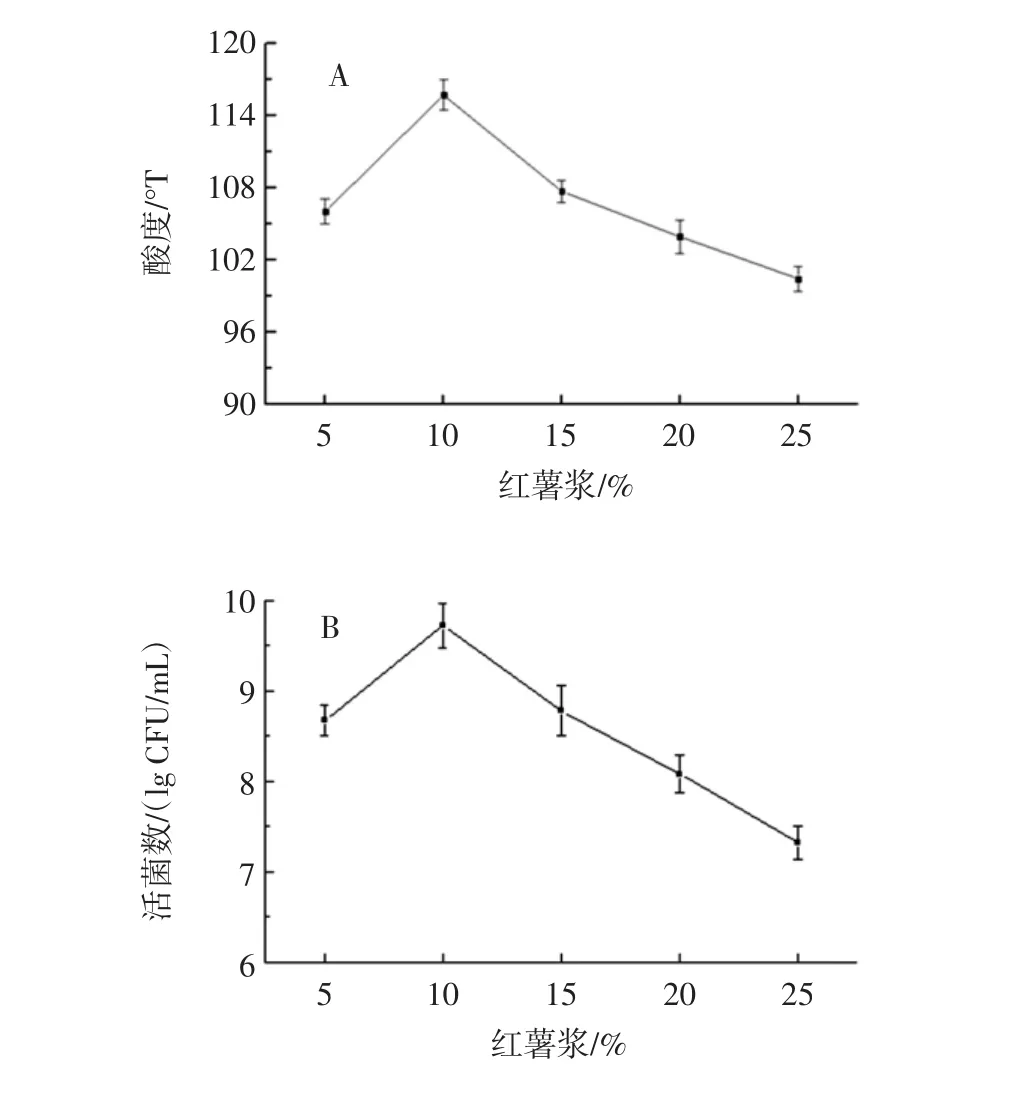
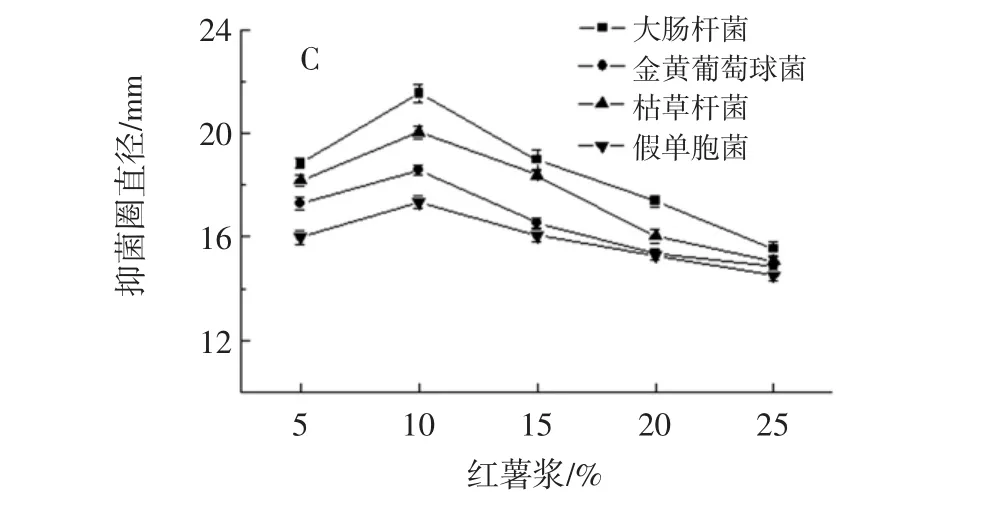
图4 红薯浆添加量对发酵乳饮料的影响Fig.4 The effect of sweet potato on the beverage
红薯浆添加量低于10%时,混合乳酸菌发酵果蔬乳饮料的产酸速率(图4A)、活菌数(图4B)及抑菌能力(图4C)均呈快速上升趋势;高于10%时则相反。因此,红薯浆适宜添加量为10%。
2.3.3 低聚果糖添加量的确定
低聚果糖添加量对发酵乳饮料的影响见图5。
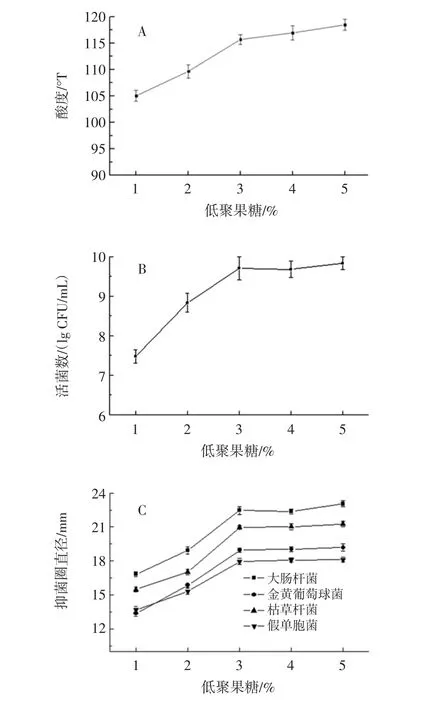
图5 低聚果糖添加量对发酵乳饮料的影响Fig.5 The effect of fructo-oligosaccharides on the beverage
发酵果蔬乳饮料的产酸速率(图5A)、活菌数(图5B)及抑菌能力(图5C)在低聚果糖添加范围内均呈上升趋势,相较于产酸速率,当低聚果糖添加量高于3%时,增加趋势不显著(P>0.05)。综上,低聚果糖的适宜添加量为3%。
2.4 响应面试验
2.4.1 优化试验及结构
在单因素试验的基础上,以香蕉浆添加量(A,%)、红薯浆添加量(B,%)、低聚果糖添加量(C,%)为变量进行响应曲面优化,以活菌数量(Y,lg CFU/mL)为指标,对混合乳酸菌发酵果蔬乳饮料的配方进行优化,响应面结果见表1。
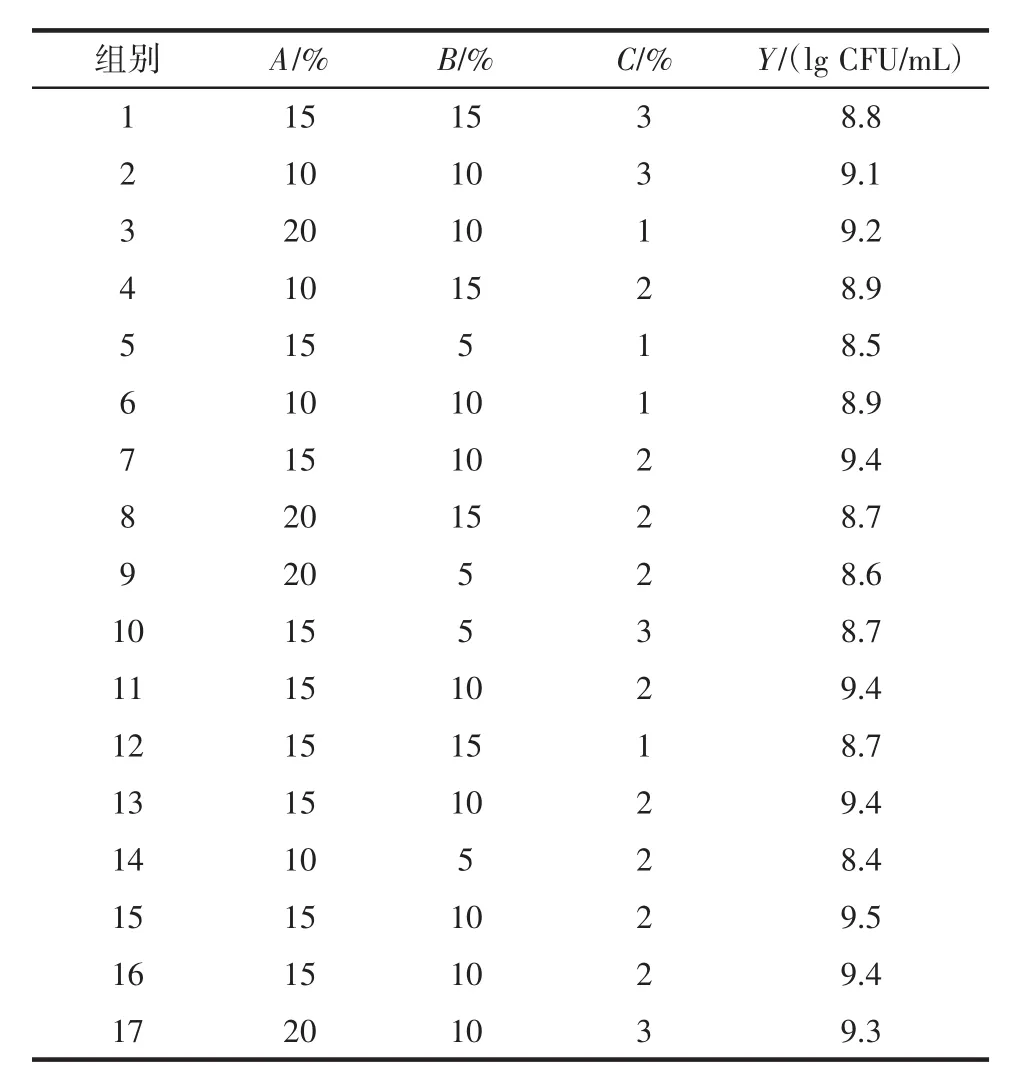
表1 响应面试验表Table 1 Response surface table
2.4.2 模型的建立及其显著性检验
通过Design Expert软件对试验结果进行分析,确定混合乳酸菌发酵果蔬乳饮料活菌数对香蕉浆添加量、红薯浆添加量、低聚果糖添加量的二次多项回归方程为:

方差分析表见表2。由方差分析结果可得,该模型P=0.000 1<0.01,具有高度显著性,能充分表明各因素之间的关系;模型中A2(P=0.001 1<0.01),B2(P<0.000 1),C2(P=0.003 7<0.01),对活菌数量影响显著;由F值可知,在该模型中,各因素对活菌数量影响大小依次为,红薯浆添加量>低聚果糖>香蕉浆添加量。模型失拟性检验P=0.107 9,失拟性不显著,方程对试验拟合较好,模型能准确模拟各因素对乳饮料的影响;模型决定系数R2=0.988 5,能够很好地反应95%的试验结果。
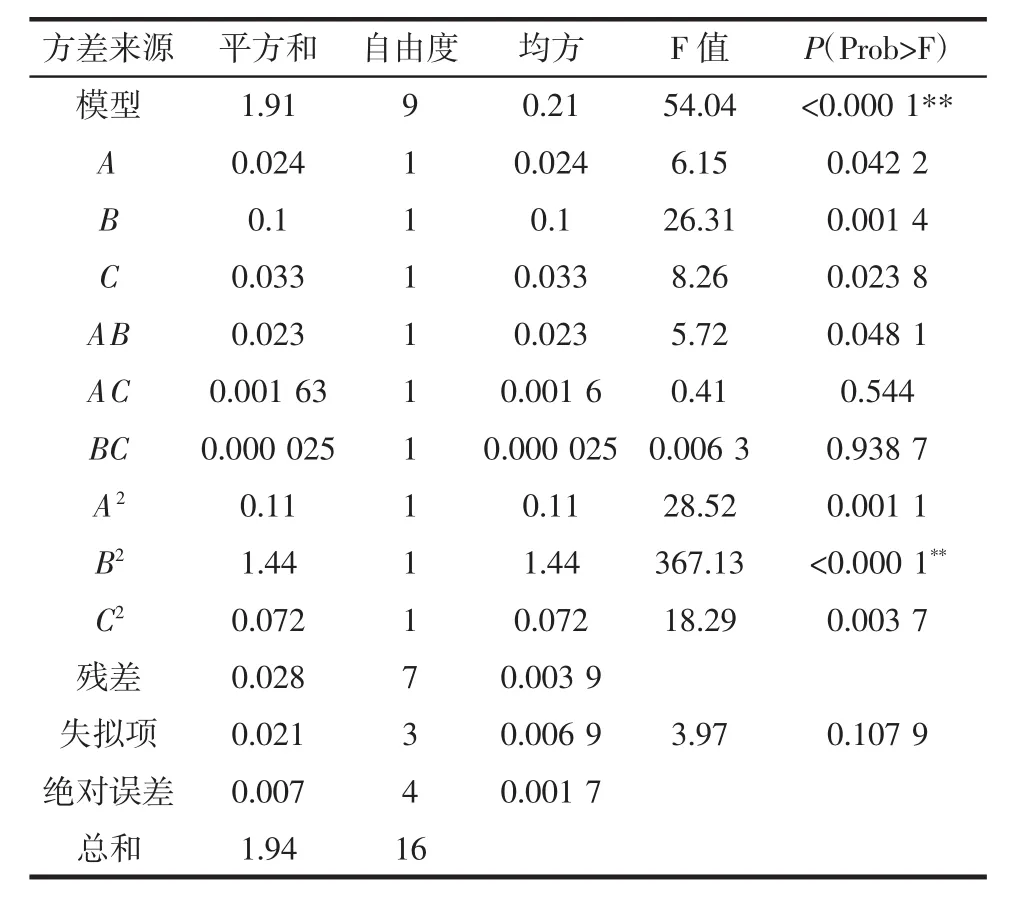
表2 二次多项式模型方差分析表Table 2 Analysis of variance table of quadratic polynomial model
2.4.3 响应曲面分析与优化
因素间的交互作用见图6、图7和图8。
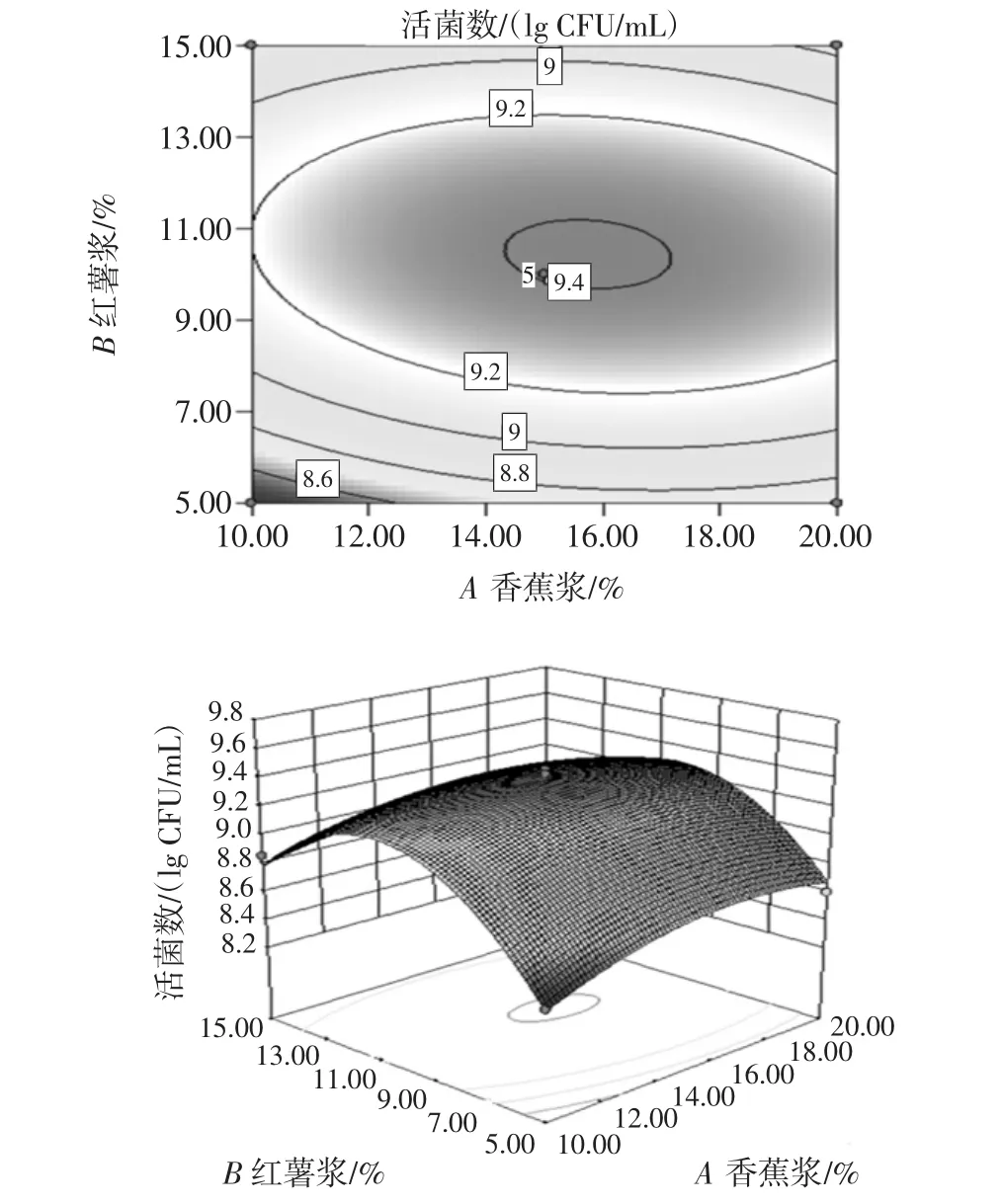
图6 香蕉浆和红薯浆添加量交互作用对活菌数影响的响应曲面和等高线Fig.6 Response surface plot of percent of banana and sweet potato
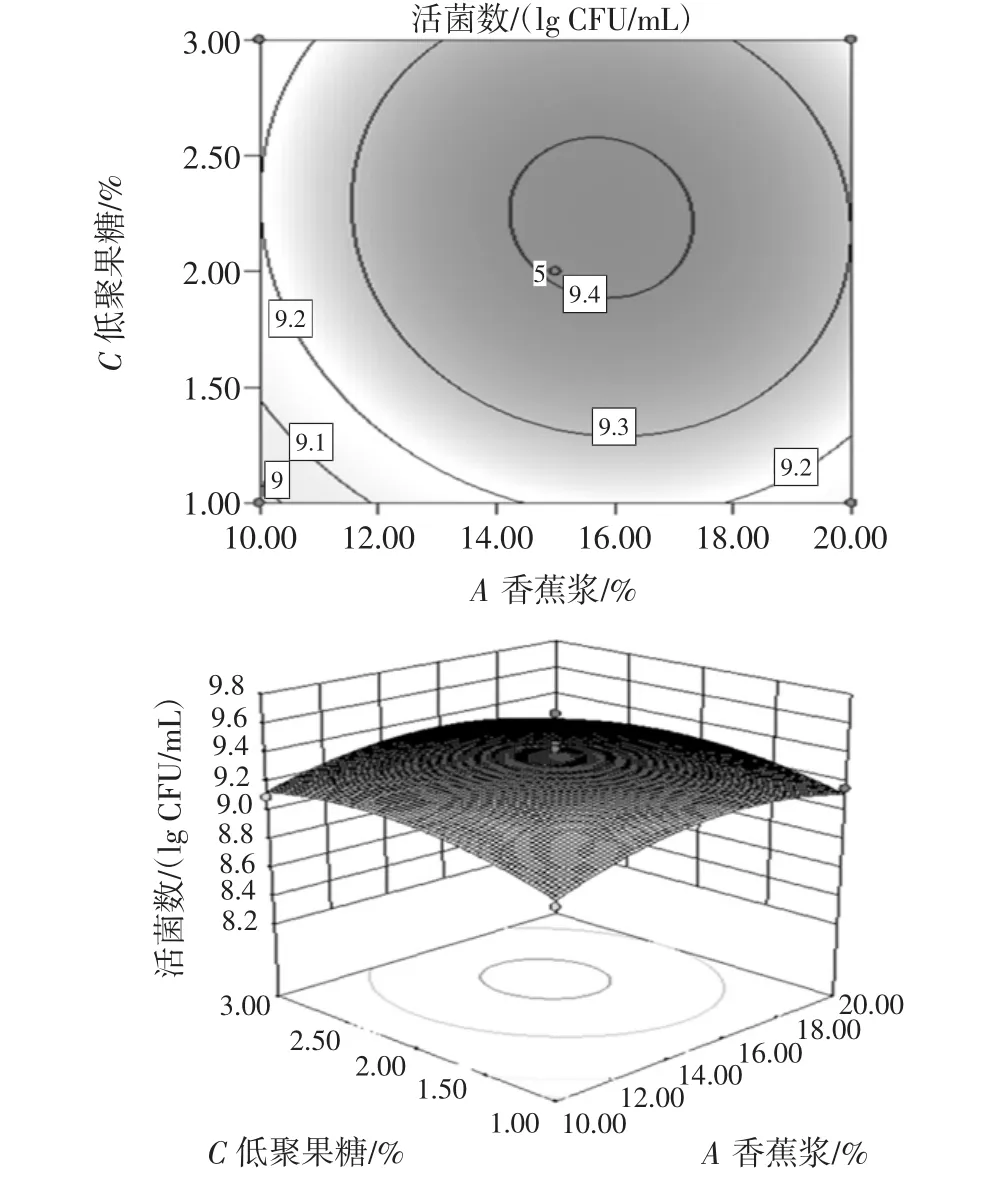
图7 香蕉浆和低聚果糖添加量交互作用对活菌数影响的响应曲面和等高线Fig.7 Response surface plot of percent of banana and fructooligosaccharides
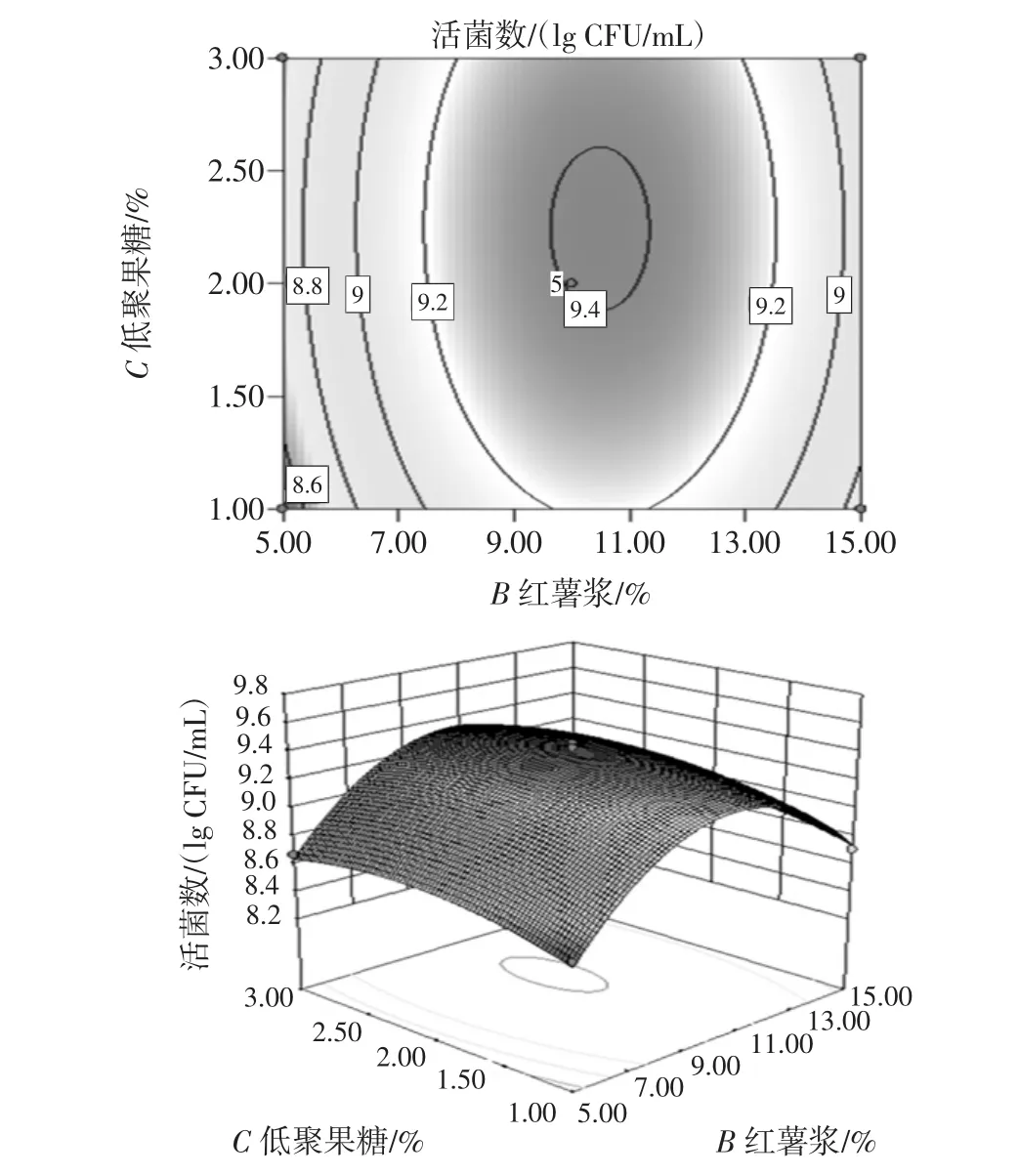
图8 红薯浆和低聚果糖添加量交互作用对活菌数影响的响应曲面和等高线Fig.8 Response surface plot of percent of sweet potato and fructooligosaccharides
比较3个图可知,香蕉浆添加量和红薯浆添加量之间的交互作用最大,而且交互作用呈倒钟形,表明拟合面有真实最大值。
对等高线分析,香蕉浆添加量和红薯浆添加量之间的等高线最密集,其交互作用对活菌数量影响最大,但总体而言,活菌数量都是随各因素变化呈先上升后下降趋势,在特定范围内获得最高活菌数量。
利用软件,获得混合乳酸菌发酵果蔬乳饮料优化配方为:乳清粉处理物和脱脂乳为发酵基质(含5%乳清粉和3%脱脂乳粉),红薯浆添加量为10.44%,低聚果糖添加量为2.23%,香蕉浆添加量为15.67%。考虑到实际操作,将工艺参数修改为:红薯浆添加量为10%,低聚果糖添加量为2%,香蕉浆添加量为16%。
2.5 贮藏稳定性的研究
对贮藏35 d内发酵果蔬乳饮料的酸度、活菌数、抑菌性的变化情况进行测定,结果见图9。

图9 储藏期时间对发酵乳饮料的影响Fig.9 The effect of storage period on the beverage
酸度在储藏0~21 d上升较慢,由118.45°T上升至第21天的126.19°T,对应的活菌数由9.48 lg CFU/mL下降到9.0 lg CFU/mL,21 d后酸度上升较快,总储藏期酸度上升至134.44°T,上升幅度为13.49%,对应的活菌数由9.0 lg CFU/mL下降到8.28 lg CFU/mL。储藏35 d过程中,混合乳酸菌发酵果蔬乳饮料抑制病原菌能力不断增强。
3 讨论与结论
益生菌已被证明对便秘患者具有润肠通便的作用。目前关于益生菌与便秘相关的机制主要有两种,一是在肠道内产生有机酸、修复和促进肠道的功能,来降低肠腔的pH值,调节肠道的神经肌肉活性,增强肠道的蠕动能力;二是有效抑制肠道内腐败菌的滋生,改善肠道环境,使得粪便松软而利于排泄[9-10]。便秘患者肠道微生物中需氧菌、真菌、梭杆菌和大肠埃希菌比例相对增加,厌氧菌、类杆菌、乳酸杆菌和双歧杆菌等显著减少。乳酸杆菌代谢产生乳酸等有机酸可改善肠道环境,促进食物的消化,提高矿物质利用率和维生素的吸收等,还具有抑制肠内致病菌,促进辅助性T细胞Th1发育,诱导产生多种细胞因子,增强细胞免疫功能[11]。双歧杆菌具有抗感染、抗肿瘤、增强机体免疫力、合成多种维生素、促进营养物质的吸收等突出益生作用,研究发现便秘组老年人双歧杆菌含量明显降低,而腐败梭菌等条件致病菌数量显著增高[12]。综上,同时考虑发酵乳感官品质,本研究采用了6种益生菌作为发酵剂。
香蕉和红薯富含膳食纤维,具有增强胃肠道推进作用和抑制肠道吸收液体,促进肠液分泌,机械性刺激肠壁而使蠕动增强的作用[13];低聚果糖在体内外均对双歧杆菌有显著地增殖作用,并在肠道内通过双歧杆菌发酵,产生大量的短链脂肪酸,刺激肠道蠕动、增加粪便湿润度并保持一定的渗透压,从而防止便秘的产生,对产荚膜梭菌、大肠杆菌、艰难梭菌的生长有一定的抑制作用[14-15]。研究表明,益生菌和膳食纤维均可不同程度的改善便秘,而益生菌联合膳食纤维可显著改善便秘[16]。因此,在以6种乳酸菌为发酵剂的基础上,添加香蕉浆、红薯浆及低聚果糖。
本试验混合6株发酵特性突出的益生菌,通过优化发酵温度、发酵时间及香蕉浆、红薯浆、低聚果糖等的添加量,制备具有润肠通便功效的复合乳酸菌发酵果蔬乳饮料,具有产酸速率较快,活菌数较高,对大肠杆菌、金黄色葡萄球菌、枯草杆菌、假单胞菌具有较强的抑制能力等特点。同时,该产品在贮藏期内保持一定的酸度、活菌数及抑菌能力。该饮料的润肠通便功效将在下一步的试验中进行验证。
