Clec14a基因调控斑马鱼胚胎血管发育*
2019-01-21杨晋娴张海骏邵义祥
杨晋娴 ,王 新 ,刘 东 ,张海骏 2,,邵义祥
(南通大学1杏林学院;2实验动物中心;3江苏省神经再生重点实验室,江苏226001)
C型凝集素(C-type lectin)是一类含有Ca2+依赖的糖识别结构域(carbonhydrate-recognition domain,CRD)的蛋白超家族,包含thrombomodulin(TM)/CD141、endosialin/TEM1/CD248、CD93/C1qRP/AA4等亚家族,均为重要的模式识别受体(pattern-recognition receptor,PRR),参与调控机体多个生物学过程,包括固有免疫、细胞间粘附、细胞凋亡[1-2]。TM是血管内皮中发现的一种抗凝血因子,在小鼠模型中TM功能丧失导致动脉和静脉循环中自发的致死性血栓形成[3];另外,TM的C型凝集素结构域能够干扰多形核白细胞与内皮细胞(ECs)的粘附[4],并抵消脂多糖诱导的炎症反应[5]。Clec14a属于TM家族成员,是一种单通道跨膜糖蛋白[6-9]。有研究表明,Clec14a是肿瘤内皮标志物(tumor endothelial markers,TEM),在肿瘤血管系统中高表达,参与调控丝状伪足形成、细胞迁移和管腔形成[10]。Kim等[11]研究也发现CLEC14a-CTLD靶向抗体能够抑制VEGF依赖的血管生成以及肿瘤血管生成。
迄今为止,有关Clec14a基因的研究主要在肿瘤领域,而关于该基因对血管发育的影响鲜见报道,包括其影响血管发育的机制研究。斑马鱼发育早期胚胎透明可辨,利于活体成像,因此我们首选斑马鱼作为研究血管发育的实验动物。我们通过胚胎整体原位杂交技术,检测Clec14a基因在斑马鱼胚胎期的时空表达,并通过Mo下调Clec14a基因表达和注射该基因mRNA进行挽救实验,观察该基因对血管发育,特别是血管新生(angiogenesis)的影响,进一步分析其调控血管发育过程的机制,为后期的临床研究提供基础。
1 材料与方法
1.1 实验动物 使用AB系斑马鱼和Tg(kdrl:mCherry)、Tg(fli1a:nGFP)转基因斑马鱼,喂养及杂交方式严格按照Westerfield编著的《实验室斑马鱼实验指南》[12]进行,饲养于南通大学实验动物中心标准化斑马鱼饲育室。
1.2 主要试剂 4%多聚甲醛(PFA),含Tween-20磷酸盐缓冲液(PBST),甲醇,anti-Dig-AP(Roche),低熔点琼脂糖(Thermo Fisher Scientific),1-phenyl-2-thiourea(Sigma)。
1.3 实验方法
1.3.1 斑马鱼胚胎获取:繁育收胚胎前一晚将斑马鱼成鱼按雌雄比为2:1放入杂交缸,次日早晨亮灯后拔去挡板,交配后收集胚胎,于28.5℃系统水中进行培养。分别在24 hpf、36 hpf和48 hpf收集胚胎,然后在4℃条件下,4%多聚甲醛固定过夜,PBST洗脱后甲醇梯度脱水,-20℃存储备用。
1.3.2 胚胎整体原位杂交:选取存储不同时间点的胚胎进行复水处理,经PBST多次清洗后使用100 ng/mL蛋白酶K消化处理,然后加入Clec14am-RNA探针杂交过夜。第二天,通过柠檬酸钠缓冲液(SSC)梯度洗去未结合的探针,然后经anti-Dig-AP(Roche)抗体过夜处理。第三天,使用PBST溶液洗去未结合的anti-Dig-AP抗体,加入BCIP/NBT/NTMT显色,最后将染色的胚胎保存于甘油中拍照观察。用于合成Clec14a基因原位杂交探针的PCR上游引物:5’-CGGCTCCTACATTTGTGACG-3’;下游引物:5’-CCACATCAGCAGAAAGACCC-3’。
1.3.3 体外合成Clec14amRNA:根据Clec14a序列信息,设计引物,通过RT-PCR技术体外扩增Clec14amRNA,然后将PCR产物连接到pCS2+载体上,筛选出重组质粒。通过KpnI内切酶线性化重组质粒,并以其为模板体外合成Clec14a mRNA(mMessagemMachineRSP6 kit,Ambion)。在斑马鱼胚胎1~2细胞时期显微注射Clec14a mRNA0.3ng。通过在线的引物设计软件primer3(http://primer3.ut.ee)设计合成Clec14a(NM_199786)的PCR引物。上游引物为:5’-CGGGATCCCGTGGTAGAAAGGGCTGTAGAGGG-3’; 下 游 引 物 为 :5’-GGAATTCCGGCAAGATGTGAGCATTGAGGT-3’。
1.3.4 显微注射:根据Clec14a序列信息设计合成特异性 morpholino(GENETOOLS,LLC)[13]下调Clec14a基因表达。在斑马鱼1细胞期显微注射Clec14a-Mo3ng,抑制Clec14a基因表达,并在28.5℃条件下培养。用于下调Clec14a的morpholino序列为:5’-GTAATACCATCCAGAAATCCATGTC-3’。
1.3.5 显微成像:将转基因斑马鱼Tg(kdrl:mCherry)和 Tg(fli1a:nGFP)胚胎麻醉(tricaine,Sigma)后,包埋在1%低熔点琼脂糖(UltraPureTMLow Melting Point Agarose,Thermo Fisher Scientiic)中,凝固后通过Leica SP8(Leica Microsystems)激光共聚焦显微境拍摄,分析斑马鱼胚胎期血管发育情况,图像使用BitplaneImaris 7.2.3处理。
1.3.6 实时定量PCR分析:利用Trizol(Invitrogen)提取不同时间段斑马鱼胚胎总RNA,逆转录获得cDNA(Transcriptor First Strand cDNA Synthesis Kit,Roche),再采用实时荧光定量PCR检测Clec14a的表达。PCR正向引物:5’-TATGACAAGCCAGGAGAGATGCC-3’;反向引物:3’-GCGAAGATGTGTAGTTCAGGACC-5’。
1.4 统计学处理 所有试验重复3次以上,样本量n>10,采用GraphPad Prism 7分析软件处理分析数据,P<0.05表示差异有统计学意义。
2 结 果
2.1 Clec14a基因在斑马鱼胚胎发育早期表达 利用胚胎整体原位杂交技术在mRNA水平检测Clec14a的时空表达,结果表明:在 24 hpf、48 hpf及72 hpf斑马鱼胚胎中,节间血管(ISV)、后主静脉(PCV)以及背主动脉(DA)均有Clec14a基因表达,并且48 hpf后心脏及大脑血管也有明显信号,72 hpf时斑马鱼胚胎心脏中Clec14a的表达更为明显,但是在胚胎后期ISV中,该基因的表达强度变弱,主要集中在心脏部位(图1)。

图1 整体原位杂交检测Clec14a在斑马鱼血管系统中的表达
2.2 Clec14a基因表达下调导致斑马鱼胚胎ISV发育缺陷 通过显微注射方法向转基因斑马鱼Tg(kdrl:mCherry)1细胞时期的胚胎中注射特异性morpholino(Clec14a-Mo),然后继续培养至 30 hpf和48 hpf,每组分别取15条斑马鱼,每条斑马鱼统计5条血管,激光共聚焦显微成像分析ISV形态。结果表明:30hpf时,空白对照组斑马鱼胚胎的ISV已全部长至DLAV,而Clec14a-Mo组只有极少数ISV生长至DLAV,且ISV血管腔明显;待胚胎培养至48 hpf时,Clec14a-Mo组有一部分ISV长至DLAV,但ISV管腔仍然较细(图2A)。根据激光共聚焦成像分析,统计结果如图2B所示,提示Clec14a基因表达下调导致斑马鱼胚胎ISV发育缺陷。
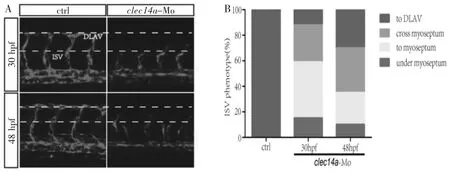
图2 激光共聚焦显微成像观察下调Clec14a基因表达后斑马鱼节间血管发育
2.3 Clec14a基因表达下调抑制斑马鱼ISV内皮细胞增殖 为了进一步研究Clec14a基因在斑马鱼血管发育过程对内皮细胞增殖和迁移的影响,我们使用标记斑马鱼内皮细胞核的转基因斑马鱼Tg(fli1a:nGFP)进行实验,从而研究下调Clec14a基因影响斑马鱼血管发育的细胞学机制。向转基因斑马鱼Tg(kdrl:mCherry)1细胞时期的胚胎中注射Clec14a-Mo,继续培养至30 hpf和48hpf时,每组分别取15条斑马鱼,每条斑马鱼统计5条血管,利用激光共聚焦显微成像分析统计内皮细胞数目。结果表明:在30hpf时,对照组斑马鱼胚胎已有65.33%ISV分化为3个内皮细胞,而Clec14a-Mo组分化为3个内皮细胞仅有14.67%,两者差异有统计学意义(P<0.05)(图3B)。待斑马鱼胚胎发育至48hpf时,对照组78.66%ISV内皮细胞分化至5个及5个以上,而Clec14a-Mo组未见有ISV内皮细胞增殖至6个,分化至5个内皮细胞的ISV数量仅占10.67%,两者差异有统计学意义(P<0.05)(图3C)。从图3A可以发现,ISV中顶细胞(tip cell)的迁移也受到较大影响,Clec14a-Mo组的顶细胞很难到达DLAV(图 3D)。
2.4 Clec14a基因下调后mRNA表达增加 为了探究注射morpholino对斑马鱼Clec14a基因的敲降效率,我们利用实时荧光定量PCR技术检测对照组和morpholino注射组Clec14a表达水平,结果显示:在30 hpf注射组Clec14a基因表达量显著高于对照组,差异有统计学意义(P<0.05)(图 4)。
2.5 注射Clec14a基因mRNA确定Clec14a-Mo的特异性 为了确认Clec14a基因下调导致斑马鱼胚胎ISV发育缺陷的特异性,我们在体外合成Clec14amRNA,在转基因斑马鱼Tg(kdrl:mCherry)1细胞时期,向胚胎中单独注射Clec14a-Mo或同时注射Clec14a-Mo和Clec14amRNA,分别培养至30 hpf,利用激光共聚焦进行ISV形态分析。结果表明:在30 hpf时,Clec14a-Mo组6.67%ISV生长至DLAV,78.67%ISV到达横向肌隔位置。而在挽救组60.00%ISV生长至DLAV,29.33%ISV到达横向肌隔位置(图5A)。统计结果显示ISV发育缺陷能够被Clec14a-mRNA部分拯救(图5B),提示Clec14a-Mo具有较强的特异性,而Clec14a-mRNA能够在一定程度上矫正血管发育缺陷。

图3 下调Clec14a基因表达后斑马鱼节间血管内皮细胞数目和迁移情况
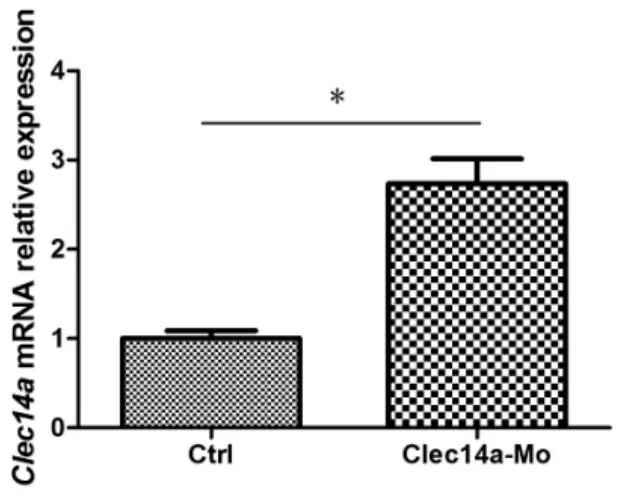
图4 对照组与注射Clec14a-Mo斑马鱼胚胎体内Clec14a基因表达的实时定量PCR分析

图5 注射Clec14a-mRNA后斑马鱼节间血管发育的激光共聚焦显微成像分析
3 讨 论
凝血蛋白(TM)家族属于C型凝集素超家族,其中包括TM、endosialin、CD93和Clec14a[1]。虽然这些蛋白质参与血管发生,但是它们的表达不限于内皮细胞(ECs)。TM作为最初在内皮细胞中被发现的抗凝因子,不仅在脉管系统中表达,也在脑膜、间皮细胞、真皮角质细胞和血小板中表达。CD93是一种吞噬作用的受体,在髓系细胞、内皮细胞、血小板和小胶质细胞中表达[14-15]。Endosialin/TEM1是有选择性地在肿瘤血管内皮细胞中表达[16],因此可以利用进行针对性的治疗。Clec14a作为TM家族的新成员,其作用机制还未见报道。本研究中原位杂交结果证实Clec14a基因在斑马鱼胚胎期的心脏、血管及脑中均有表达。
在生命科学研究中,心血管系统是最重要的研究方向之一,它是完成体内物质交换的基础,是生命代谢活动的基本条件,它遍布全身,影响生命体的每一个重要环节。血管发育过程依赖两个阶段,一个是血管发生(vasculogenesis),另一个是血管新生(angiogenesis)[10]。斑马鱼依靠其得天独厚的特点,成为研究血管新生的首选模型。转基因斑马鱼Tg(kdrl:mCherry)与 Tg(fli1a:nGFP)分别标记内皮细胞的细胞膜和细胞核,我们利用这两种转基因斑马鱼探讨Clec14a基因在血管发育过程中的作用。在斑马鱼胚胎期,下调Clec14a基因表达后,30 hpf和48 hpf均可发现ISV内皮细胞数目减少,部分ISV不能生长至DLAV。同时我们利用qRT-PCR技术对敲降Clec14a基因的效率进行检测,发现在注入Clec14a-Mo的斑马鱼胚胎中表达高于空白对照组,说明在敲降组斑马鱼中,该基因的翻译过程受到阻碍,从而产生反馈导致更多的RNA转录本产生,最终导致较少的Clec14a蛋白参与血管的发生发育,提示Clec14a基因在斑马鱼胚胎期可能通过调控血管内皮细胞分化和迁移来影响血管发育。通过体外合成Clec14amRNA挽救Clec14a-Mo处理后斑马鱼胚胎的表型,挽救后斑马鱼胚胎血管发育较Clec14a-Mo组有明显改善,表明Clec14a-mRNA在发育过程中及时弥补Clec14a下调后的缺失,提示注射Clec14a-Mo所导致的斑马鱼血管发育的影响具有特异性。在研究血管管腔的形成和内皮细胞迁移的体外实验中,敲降Clec14a基因我们发现Clec14a基因对内皮细胞管状结构形成有重要作用,并且参与调控内皮细胞与细胞外基质的粘附作用,解释了Clec14a基因对内皮细胞迁移的影响[17]。
综上所述,本研究显示,Clec14a基因在斑马鱼胚胎血管的发育过程中,通过调控血管内皮细胞分化、增殖和迁移,从而影响血管发育。Clec14a基因调控中涉及的更深层次的分子机制还有待于进一步深入研究。本研究为进一步探讨Clec14a基因在人类血管发育和相关疾病的临床研究中的作用提供了参考依据。
