不同孔径微孔滤膜富集肿瘤细胞的方法
2019-01-21刘文娟杨水青余春红崔宁轩易宗春
赵 霄 刘文娟, 李 磊, 杨水青, 余春红, 崔宁轩, 王 颖, 易宗春,*
1(北京航空航天大学生物与医学工程学院,北京 100083)2(北京航空航天大学生物医学工程高精尖创新中心,北京 100083)
引言
肿瘤原发灶或继发灶上的肿瘤细胞,自发或受外界因素的作用,脱离肿瘤组织进入血液循环系统或淋巴系统,经过血液循环到达人体别的组织或器官,形成新的肿瘤灶,这些存在于血液中的肿瘤细胞即为循环肿瘤细胞(circulating tumor cells, CTCs)[1]。循环肿瘤细胞的检测对癌症的早期检测、复发监测、预后评估及个性化治疗等有着重要意义[2]。但是,由于循环肿瘤细胞在血液中含量很少,与白细胞、红细胞相差悬殊[3],这又给循环肿瘤细胞的检测带来极大的困难与挑战,因此循环肿瘤细胞的富集就非常重要。
现有的富集方法主要包括免疫磁分离法、梯度离心法、微流控技术以及膜滤过分离法等。但是,前两种富集方法假阳性假阴性高、敏感性差;微流控技术灵敏度较高,但成本高;而基于细胞大小的膜滤过分离技术与微流控原理类似,具有操作简单、检测成本低、敏感性高等特点,在临床应用中极具优势。现有的针对膜过滤富集循环肿瘤细胞的方法多采用8 μm滤膜[4],对于8 μm以下滤膜的研究较少。有研究发现,细胞可穿过孔径比其自身直径小很多的滤膜[5],因此笔者进一步研究多种滤膜孔径与肿瘤细胞回收率之间的关系,以探索更理想的膜过滤富集循环肿瘤细胞方法。
1 方法
1.1 材料和仪器
K562细胞(中国医学科学院基础医学研究所细胞中心),可换膜过滤器(北京凯乐思公司),不同孔径(1、3、5、8、10 μm)聚碳酸酯微孔滤膜(北京升河滤膜公司),10 mL注射器(上海治宁公司),IX荧光显微镜(日本Olympus公司),DT5-1离心机(北京时代北利离心机公司),RPMI 1640培养基(美国Invitrogen公司),胎牛血清(FBS,美国Hyclone公司),4%多聚甲醛(北京索莱宝公司),结晶紫溶液(北京鼎国盛公司),红细胞裂解液(北京凯乐思科技有限公司)。
1.2 实验过程
1.2.1细胞培养
K562细胞在含有10% FBS、100U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养基中,放置于37℃、5% CO2培养箱培养。
1.2.2甲醛固定及结晶紫染色
取指数生长期的K562细胞,每毫升加入1 mL的4%多聚甲醛固定液,室温固定15 min后,PBS洗涤3次。使用500 μL结晶紫染色液染色10 min,PBS洗涤3次,用于后续实验。
1.2.3细胞滤过率的测定
活性及固定的K562细胞滤过率的测定:分别取浓度为7.2×105~7.4×105/mL的活性的K562细胞及固定后的K562细胞200 μL,通过1、3、5、8、10 μm微孔滤膜。
1 mL血液滤过率的测定:分别取1 mL静脉血与裂解液按照1:10的比例混匀,8 min后离心洗涤,再通过1、3、5、8、10 μm微孔滤膜;重复以上实验3次,计算每个样本滤过率:活性K562细胞滤过率(%)=回收液中活性K562细胞个数/实际所加活性K562细胞个数×100%,固定K562细胞滤过率(%)=回收液中固定K562细胞个数/实际所加固定K562细胞个数×100%,1 mL血液的滤过率(%)=回收液中白细胞个数/实际所加1 mL血液中白细胞个数×100%。
1.2.4细胞回收率及阳性率测定
将固定染色的K562细胞作为目标细胞,稀释后取少量加入96孔板中,静止2 h后,在显微镜下找出10个只含有1个细胞的孔。1~10个目标细胞按照如上方法配置。将不同孔径的滤膜安装至可换膜过滤器中,将含有目标细胞的液体吸入过滤装置中,并用1 mL PBS清洗。重复以上实验3次,计算每个样本的回收率及阳性率:回收率(%)=滤膜上的固定K562细胞数之和/实际所加固定K562细胞个数×100%,阳性率(%)=滤膜上出现固定K562细胞的样本个数/总样本数×100%。
1.3 统计学分析
采用方差分析法来分析各组间的差异,两组间差异用t检验,P<0.05被认为差异具有统计学意义,error bars采用数据标准差表示。
2 结果
活性K562细胞、固定K562细胞及血液通过不同孔径的微孔滤膜滤过率及时间的结果如图1所示。活性及固定K562细胞通过1、3、5、8、10 μm微孔滤膜后(见图1(a)),随着滤膜孔径增大,滤过率逐渐增大,活性的K562细胞滤过率明显大于固定后的K562。活性K562细胞及固定染色后的K562细胞均可穿过5、8、10 μm滤膜,不能穿过1 μm滤膜,固定K562细胞不能穿过3 μm滤膜。同时,将1 mL血液样本分别通过1、3、5、8、10 μm微孔滤膜,如图1(a)所示,8和10 μm的滤过率为64%左右,1、3、5 μm滤膜的滤过率分别为0%、16.48%、44.23%。固定K562细胞过滤时浓度与时间的关系如图1(b)所示。使用不同浓度固定染色的K562细胞,分别通过1和3 μm滤膜,相同条件下,使用1 μm滤膜的过滤时间显著性大于3 μm滤膜过滤的时间显著性(P<0.01)。
不同条件下目标细胞通过3 μm滤膜后回收率的结果如图2所示。将1~10个固定染色的K562细胞作为目标细胞,分别在未混入细胞、混入5×105个活性K562细胞、混入1×106个活性K562细胞、混入1 mL血液后,通过3 μm滤膜过滤,测得回收率(见图2)。目标细胞未混任何细胞,平均回收率可达60%~70%;目标细胞混5×105个活性K562,平均回收率在45%~60%之间;目标细胞混1×106个活性K562,平均回收率在40%~55%之间;目标细胞混入1 mL血液,平均回收率在40%~65%之间。混了活性K562的样本进行过滤时,对1~10个目标细胞的富集影响具有统计学意义(P<0.05);混了血液的样本进行过滤时,对2、4、10个目标细胞富集的影响具有统计学意义(P<0.05)。总之,目标细胞在不同样本溶液中,回收率具有一定差异。
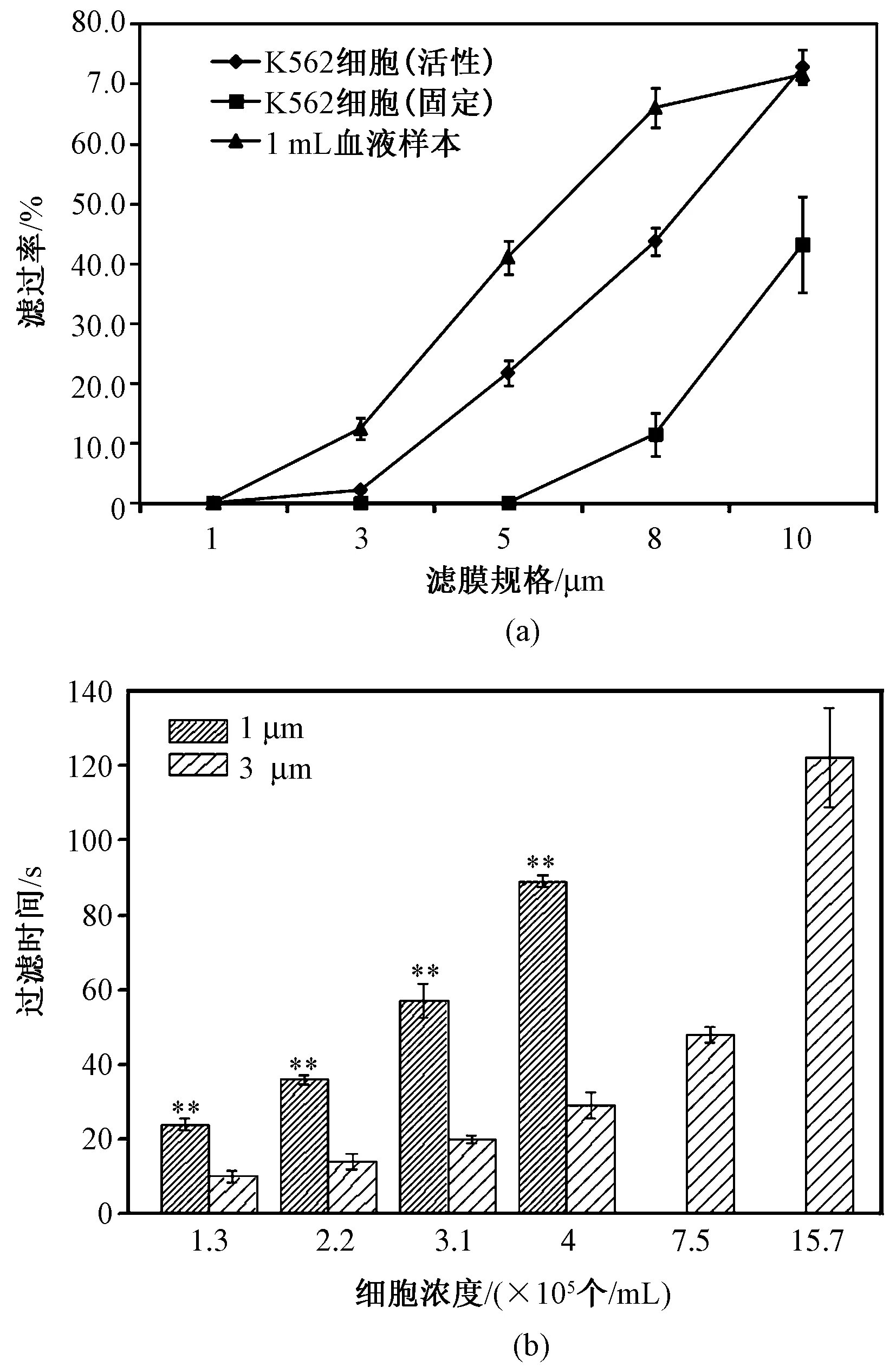
图1 活性、固定K562细胞及血液样本通过不同孔径的微孔滤膜滤过率及时间。(a)活性K562细胞、固定K562细胞及血液样本通过不同规格滤膜后的滤过率;(b)1和3 μm滤膜过滤的固定K562细胞浓度与时间的关系(**表示P<0.01)Fig.1 The filtration rate and time of K562 cells(live and fixed)and 1 ml blood cells through microporous filter membranes with different pore sizes. (a) The filtration rate of live K562 cells, fixed K562 cells and blood cells through different filter membranes; (b) The relationship between concentration and time of fixed K562 cells filtered by 1 μm and 3 μm filters. Meanwhile, t-test has been used(** indicates P<0.01)

图2 不同条件下目标细胞通过3 μm滤膜后的回收率Fig.2 The recovery rate of target cells through 3 μm filter membrane under different conditions
不同条件下目标细胞通过3 μm滤膜后阳性率的结果如图3所示。将1~10个固定染色的K562细胞作为目标细胞,分别在未混入细胞、混入5×105个活性K562细胞、混入1×106个活性K562细胞、混入1 mL血液后,通过3 μm滤膜过滤,测得阳性率如图3所示。目标细胞未混任何细胞,目标细胞个数为2时阳性率为90%,目标数为4及以上时阳性率可达100%;目标细胞混入5×105个活性K562,目标细胞个数为2时阳性率为73.33%,目标数为4及以上时阳性率可达100%;目标细胞混入1×106个活性K562,目标细胞个数为2时阳性率为66.67%,目标数为4时阳性率为93.33%,目标数为6及以上时阳性率可达100%;目标细胞混入1 mL血液,目标细胞个数为2时阳性率为77%,目标数为4及以上时阳性率可达100%。混入活性K562细胞后会对目标细胞富集的产生影响,混入细胞越多阳性率越低;混入血液后测得的阳性率大于混活性K562细胞的阳性率。在细胞个数为6及以上时,阳性率均可达到100%。
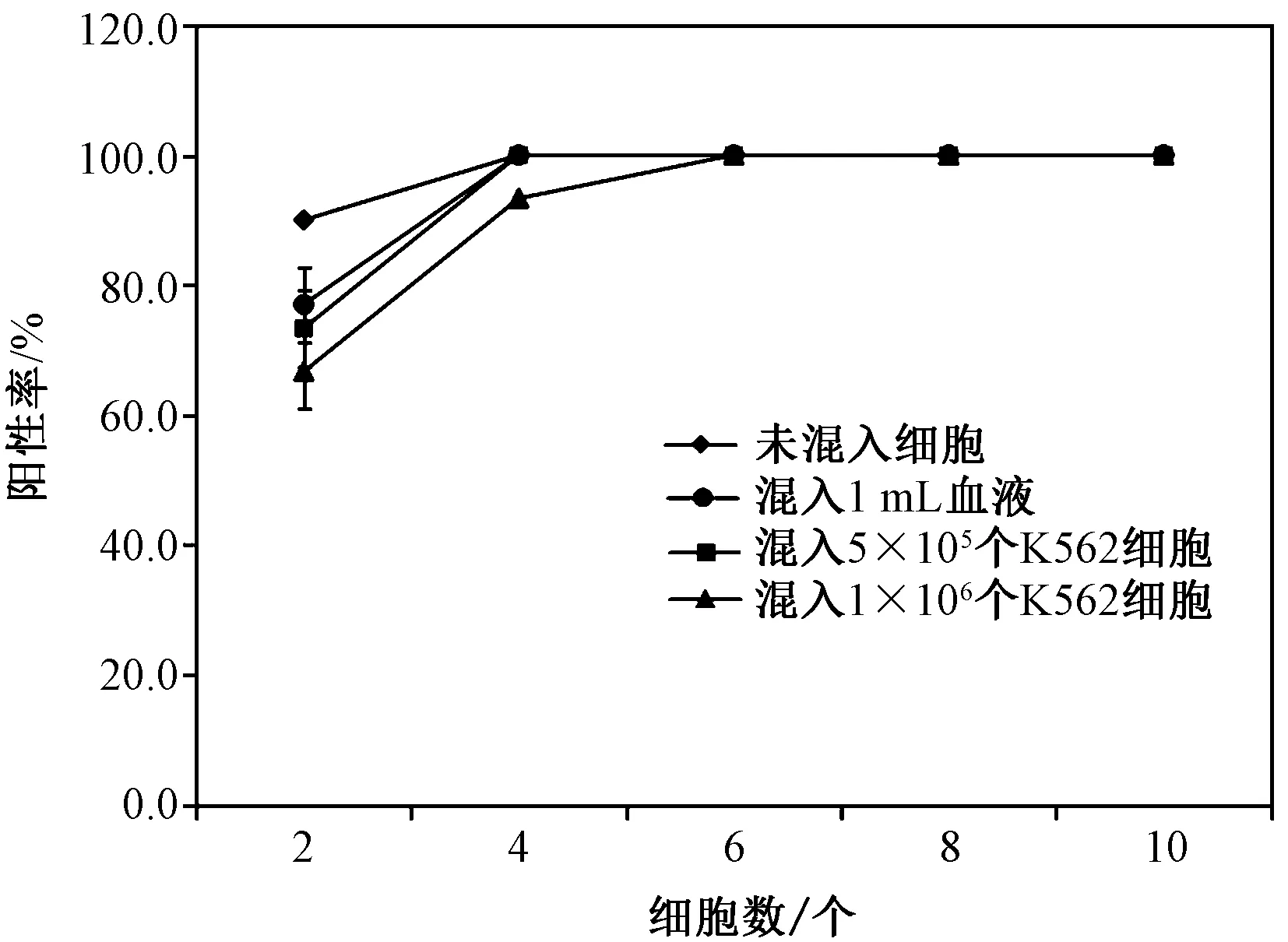
图3 不同条件下目标细胞通过3 μm滤膜后的阳性率Fig.3 The positive rate of target cells through 3 μm filter membrane under different conditions
3 讨论
实际临床循环肿瘤细胞的大小在10 μm以上,而固定的K562细胞的直径约为12 μm,活性的K562细胞约为13 μm[5],K562细胞与其他细胞系相比直径较小,但也在10 μm以上,因此本实验采用与实际肿瘤细胞的大小相差不多的K562细胞进行富集的研究,从而可以更好地选出一种合适孔径的滤膜,以去除直径较小的白细胞,保留直径较大的肿瘤细胞。本实验首先检测活性和固定的K562及血液通过不同微孔滤膜的滤过率,选出1 μm及 3 μm孔径滤膜用于肿瘤细胞的富集,同时结合1 μm与3 μm滤膜在过滤细胞的时间效率,进一步确定了3 μm的微孔滤膜富集肿瘤细胞系。
接下来,在模拟循环肿瘤细胞富集的实验过程中,使用多聚甲醛固定的K562细胞作为目标细胞,用以模拟循环肿瘤细胞。临床上对循环肿瘤细胞进行富集与检测,有对活细胞的,也有对固定细胞的。Chen等使用一种微椭圆形过滤器,对转移性乳腺癌患者、非小细胞肺癌患者、结肠癌患者血液中的循环肿瘤细胞(活性)进行了富集[6];吴源娜等使用基于膜过滤分离技术的CTC-BIOPSY@,对胃癌患者血液中的循环肿瘤细胞(固定)进行了富集[7]。笔者在后续研究临床样本时,将会对样本进行固定,对固定细胞进行富集,因此使用多聚甲醛固定的K562细胞作为目标细胞,用以模拟循环肿瘤细胞。经多聚甲醛固定后的K562与活性K562细胞相比,形态特征无差异,均为圆球形;活性的K562弹性更大,更容易穿过微孔滤膜,而固定的K562稳定性增强,硬度增加,较难通过微孔滤膜。
Coumans等在对相对直径较大的细胞(MDA-466,直径14.9 μm;MDA-231,直径15.4 μm)进行过滤时,通过5 μm孔径的氮化硅微筛过滤的回收率约为25%和37%[8],接下来将1~10个染色固定后的K562细胞作为目标细胞进行富集研究,回收率在60%~70%,某些细胞数范围内回收率呈上升趋势。目标个数为2时阳性率为90%,4个细胞及以上阳性率可达100%,证明实验的可行性。将目标细胞混入5×105个活性K562细胞及1×106个活性K562细胞时,整体上回收率及阳性率均比为混入任何细胞时有所降低,但回收率仍在50%左右,当目标细胞数为6个及以上时,阳性率为100%。
Hofman等使用膜过滤分离技术检测病人样本的的循环肿瘤细胞,阳性率约为50%[9]。本实验回收率在40%~65%之间,目标细胞为2个细胞时阳性率为76.67%,细胞个数为4时阳性率为100%,说明当血液样本较少时,使用3 μm的滤膜来富集全血中的循环肿瘤细胞是值得尝试的。将目标细胞混入1 mL血液中,待红细胞裂解后,即可用3 μm的微孔滤膜进行过滤,相比利用循环肿瘤细胞表面标记物的富集方法操作简单,同时避免了由于肿瘤细胞上皮标志物带来的假阳性或假阴性。
4 结论
本实验研究活性K562细胞、固定K562细胞及血液样本通过微孔滤膜的滤过情况,选取孔径为3 μm的聚碳酸酯滤膜来完成循环肿瘤细胞的富集,同时检测不同条件下固定的肿瘤细胞通过3 μm微孔滤膜的回收率及阳性率,为今后的临床肿瘤患者血液样本通过微孔滤膜富集并检测CTC提供了可行性的研究。但是,考虑到每毫升血液中CTC含量较少,仅为1~10个,而人体外周血来源容易,因此在完成实际临床样本检测时,可考虑检测较大量的样本,比如3 mL血样,增加检出的回收率及阳性率,进一步确立从外周血富集回收肿瘤细胞的方法。
