羟基磷灰石表面蛋白质吸附的研究进展
2019-01-21付亚康张科宏刘耀文
付亚康 张科宏 翁 杰 刘耀文
1(雅安职业技术学院,四川 雅安 625000)2(西南交通大学材料先进技术教育部重点实验室,成都 610031)3(四川农业大学食品学院,四川 雅安 625014)
引言
当生物材料(导管、支架、人造髋关节或组织工程材料)和蛋白质溶液(血液、组织液、培养液)接触时,溶液中的蛋白质将迅速地吸附于材料表面,并且在几秒到几分钟之内达到饱和,形成一层蛋白质膜[1]。随后,细胞膜表面受体与吸附蛋白质活性位点发生特异性结合,使细胞外信号通过细胞膜进入细胞内部,最终决定黏附细胞的生物行为[2]。由于细胞直接与吸附蛋白作用,不与材料表面接触,所以生物材料表面蛋白质吸附的性能(包括吸附蛋白质的种类、数量、构象变化[3]等)对生物材料的性能研究及功能设计具有重要的意义,因而蛋白质吸附一直是生物材料研究领域的一个重要课题。
HAP是人体硬组织中的主要无机成分, 理论组成为Ca10(PO4)6(OH)2,钙磷比为1.67,其晶体为六方晶系(见图1),属于P63/m空间群,其结构为六角柱体,a、b轴夹角为120°,晶胞常数为a=b=9.432Å,c=6.884Å。HAP良好的生物相容性和生物活性已被大量研究所证实[3], 因而被广泛地应用于临床骨缺损修复。近年来,多孔HAP植入体显示出优良的骨诱导性, 但其骨诱导机理还存在较多不明之处[4-5]。目前对HAP骨诱导机理的研究大多涉及蛋白质在HAP表面的吸附,一方面是因为蛋白质和HAP是硬组织的重要组成成分[6],另一方面是因为“类骨磷灰石层”[7-9]的形成包括蛋白质吸附过程。
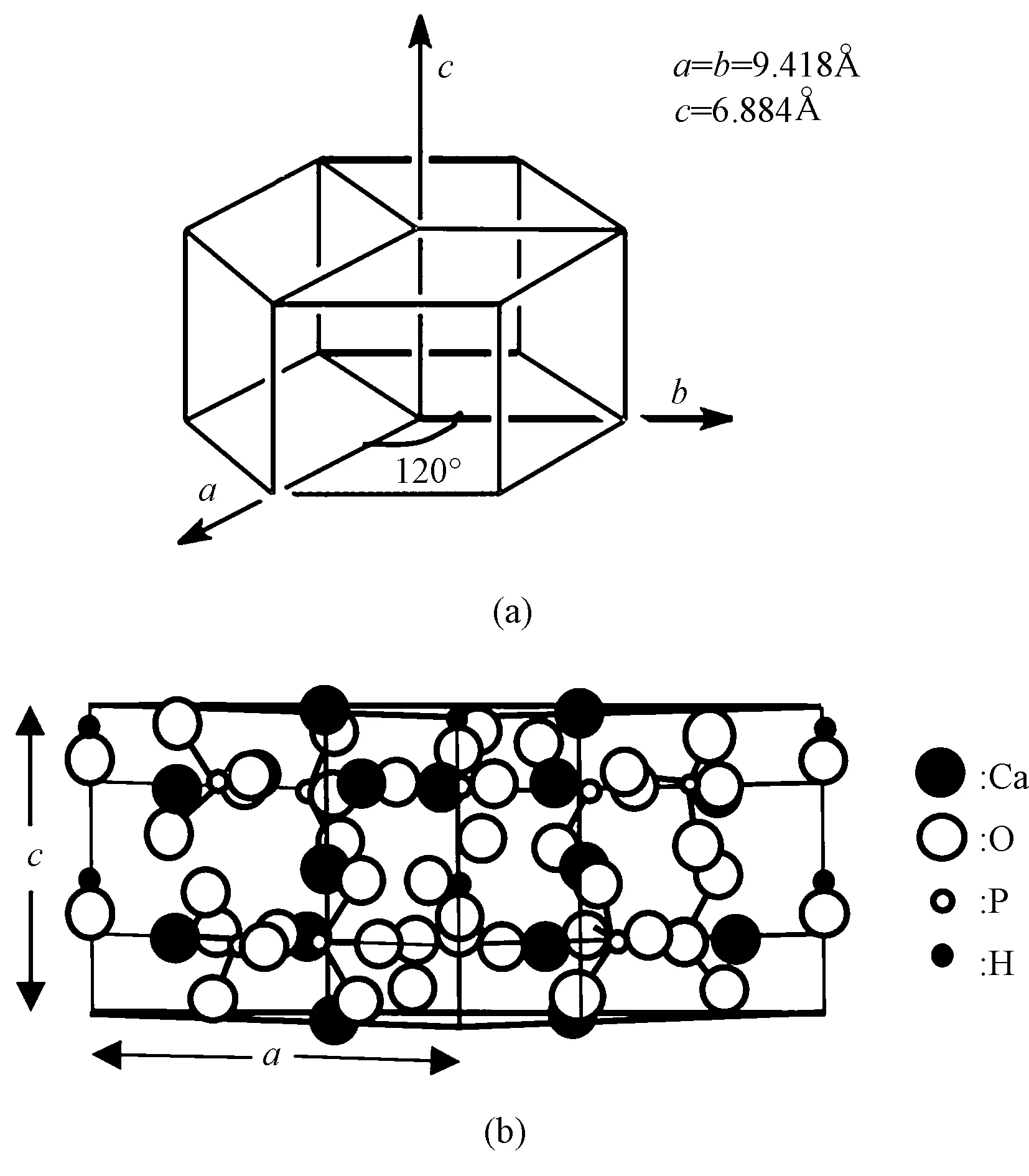
图1 (a)HAP晶胞结构示意;(b)HAP晶胞结构在(110)晶面上的投影[17]Fig.1 (a)Schematic diagram of the unit cell structure of HAP; (b)Projection of unit cell of HAP crystal viewed along (110) face[17]
另外,HAP还可以用作层析柱的填料[10],其中PO43-可与带正电的蛋白质以离子键结合,由氯化钠或磷酸钠浓度梯度洗脱;其中Ca2+可与带负电蛋白质的自由羧基以金属螯合的方式结合,由磷酸钠浓度梯度洗脱。HAP耐碱度高、生物安全性好,是目前唯一直接用于蛋白质和核酸纯化的无机层析填料[11-12],其表面蛋白质吸附的性能对HAP的层析功能具有重要影响。
综上所述,大量研究集中在HAP表面蛋白质吸附的行为和机制上,但由于该研究涉及蛋白质[13]、吸附环境[14]、HAP性能三方面因素[15-16];研究过程中可变的因素较多,导致许多研究的结论不一致,甚至相反[17-18],因此关于HAP表面蛋白质吸附的行为和机制还未形成较统一、清楚的认识。下面综述近30年关于HAP表面蛋白质吸附的研究工作,主要涉及吸附的机制、重要的影响因素以及与之相关的应用研究,希望能为HAP表面蛋白质吸附行为的认识、骨诱导机理的研究及具有选择性蛋白吸附功能的HAP材料的设计提供有益的借鉴。
1 吸附机制
蛋白质分子在HAP表面发生吸附的过程,实际上是蛋白质分子从溶液中向HAP材料表面迁移、富集的过程。研究表明,导致这一过程发生的作用力主要有静电作用、氢键和范德华力。具体情况中,导致吸附的作用力可能是其中的一种,也可能是多种[19-20]。
1.1 静电作用
研究表明,静电引力是导致HAP与蛋白质之间发生吸附最主要的一种作用力。由于Ca2+、PO43-是组成HAP的主要离子,Ca2+带正电荷,PO43-带负电荷,而蛋白质分子往往带有一定量的电荷;另外HAP晶格大小与蛋白质分子的尺寸同属于微纳米范围,因此理论上HAP和蛋白质分子之间可以发生静电作用而吸附。众多实验都支持这一结论,Kazuhiko等制备了Ca/P为1.55~1.70的HAP,随着Ca/P的增大,HAP表面的正电性逐渐增大,蛋白吸附实验发现,HAP对BSA分子(酸性蛋白,带负电荷)的吸附量由0.45mg/m2逐渐增大至0.82 mg/m2,研究认为这是因为HAP晶面中Ca2+密度增大,晶面与带负电荷的BSA分子之间静电引力增强,导致吸附量增大[21]。为了验证这种结论,Santos等对HAP表面进行喷金处理,屏蔽了HAP表面的Ca2+和PO43-,实验发现喷金后HAP表面对BSA的吸附量大大下降,说明BSA分子在HAP表面发生吸附主要是通过静电作用,而不是疏水作用[22]。Chen等采用分子动态平衡模拟技术,模拟富含亮氨酸的釉原蛋白(LRAP)在HAP(001)晶面上的吸附行为,发现LRAP的羧基与HAP(001)晶面上Ca2+之间存在较强的静电引力,LRAP上-COO-的两个氧原子与钙原子呈三角形分布[23]。
1.2 氢键
氢键也是蛋白质与HAP之间发生吸附的一种重要作用力[19]。Dong等研究了BMP-2在HAP(001)晶面的吸附,发现BMP-2具有3种吸附基团,分别为-OH、-NH2和-COO-,不带电荷的吸附基团(-OH和-NH2)主要以氢键作用与HAP晶面发生吸附,通过量子化学的计算也证实了氢键的存在[24]。Zhou等采用分子动力学模拟技术研究了BMP-7在HAP表面的吸附过程,得到类似的结论:发现BMP-7的吸附残基可分为两类,即谷氨酸/天冬氨酸、精氨酸/赖氨酸,前者以静电引力的方式吸附于HAP表面,后者以氢键的形式吸附于HAP表面[20]。可以看出,氢键主要存在于不带电的吸附基团与HAP表面之间。
1.3 范德华力
Liao等利用分子动力学模拟技术,研究FN第3结构域第10模块(FN-III10)和第7-10模块(FN-III7-10)在HAP(001)晶面的吸附过程(见图2)[19]。研究发现,随着吸附的进行,范德华力和静电引力交替地主导着吸附的进程:FN-III10在吸附起始阶段,静电引力起主导作用;吸附进行20 ns后,大量氨基酸残基逐渐吸附于HAP表面,氨基酸残基与HAP表面带电离子发生电性的错配,导致静电斥力增大,静电引力作用逐渐减弱,范德华力逐渐增强,成为主要的吸附作用力。在范德华力的作用下,FN-III10中无规则卷曲部分发生较大的结构变化,导致FN-III10的构象发生变化(见图2(d))。而FN-III7-10的吸附经历了由弱到强的吸附过程,随着碱性残基Arg1421锚定到HAP表面,吸附驱动力由范德华力转变为静电引力。
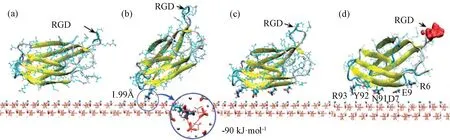
图2 计算机模拟FN-III10在HAP(001)晶面的吸附过程。(a)吸附时间为0;(b)吸附时间为6.11 ns;(c)吸附时间为21.59 ns;(d)吸附时间为100 ns[19]Fig. 2 Snapshots of computer simulation process of FN-III10 adsorption on HAP(001). (a) At 0 ns; (b) At 6.11ns; (c) At 21.59ns; (d) At 100 ns[19]
2 影响因素
HAP表面的蛋白质吸附过程十分复杂,主要受到材料因素、蛋白质及吸附环境三方面因素的影响,如表1所示。材料因素包括晶面结构、比表面积、孔隙尺寸等,蛋白质因素主要包括蛋白质种类及浓度,环境因素主要包括温度、pH、离子的种类及浓度等。
2.1 表面晶面
随着HAP合成技术的多样化,众多研究者制备出针状、带状、片状及球状等HAP颗粒用于蛋白质吸附的研究,研究发现HAP表面的晶面成分是影响HAP表面蛋白质吸附性能的一个重要因素[25-26]。根据HAP不同晶面与蛋白质分子之间作用的特点[27],可将HAP参与吸附的晶面分为两类:a晶面和c晶面(见图3)。
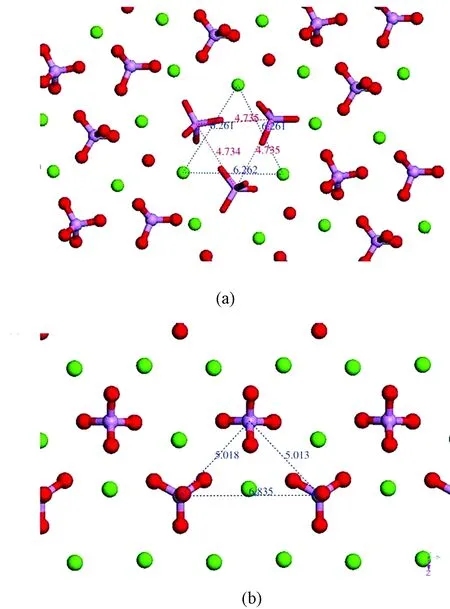
图3 HAP中带电离子和基团分布的俯视示意。 (a)HAP的c晶面;(b)HAP的a晶面,钙显示绿色;磷显示蓝紫色;氧显示红色[26]Fig.3 The top view of charged ions or groups distribution on (a) c and (b) a crystal planes of HAP. Ca, green; P, violet; O, red[26]
2.1.1a晶面
a晶面是指HAP沿c轴取向生长后形成的晶面。HAP的 a晶面上分布着大量的钙(Ⅰ)和钙(Ⅱ)离子,钙(Ⅰ)和钙(Ⅱ)离子是酸性蛋白质的吸附位点(C位点),因此a晶面对酸性蛋白质具有选择性吸附作用。例如,刘翠莲等研究了纤维蛋白原(Fg)在HAP(100)、(001)晶面的吸附行为,(100)和(001)晶面分别属于a和c晶面,实验发现HAP(100)晶面对Fg的吸附量大于(001)晶面;计算机分子模拟技术也表明,Fg在(100)晶面的吸附性能强于(001)晶面的吸附性,这正是因为HAP的a晶面对酸性的Fg具有选择性吸附作用[28]。再如,Kazuhiko等采用水热法,制备了宽度相近、c轴方向长度在27~102 nm范围的纳米HAP,蛋白质吸附实验表明,BSA的饱和吸附量随HAP颗粒c轴长度增大而增大,由0.66 mg/m2增大至1.44 mg/m2。这是因为随着HAP颗粒c轴方向尺寸逐渐增大,颗粒外表面中a晶面成分占总比表面积的比例逐渐增大,导致HAP对酸性蛋白质(如BSA)的选择吸附性逐渐增强[29]。
表1影响HAP表面蛋白质吸附性能的因素
Tab.1FactorsaffectingproteinadsorptionpropertiesonHAPsurface

影响因素对蛋白质吸附性能的影响暴露晶面a晶面促进对酸性蛋白质的吸附c晶面促进对碱性蛋白质的吸附比表面积 当HAP颗粒暴露晶面的组成固定 蛋白质吸附量随比表面积增大而增大 当HAP颗粒暴露晶面组成不固定 蛋白质吸附性能与比表面积大小无关孔隙尺寸 当孔隙尺寸大于蛋白质分子尺寸时,蛋白质吸附量随比表面积增大而增大吸附环境PO43- 抑制酸性蛋白质在HAP表面的吸附,在低浓度范围内促进碱性蛋白质在HAP表面的吸附Ca2+ 促进酸性蛋白质的吸附;有助于α螺旋构象的形成,从而促进蛋白质的吸附pH 在一定范围内,pH增大,促进碱性蛋白质的吸附,抑制酸性蛋白质的吸附温度对不同蛋白质的吸附影响不同
2.1.2c晶面
HAP的c晶面是指HAP沿a轴取向生长形成的晶面。c晶面上分布着大量的PO43-,它是碱性蛋白质的吸附位点(P位点),因而c晶面对碱性蛋白质具有选择性吸附作用。Zhuang等利用气-液界面法制备了暴露c晶面的片状HAP颗粒,蛋白吸附实验发现:该片状HAP对溶菌酶(LYS,碱性蛋白)具有超强的选择性吸附作用[30]。笔者也曾研究HAP不同晶面对蛋白质的吸附行为,发现随着c晶面含量逐渐增加,HAP对LYS(碱性蛋白质)的吸附性逐渐增强,对BSA(酸性蛋白质)的吸附性逐渐减弱,说明HAP的c晶面对碱性蛋白质具有选择性吸附作用[31]。
其三,教育行政部门需要认识到教师情绪劳动作为劳动类型之一,不能被“忽视”,也不能被“敌视”,需要被合理考虑。因此,教育行政部门从意识上要重视教师情绪劳动的存在与管理,从策略上要全员关注、全程管理、科学优化,努力将对教师情绪劳动的模糊认知、判断、处理走向更加科学、合
2.2 比表面积
HAP的比表面积是指单位质量的HAP颗粒具有的总面积,由于蛋白质吸附发生于HAP颗粒的表面,因而比表面积对HAP表面蛋白质吸附的性能具有重要影响。比表面积对HAP表面蛋白质吸附性能的影响与HAP颗粒表面暴露晶面的组成有关,除此之外还与孔隙的尺寸有关。因此,比表面积对HAP表面蛋白质吸附性能的影响要根据HAP暴露晶面的组成固定、不固定和孔隙尺寸3种情况而定。
2.2.1HAP颗粒暴露晶面的组成固定
HAP表面暴露晶面的组成固定,是指HAP单位面积中蛋白质吸附位点的类型、数量不变,此时单位质量HAP的最大蛋白质吸附量随比表面积增大而增大。这是因为比表面积越大,单位质量HAP含有的蛋白质吸附位点越多,因此单位质量HAP的蛋白质吸附量越大。例如,Fernandez等使用模板调控的方法制备了暴露晶面组成固定,比表面积不同的HAP颗粒,蛋白吸附实验发现:当HAP的比表面积由34 m2/g增大至62 m2/g时,HAP对Fg的饱和吸附量由55 μg/mg增大至195 μg/mg,对FN的饱和吸附量由194 μg/mg增大至259 μg/mg[32]。类似的,Matsumoto等通过改变反应温度制备了暴露晶面组成固定,比表面积不同的HAP颗粒,蛋白吸附实验发现:当HAP比表面积由11 m2/g增大至88 m2/g时,HAP对细胞色素c的饱和吸附量由1.61 μg/mg增大至14.59 μg/mg[33]。
2.2.2HAP颗粒暴露晶面的组成不固定
HAP颗粒暴露晶面的组成不固定,是指HAP单位面积中各种暴露晶面所占总面积的比例发生了变化。在这种情况下,HAP表面蛋白质吸附性能与比表面积无直接关系。这是因为HAP不同晶面对蛋白质吸附的性能不同,当HAP颗粒暴露晶面的组成不固定时,HAP比表面积的增大并不意味着HAP单位面积中蛋白质吸附位点的增多,因而不能决定HAP的蛋白质吸附性能。例如,Zhuang等制备了纤维状HAP(fHAP)、片状HAP(pHAP)(见图4),比表面积分别为4.28、17.51 m2/g,蛋白吸附实验发现:fHAP、pHAP对BSA的饱和吸附量分别为9.0、7.9 μg/mg,fHAP的比表面积小于pHAP的比表面积(SSAfHAP

图4 HAP的扫描电镜图。(a)fHAP;(b)pHAP(比例尺:10 μm)[30]Fig.4 SEM images. (a) fHAP; (b) pHAP (scale bars:10 μm)[30]
2.2.3HAP微结构中的孔隙尺寸
孔隙是HAP微结构中常见的一种,孔隙的存在导致HAP比表面积增加。当孔隙尺寸大于蛋白质分子尺寸时,蛋白质分子可以进入孔隙发生吸附,因而单位质量HAP的蛋白质吸附量随比表面积增大而增大;相反,当孔隙尺寸小于蛋白质分子尺寸时,蛋白质分子不能进入孔隙发生吸附,因而单位质量HAP的蛋白质吸附量不随比表面积增大而增大。例如,Fujii等制备了具有10 nm介孔的HAP颗粒,介孔的引入使HAP的比表面积由对照组的50 m2/g增大至220 m2/g[34]。蛋白吸附实验发现:单位质量含介孔的HAP对β2-MG(分子尺寸为4.5 nm×2.5 nm×2 nm)的饱和吸附量由0.1 μg/mg增大至0.44 μg/mg,升高4.4倍,与比表面积的增大倍数相同;而单位质量含介孔的HAP对BSA(分子尺寸为4 nm×4 nm×16 nm)的饱和吸附量未发生明显变化。
2.3 吸附环境
蛋白质吸附环境是指蛋白质发生吸附的水溶液的参数条件,主要包括溶液中无机盐离子的种类及浓度、温度和pH值等因素。众多研究发现,影响HAP表面蛋白质吸附性能的环境因素主要有Ca2+浓度、PO43-浓度、pH和温度等。
2.3.1PO43-
PO43-是HAP晶格的构成离子,也是体液中重要的无机盐离子。研究表明:在蛋白质吸附中,PO43-抑制酸性蛋白质在HAP表面的吸附;在低浓度范围内,PO43-促进碱性蛋白质在HAP表面的吸附。例如,Giichiro等研究发现:在0.002~0.2 mol/L的PO43-浓度范围内,随着PO43-浓度逐渐增大,HAP颗粒对BSA的吸附量逐渐减小;而对LYS的吸附量是先增大,当PO43-浓度超过0.01 mol/L后,HAP对LYS的吸附量又逐渐减小[35]。Yang等也发现,PO43-和BSA在HAP表面具有竞争吸附关系,PO43-能够有效抑制BSA分子在HAP表面的吸附[36]。Smith等使用化学力显微镜观察到,随着吸附环境中PO43-的加入,BSA分子在HAP表面的吸附受到抑制[37]。笔者曾研究了吸附环境中PO43-浓度对HAP的ζ电位和蛋白质吸附性能的影响,得到了类似的结论,研究认为:随着PO43-浓度升高,溶液中的PO43-逐渐吸附于HAP表面的Ca2+位点(C位点[27]),使BSA的吸附位点减少,因而HAP对BSA的吸附量随PO43-浓度增大而逐渐减小;对于LYS的吸附,当PO43-浓度较小时,PO43-吸附于HAP表面,使HAP表面负电性增加,HAP与LYS之间静电作用增强,导致对LYS的吸附量增加;当PO43-浓度较大时,溶液中PO43-与LYS分子之间的静电作用增强,同时伴随溶液中离子强度的增大,HAP表面双电层被压缩,负电性减弱,HAP与LYS分子之间静电作用逐渐减小,导致对LYS的吸附性能减弱[31]。
2.3.2Ca2+
Ca2+同时存在于HAP晶体和体液环境中,对不同种类蛋白质在HAP表面的吸附性能具有重要的调控作用,关于其调控机理主要有两种解释。
一种观点认为,Ca2+可以调控HAP表面的电荷性质,进而调控HAP的蛋白质吸附性能。在不含有Ca2+的环境中,HAP表面带负电荷[38]。Yin等发现,随着吸附环境中Ca2+浓度逐渐增大,HAP表面电荷逐渐由负电转变为正电,并且正电性逐渐增强,当Ca2+浓度大于0.005mol/L时,HAP表面的正电荷不再增加;蛋白吸附实验发现,HAP对BSA的吸附量也随Ca2+浓度增大而增大,当Ca2+浓度增大至0.005mol/L时,HAP对BSA的吸附量达到最大,与HAP的ζ电位随Ca2+变化的规律一致[39]。类似的,Boix发现,BMP-2(酸性蛋白,pI≈5)在HAP表面的吸附量也随吸附环境中Ca2+浓度的增大而增大[40]。Yin等认为,这是由于Ca2+吸附于HAP表面,导致HAP表面正电性增强,进而对BSA的吸附量增大,当Ca2+浓度大于0.005 mol/L时,Ca2+的吸附达到饱和,因而对BSA的吸附量达到最大[39]。
另一种观点认为,Ca2+能够改变蛋白质分子的构象,进而调控蛋白质在HAP表面的吸附行为[41-42]。Roy发现,吸附环境中Ca2+能促进基质Gla蛋白在HAP表面的吸附,Ca2+诱导基质Gla蛋白发生了有利于在HAP表面吸附的构象变化[43]。Wallin等利用圆二色谱研究基质Gla蛋白中α-螺旋的含量,发现在含有Ca2+的环境中基质Gla蛋白的α-螺旋的含量明显增高,同时基质Gla蛋白在HAP表面的吸附量增大,认为α-螺旋结构有利于基质Gla蛋白在HAP表面发生吸附[44]。类似的,Wians等也发现,吸附环境中加入Ca2+后,骨钙蛋白(OC)中α-螺旋的含量明显增加,同时OC在HAP表面的吸附量增大[45]。Hauschka等发现相似的结论,并认为钙离子的存在使蛋白质中α-螺旋结构增加,后者有利于在HAP表面发生吸附,因而使蛋白质在HAP表面的吸附性能增强[46]。
2.3.3pH
pH是一项重要的生理环境参数,对蛋白质在HAP表面的吸附具有重要影响。Sharpe等发现,pH能有效调节转铁蛋白在HAP涂层表面的吸附性能[47]。Wassell等发现,HAP对BSA的最大吸附量和吸附常数都随pH增大而逐渐减小[48]。笔者曾研究了吸附环境pH对HAP表面ζ电位及蛋白质吸附性能的影响,发现在pH为5~11的范围内,随着pH的增大,HAP表面负电性逐渐增强,对BSA的吸附量逐渐减小,对LYS的吸附量逐渐增大[31]。笔者认为,这是由于pH调节HAP与蛋白质分子之间的静电作用程度所致,随着pH增大,HAP表面吸附的OH-增加,HAP表面负电性增强,导致HAP对BSA(酸性蛋白质)的吸附量逐渐减小,对LYS(碱性蛋白质)的吸附量逐渐增大;pH的变化有可能导致BSA分子的构象发生变化,使BSA在HAP表面吸附的机制发生变化,导致蛋白质吸附性能发生变化。
2.3.4温度
温度对不同蛋白质在HAP表面的吸附行为的影响不同。Yang等利用石英晶体天平技术,系统地研究了温度对HAP表面BSA吸附性能的影响,发现随着吸附温度升高,BSA的吸附量逐渐增大[36]。他们认为,这是因为高温条件下BSA分子向HAP表面扩散的速率增大,导致BSA在HAP表面的吸附量较大。
相反,Hlady等发现,人血清白蛋白(HSA)在HAP表面的吸附量随温度升高而降低,认为这是因为HSA在HAP表面的吸附属于放热反应,低温有利于吸附的进行[49]。Dillman等的研究得到同样的结论,发现血清蛋白在高分子薄膜表面的饱和吸附量也随体系温度升高而降低[50]。
3 应用研究
3.1 药物缓释载体
近年来,为了提高HAP材料骨诱导性能,载BMP等促骨生长蛋白的HAP被用于骨组织修复的研究,其中HAP的载药量和对药物的缓释性能是研究的热点。Dasgupta等发现,通过掺杂Zn元素可以提高HAP对BSA的载药量,同时可以调控BSA的缓释行为[51]。为了提高HAP对蛋白质类药物的缓释效果,Fu等制备了空心结构的HAP微球,中空结构进一步提高了对BSA的载药量,达126 μg/mg;对具有中空结构的HAP进行烧结后,微球壳层中形成中孔,中孔结构的限制作用和静电引力作用有效减缓了BSA的释放,使载BSA的HAP微球在植入14 d内表现良好的药物缓释性能[52]。类似的,为了防止植入后发生药物的突释,Liu等采用原位合成法,在HAP成核、生长的环境中引入BSA分子,使BSA分子嵌入到HAP的晶体结构中,避免了表面物理吸附载药引起的药物突释,实现了更长时间的药物缓释[53]。Xie 等体外研究了纳米HAP对BMP-2的载药和缓释性能,发现纳米HAP颗粒对BMP-2的载药量较好,达70 μg/mg,在植入14 d内具有较平稳的缓释效果[54]。
3.2 骨组织工程支架
骨组织工程支架是指由细胞(或生长因子)、生物材料组装而成,能够在修复初期提供力学强度并且支持新骨长入的人造生物材料支架。研究发现,骨形态发生蛋白(BMP)可以促进新骨生长,在骨修复领域具有较好的应用前景,具有装载BMP功能的支架材料的设计和制备成为研究的热点。有的研究者利用高分子、HAP,分别模拟生物骨组织中的有机、无机成分;利用HAP对BMP强烈的吸附作用,提高BMP的载药量,结合高分子材料适宜的强度和降解性能,使该类复合材料具有良好的骨组织修复功能。例如,Kaito等制备了载BMP-2的HAP/PLA-PEG骨修复支架,利用兔桡骨缺损评价支架的修复性能,发现植入8周后,骨缺损完全修复且强度良好[55]。值得注意的是,载BMP-2的量仅为之前研究中所需BMP-2含量的10%,极大降低了BMP-2过量导致的风险。这主要是因为HAP本身具有骨诱导性能,同时贯通多孔结构有利于新骨向材料内部长入。
另外,HAP和BMP还可以进一步提高静电纺丝纤维的成骨分化性能。静电纺丝纤维具有特殊的纤维结构,有利于干细胞骨性分化。Li等将纳米HAP颗粒与BMP-2成分加入到静电纺丝纤维中,体外人骨髓间充质细胞(hMSCs)培养发现:加入BMP-2和HAP成分的纤维,诱导hMSCs骨性分化的能力更强;同时BMP-2和HAP成分的加入,促进了纤维上钙盐的沉积及具有晶体结构的骨组织的形成。这说明,HAP和BMP-2能够有效地增强静电纺丝纤维材料的骨诱导性能[56]。
4 结语与展望
HAP表面蛋白质吸附问题涉及生物、材料、物理、化学、医学等多个学科,展现出巨大的理论价值和应用价值,始终是研究的重要热点之一。随着科学技术的发展,现代分析检测技术不断创新和组合,诸如原子力显微镜、表面等离子共振、耗散型石英晶体微天平和计算机分子模拟等技术逐渐地被运用于HAP表面蛋白质吸附问题的研究,使研究从简单的对吸附量的定量深入到分子构象的变化、分子形貌及吸附的动态过程等层面,极大地增进了人们对该问题的理解。有理由相信,随着未来更加先进的检测技术运用于该领域,对HAP表面蛋白质吸附的认识将进一步深入。
