鼠疫历史疫情的考古微生物学研究进展
2019-01-21亚军
,,,3,亚军,3
鼠疫是由鼠疫耶尔森氏菌(简称鼠疫菌)引发的一种自然疫源性疾病。鼠疫作为一种发病急、传播快、病死率高、传染性强的烈性传染病,在人类历史上曾发生过3次世界性大流行:第一次大流行始于公元541-544年的古罗马帝国,一直持续到公元767年,史称查士丁尼瘟疫[1]。该流行起源于亚洲中部,经地中海沿岸蔓延到北非、欧洲大陆乃至不列颠群岛,累计造成一亿人死亡[2]。暴发于公元1347年的第2次鼠疫大流行(史称黑死病)同样起源于亚洲,经古代丝绸之路抵达欧洲的地中海港口,波及亚洲、欧洲大部及非洲北部,并伴随着周期性暴发持续到18世纪[3]。第3次鼠疫大流行起始于19世纪50年代的中国云南,随后于1894年经香港传播到全球[1, 4-5]。微生物学家Alexandre Yersin于1894年在香港患者体内分离得到鼠疫菌,进而确认了鼠疫菌是引发现代鼠疫大流行的罪魁祸首[6]。而由于前两次鼠疫大流行在临床症状、传播速率及死亡率等方面与第3次存在一些差异,关于其病原体是否为鼠疫菌的问题曾一度处于争论之中[7];近来,随着考古微生物学(Paleomicrobiology)的发展,这一争论已基本得到解决。
考古微生物学最早可追溯到19世纪20年代,旨在通过研究古人体或古环境样本中的病原体信息来建立古代传染病的诊断体系,并结合相关历史记录,以更好地阐释古代病原体的进化、毒力状态、疫源地、传播媒介、传播路线等问题[8]。支撑该领域的原理是,尸骸内特定组织能够保存导致个体死亡的病原体的DNA或蛋白质等生物大分子[9]。尽管特定环境下古DNA能够长期保存,但水解作用及化学损伤等导致的DNA降解仍是考古微生物学面临的主要挑战。此外,由于实验过程中可能会出现当前生物分子的污染,严格无菌操作和实验对照便成为考古微生物学这一领域发展的必要基础。迄今为止,已从很多考古样本中分离得到古微生物DNA,包括冻土、琥珀、骨骼、内脏器官、牙髓和粪化石等[9]。考古微生物学研究方法主要包括显微观察、免疫检测、PCR测序和系统发育分析等。其中,基于古DNA的系统发育分析能够确定病原体基因组的变异情况,揭示其可能的进化过程,进而阐明传染病的扩散路径;鼠疫历史疫情的相关研究是考古微生物学研究中一个比较成功的范例。
1 基于PCR的古DNA检测
由于鼠疫会导致菌血症,而牙髓是牙齿中高度血管化的软组织,加之牙齿良好的封闭环境,使得古代病原体DNA在牙齿中的长期保存成为可能[3]。1998年,Drancourt等以牙髓为检测样本,以鼠疫菌特异性基因pla为靶基因,对法国普罗旺斯地区两处万人冢出土的疑似鼠疫患者残骸进行核酸检测。在获得的12颗牙齿中,有6颗检测到pla特异性片段,且DNA序列与现代鼠疫pla序列一致;用于扩增ropB片段的4颗牙齿,在经过两轮PCR后,获得预期片段;而用作阴性对照的7颗牙齿全部未检出鼠疫菌。这一研究首次从实验室诊断的角度确定,1722年马赛大瘟疫(黑死病)的病原体是鼠疫菌,并建立了基于核酸分子鉴定对古代鼠疫进行检测的方法,成为后续工作的借鉴[10]。
样本污染是古DNA检测最需要注意的问题之一,为解决这一风险,研究人员设计了"自杀PCR"的检测方案,陆续确认了鼠疫菌是欧洲黑死病及查士丁尼大瘟疫的罪魁祸首[11-12]。在随后的研究中,基于核酸检测的新方法不断应用于古代鼠疫菌的检测鉴定,包括基因间区分型系统[13-14]、简单的系统发育分析[15-16]以及16S rRNA序列测定[17]等(表1),在很大程度上推动了古代鼠疫的实验室诊断及鼠疫菌的分子鉴定工作,使之前仅仅基于人类学数据或历史文献记载的鼠疫病因学推测得以证实。
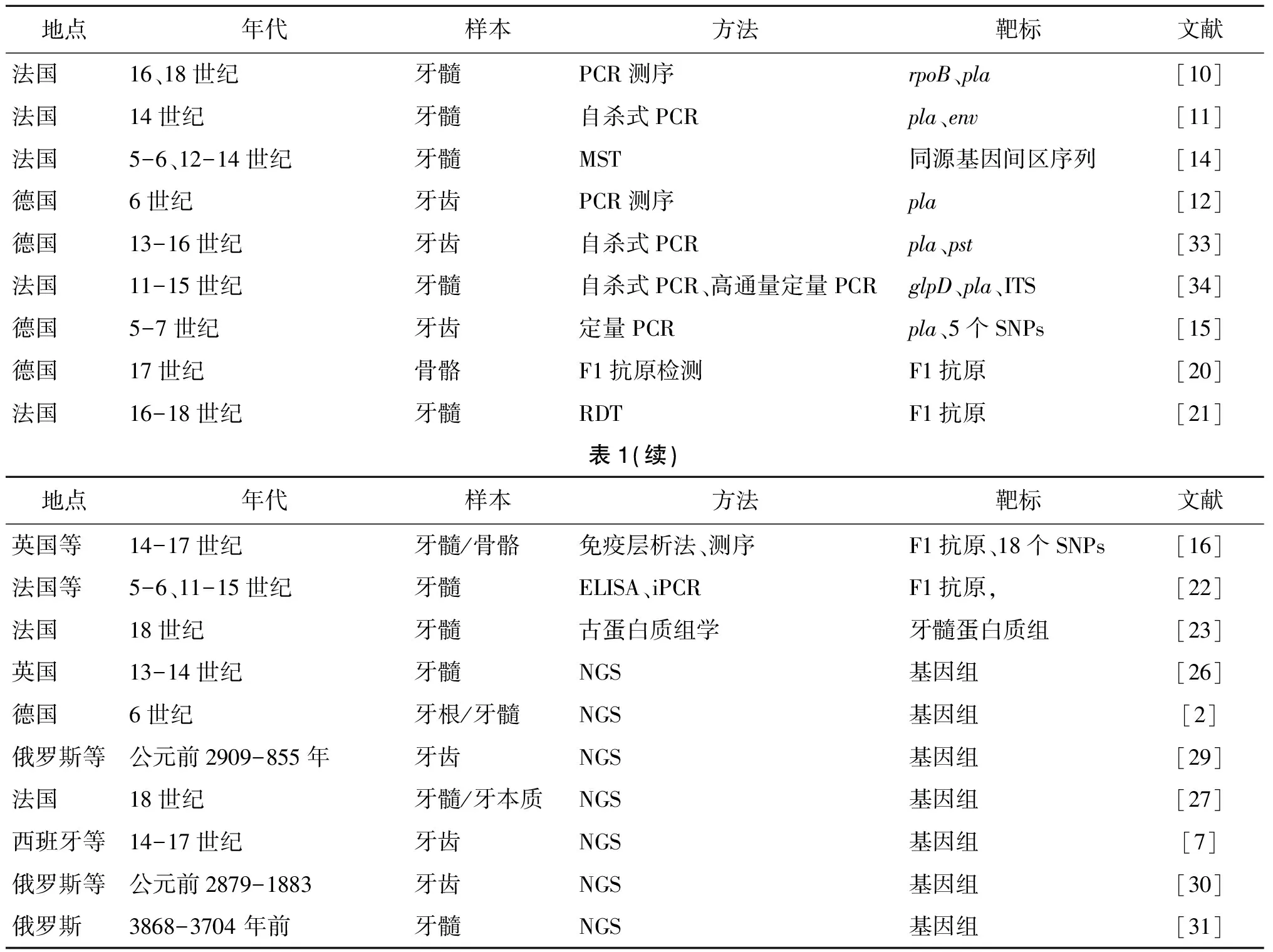
表1 鼠疫考古微生物学研究概览Tab.1 Overview of paleomicrobiological researches on ancient plague pandemics
MST: multiple spacer typing,多间区分型;RDT: rapid diagnostic dipstick test,快速试纸条检测;iPCR: immuno-PCR,免疫PCR;NGS: next generation sequencing, 二代测序。
2 古代鼠疫菌的蛋白质检测
研究表明,蛋白质在某些考古样本中能保存更长时间[18],因此对鼠疫菌特异性蛋白质的检测可作为古代鼠疫检测方法的补充。F1蛋白是鼠疫菌产生的一种特异性荚膜抗原,也是鼠疫实验室诊断中必不可少的靶标[19]。鼠疫菌存活与否、样本存留时间等一般不会影响F1抗原的检测结果[20],这也为古代鼠疫菌的免疫检测提供了可能。Pusch等人于2004年首次通过免疫层析试纸,在德国一处教堂埋葬的17世纪的骨骼残骸中检测到鼠疫菌F1抗原。在此研究中,研究人员根据埋葬的尸体是否经过石灰消毒处理来初步判断是否死于鼠疫,随后分别选取死于黑死病和正常死亡的各12具尸骸作为样本,采用DNA杂交及免疫层析两种方法同时进行检测。结果显示,在死于黑死病的12具尸骸中,通过特异性扩增caf1基因片段,仅有2个样本得到阳性结果,而通过免疫层析方法可检测到10个样本呈阳性,说明F1抗原蛋白相较于其编码基因caf1的保存更加持久和完整[20]。该研究表明,古代鼠疫患者遗骸中F1抗原含量足够用于检测鉴定,这为古代鼠疫的抗原检测奠定了基础。此后,研究人员不断改良古代鼠疫菌的F1抗原检测方法,包括快速检测试纸试验(RDT)[21-22]、iPCR等技术[22],大大提高了古代鼠疫菌F1抗原检测的灵敏度(表1)。
除单一F1抗原检测外,Drancourt等还将蛋白质组学技术应用于18世纪的鼠疫遗骸的分析。该研究将牙髓蛋白提取纯化后,通过质谱分析发现,在鉴定的211个细菌源性多肽中有4个多肽分属于3个耶尔森氏菌属蛋白,其中的一个多肽仅与假结核耶尔森氏菌和鼠疫菌完全匹配。此外他们还发现,古遗体牙髓中可以检测到免疫球蛋白,提示考古遗骸牙髓的蛋白质组学也可用于研究病原和宿主炎症反应,使得古代疾病的血清学检测成为可能[23]。Righetti等开发了一种EVA film(乙烯-乙酸乙烯酯共聚物胶膜)技术应用于1630年意大利鼠疫考古材料的宏蛋白质组学分析,确认检测得到的17种耶尔森氏菌属蛋白质是由鼠疫菌产生的[24]。基于古蛋白质组学技术分析考古鼠疫相关样本,可以通过多个鼠疫菌蛋白对古代鼠疫样本进行更为全面的检测和确认,提高样本检出率和结果可靠性。
3 古代鼠疫菌的基因组DNA分析
基因组学分析,不仅可以检测古代样本中是否存在鼠疫菌核酸,还可基于全基因组序列信息,回答古代鼠疫菌进化、毒力因子获得或缺失以及鼠疫传播扩散等更为复杂的问题[25]。
2010年Bramanti等通过部分基因组分析,将检测到的黑死病菌株在鼠疫菌的系统发育树上进行定位[16]。2011年,Bos等基于鼠疫菌CO92株基因组设计芯片,富集黑死病遗骸牙髓中的鼠疫菌DNA,完成了第一株古代鼠疫菌基因组草图测定。系统发育分析表明,该菌株是大部分现存鼠疫菌株的祖先,同时确认对人类致病的当代鼠疫菌很可能起源于中世纪时期。但该菌株与现代鼠疫菌基因组相比,未发现独特的SNP位点,从遗传学上难以解释黑死病的高致死率,还需要结合其他诸多因素进行深入研究[26]。Bos等人此后又测定了5株马赛大鼠疫时期的鼠疫菌基因组,确认该时期的鼠疫菌是14世纪黑死病菌株的后代,但该谱系在任何现存鼠疫疫源地都没有发现。基于以上研究,Bos等推测引发黑死病的鼠疫菌株的后代在某种未知的宿主体内潜伏数百年,产生了多样化并最终导致18世纪中期的马赛鼠疫大流行[27]。关于第二次鼠疫大流行为何能够在欧洲持续数个世纪之久的争论,主要存在两种观点:一种是认为黑死病时期的鼠疫是单一菌株的传播导致,该菌株长期在欧洲潜伏并引发流行性鼠疫[7];另一种观点则认为第二次鼠疫大流行是亚洲鼠疫多次向欧洲传播的结果[28]。但目前缺乏决定性证据证实任一假设,仍需要更多古代鼠疫菌基因组测定分析。
2014年,Wagner等测定了德国墓葬得到的两株查士丁尼鼠疫时期的鼠疫菌基因组,根据其在鼠疫菌系统发育树的位置,认为导致前两次鼠疫大流行的菌株都是早期中亚谱系的后代,同时是一些中国菌株的祖先,并推测导致查士丁尼鼠疫的菌株在第二次大流行前已经灭绝[2]。关于查士丁尼鼠疫起源及传播路线问题,Wagner提出该谱系起源于中国,经丝绸之路等贸易路线传播至整个欧亚大陆,而第二次大流行从亚洲传播到欧洲后,又沿尼罗河传播到中非地区[2]。
经蚤传播的能力是鼠疫菌毒力研究中的一个关键问题,而鼠疫菌历史菌株基因组的测定为相关毒力因子的获得缺失研究提供了依据。Rasmussen等测定了7株青铜时代的鼠疫菌基因组,发现该时期菌株缺少引发腺鼠疫的必要点突变(Pla的Ile259Thr突变)[29]。2017年,古人类学家Krause等又测定了6株新石器时代晚期至青铜时代(3700至4800年前)欧洲鼠疫菌株(LNBA谱系)的基因组,发现LNBA菌株已具备在其祖先假结核耶尔森氏菌中不存在的pla和caf1毒力基因[30],但缺失了在蚤传播途径中起重要作用的鼠毒素基因ymt,而且ureD基因(编码脲酶D蛋白,对蚤致死,失活后使鼠疫菌获得经蚤传播能力)能够正常表达,这表明跳蚤很可能不是当时鼠疫传播的主要媒介,支持了该时期鼠疫菌缺乏腺鼠疫感染模式的理论[30]。值得一提的是,LNBA谱系是目前已知最古老的鼠疫菌;这一研究将鼠疫菌的物种形成时间定位在5000-7500年前,是目前最为精确的鼠疫菌起源时间估算[29-30]。2018年,Spyrou等测定了两株分离自俄罗斯的与LNBA谱系同时期的鼠疫菌基因组,但该谱系在系统发育树中形成一个独立的分支,并且已具备经蚤传播的关键基因,说明其已能够适应跳蚤这一传播媒介[31]。此外,该谱系在系统发育树上与0.PE4(田鼠型鼠疫菌)虽然位置相近,但致病性却存在显著差异,后续研究可以通过基因组的差异分析来探究二者毒力的差异原因。
4 小 结
据WHO报导,自2017年8月马达加斯加鼠疫暴发后仅4个月时间,已确认鼠疫病例2 417例,且超过100人死亡[32]。可以预见,马达加斯加以及其他一些鼠疫疫源地仍会暴发疫情,将对世界医疗和公共卫生界构成极大的挑战。因此,对鼠疫菌的进化路线、毒力变化及致病机制的研究仍是至关重要的。无论是从核酸或蛋白质方面,考古微生物学都将为以上研究提供一个崭新的视角,使我们通过分析历史上鼠疫疫情流行情况及鼠疫菌遗传特征,进而探究其传播方式及致病机制。然而,由于历史不可重现,研究人员只能通过历史记载及考古微生物学研究间接地推测古代鼠疫流行的场景;而考古微生物学研究样本中的核酸和蛋白质都是痕量的,这一固有的局限性势必导致争议性结果的存在。在接下来的研究中,可以现有研究为基础,在继续探索新的古代鼠疫菌株基因组信息的基础上,参考同时期流行地域的历史人文资料,获得更为可靠的结果。
考古微生物学在鼠疫历史疫情研究中的成功实践表明,这一新兴学科将考古学、人类学、古地理学、古生态学与微生物学数据相结合进行整体研究,为更加全面、准确地解释古代传染病的起源、传播及病原体进化等问题提供新的思路[33]。
