M13-IN5重组噬菌体的构建与鉴定及其对沙眼衣原体的作用研究
2019-01-21练婷婷魏世娟刘原君任杰王生郭媛丽郭睿刘全忠邵丽丽
练婷婷 魏世娟 刘原君 任杰 王生 郭媛丽 郭睿 刘全忠 邵丽丽
300052天津医科大学总医院皮肤性病科
沙眼衣原体(Ct)泌尿生殖道感染的发病率逐年增高,已居性传播疾病的首位[1]。据WHO统计,全世界每年大约新发沙眼衣原体感染约9 200万例[2]。约2/3的沙眼衣原体感染者没有临床症状,易被忽视,导致衣原体在宿主体内持续感染,引起一系列严重的并发症和后遗症[3]。虽然许多学者把精力投入到衣原体疫苗研究中,但迄今为止尚未获得具有免疫保护作用的疫苗[4],而且目前抗生素治疗效果不佳,难以将衣原体彻底清除[5]。衣原体噬菌体是一种以衣原体为宿主的噬菌体,能引起衣原体始体裂解性感染,并依靠简单的黏附作用传给下一代原体,目前衣原体噬菌体已因为能够引起衣原体病变并裂解而作为生物制剂用于衣原体感染的治疗[6]。但是迄今仍没有发现Ct的噬菌体。我们前期将纯化的衣原体噬菌体衣壳蛋白VP1作用于Ct,发现其能明显抑制Ct,对VP1蛋白进行分析推测IN5环为最重要的功能区[7]。本研究通过构建带有IN5环蛋白序列的重组噬菌体,观察其体外对Ct的作用,希望为Ct感染提供精准、特异、有效的生物治疗。
材料与方法
一、实验材料
Hela细胞株、Ct E型标准株和鼠抗VP1多克隆抗体由天津性传播疾病研究所提供。M13噬菌体及大肠杆菌E.coliK12标准株ER2738和ECORI限制性内切酶产自美国NEB公司,In-Fusion HD克隆试剂盒和Taq DNA聚合酶为日本TaKaRa公司产品,预染蛋白分子量标记物为美国Thermo公司产品,碱性磷酸酶缀合的Affinipure山羊抗小鼠IgG产自美国Proteintech公司,兔抗FD段噬菌体抗体产自美国R&D公司,异硫氰酸荧光素(FITC)标记的山羊抗兔IgG二抗及Alexa Fluor594标记的山羊抗鼠IgG二抗产自北京索莱宝公司,CCK8试剂盒产自美国MCE公司,所有引物均由苏州金唯智(北京)生物科技有限公司合成。
二、细胞培养
取对数生长期Hela细胞,制备Hela细胞悬液接种至24孔板,细胞密度4 × 105/ml,每孔500 μl,置于37℃、5%CO2孵箱中培养至70%~80%的密集度。
三、构建重组噬菌体
利用DNA重组技术,构建表达衣原体噬菌体phiCPG1衣壳蛋白VP1的IN5环蛋白的重组M13噬菌体,将外源基因直接连接至pIII蛋白编码基因的5′端,在噬菌体装配过程中展示在噬菌体表面,产生与pIII蛋白融合的外源蛋白质,见图1。具体步骤如下:采用PCR技术扩增获得线性M13载体,正向引物 5′-GATTTAGGTTCGACTTCTTCGGCCGAAACTG TTGAAAGTTG-3′,反向引物5′-AACAGGAACAATA CCAGAGTGAGAATAGAAAGGTACCACTAAAGG-3′;反应条件为94℃ 4 min,94℃ 30 s、65℃ 40 s、72℃40 s共30个循环,72℃10 min。根据IN5基因序列设计引物,引物5′端包含将要连接的DNA片段末端完全同源的15个碱基,正向引物5′-GTACCTTTCTATTCTCACTCTGGTATTGTTCCTGTTCAAGGTTTAGG-3′,反向引物5′CTTTCAACAGTTTCGGCCGAAGAA GTCGAACCTAAATCTACATAAGCCC-3′,反应条件为94 ℃4 min,94 ℃30 s、65 ℃40 s、72 ℃ 40 s共30个循环,72℃10 min。采用10 g/L琼脂糖凝胶电泳检测PCR产物,通过凝胶提取分离目的片段进行离心柱纯化。建立In-Fusion克隆反应体系,包括5×In-Fusion高保真PCR酶2 μl、线性化载体1 μl、纯化的DNA插入片段2 μl、去离子水5 μl,混合均匀后在50℃孵育15 min,然后转入ER2738大肠杆菌感受态细胞,加入500 μl LB培养基,混匀后置于37℃,160 r/min振荡培养1 h,然后将已转化的感受态细胞加到50 mg/L LB琼脂培养基上,倒置平板,37℃过夜。

图1 M13-IN5重组噬菌体构建策略图
四、重组噬菌体目的基因检测
1.PCR扩增IN5环目的片段:从实验平板中挑取重组噬菌体单克隆,用试剂盒(北京索莱宝科技有限公司)提取噬菌体DNA,进行PCR扩增。正向引物5′-GTACCTTTCTATTCTCACTCTGGTATTGTTC CTGTTCAAGGTTTAGG-3′,反向引物5′-CTTTCAAC AGTTTCGGCCGAAGAAGTCGAACCTAAATCTACA TAAGCCC-3′。PCR反应体系为50 μl,包括高保真扩增酶25 μl、上下游引物各1 μl、重组噬菌体DNA 2 μl,加入无酶水至总体积50 μl。扩增条件:98 ℃2 min;98 ℃ 10 s,56 ℃ 10 s,72 ℃ 20 s,30个循环;72℃5 min。将PCR产物进行10 g/L琼脂糖凝胶电泳。
2.酶切验证:将重组噬菌体阳性克隆DNA进行ECORI单酶切,反应体系 50 μl,包括 DNA 4 μl、ECORI酶1 μl、10 × NE 缓冲液5 μl、无酶水 40 μl。60℃水浴1 h,琼脂糖凝胶电泳,凝胶影像分析仪观察电泳条带。酶切验证正确的重组噬菌体DNA由苏州金唯智(北京)生物科技有限公司测序。
五、重组噬菌体活性检测
用LB培养基稀释重组噬菌体至效价108~1011噬斑形成单位(PFU)/ml,将10 μl噬菌体液加入90 μl含对数生长中期大肠杆菌ER2738的菌悬液,室温孵育5 min,加入3 ml 45℃顶层琼脂糖凝胶,混匀,立即倾倒至预热的LB平板上,37℃倒置培养过夜。计数噬菌斑,噬菌体效价(PFU/ml)=噬菌斑数×稀释倍数×10。
六、细胞增殖活性检测
向96孔板中加入Hela细胞悬液,每孔100 μl(4× 105/ml),37℃、5%CO2培养箱中预培养24 h,加入10 μl效价为1011PFU/ml的M13噬菌体或M13-IN5重组噬菌体,同时以未感染衣原体的Hela细胞作为空白对照组,每组设置3个复孔,将培养板在37℃、5%CO2培养箱中孵育24 h。向每孔加入10 μl CCK8溶液,孵育4 h,Bio-Rad酶标仪检测450 nm波长处各孔吸光度(A值)。每个实验重复3次。
七、重组噬菌体目的蛋白表达的检测
取重组噬菌体液、M13噬菌体液、对数期ER2738菌液各100 μl,噬菌体效价均为1011PFU/ml,加入1 μl苯甲基磺酰氟(PMSF)和100 μl RIPA裂解液,振荡10 s,冰上孵育5 min,重复3次,15 450 ×g4℃离心10 min,取上清液。加5×十二烷基硫酸钠(SDS)蛋白样品上样缓冲液95℃孵育10 min变性蛋白。免疫印迹鉴定目的蛋白,操作如下:15%SDS-聚丙烯酰胺凝胶电泳(PAGE)分离蛋白,湿转(300 mA、1 h)至聚偏二氟乙烯(PVDF)膜上,1×TBST缓冲液洗涤3次,3%牛血清白蛋白室温封闭2 h,加入一抗(小鼠源性VP1多克隆抗体,1∶1 000稀释),4℃封闭过夜,TBST洗涤3次,每次10 min,加入二抗(碱性磷酸酶缀合的Affinipure山羊抗小鼠IgG,1∶1 000稀释),室温封闭2 h,TBST洗涤3次,每次10 min,显影目的蛋白。
八、共聚焦显微镜定位噬菌体
将500 μl Hela细胞(4× 105/ml)接种至24孔板,在37℃、5%CO2孵箱中培养至70%密集度时,分为3组,即衣原体对照组、M13噬菌体组、M13-IN5噬菌体组,各组每孔均按照MOI[衣原体原体(EB)数/Hela细胞数]为1加入E型Ct标准株,同时M13噬菌体组、M13-IN5噬菌体组加入200 μl效价为1011PFU/ml的M13噬菌体和M13-IN5重组噬菌体,32℃ 206×g离心1 h,37℃、5%CO2孵箱培养,衣原体对照组不加噬菌体,直接培养,每组设3个复孔。在衣原体感染后36 h,弃培养液,PBS冲洗3次,每次5 min,待完全干燥;加冰甲醇固定15 min,按上述方法用PBS冲洗;加入0.1%TritonX-100作用10 min,PBS冲洗;加入细胞培养液500 μl/孔,室温封闭1 h,PBS冲洗;同时加入鼠抗EB单克隆抗体(1∶2 000稀释)及兔抗FD段噬菌体抗体(1∶2 000稀释)200 μl/孔,4 ℃孵育过夜,PBS冲洗;加入FITC标记的山羊抗兔IgG二抗及Alexa Fluor594标记的山羊抗鼠IgG二抗(1∶80稀释)50 μl/孔,37℃避光孵育1 h,PBS冲洗;滴加DAPI避光孵育5 min,对标本进行染核,PBS洗4次,每次5 min,用防淬灭封片剂将玻片固定在载玻片上,共聚焦显微镜观察重组噬菌体的位置。
九、重组噬菌体对CtE株生长的影响
Hela细胞干预方法同“八、共聚焦显微镜定位噬菌体”,在衣原体感染后36、48、60、72 h,无水冰甲醇固定15 min,风干,加入卢戈氏碘液,作用1 min,400×光镜下观察包涵体,每孔计数40个视野下的包涵体数目,计算平均值。实验重复3次。
十、干预实验各时段噬菌体效价测定
Hela细胞分组及处理方法同“八、共聚焦显微镜定位噬菌体”,在干预后12、24、36、48、60、72 h收集细胞和培养基,加入数颗无菌小玻璃珠,然后剧烈振荡1 min,825×g离心5 min。取上清液做噬菌体滴度测定,用LB培养基倍比稀释含噬菌体的上清液至效价为105~108PFU/ml,双层平板法测定噬菌体滴度,具体同“五、重组噬菌体活性检测”。计数噬菌斑,计算PFU。
十一、数据分析
应用SPSS17.0软件进行数据处理,结果用±s表示。两样本均数间比较采用t检验,多组样本均数比较采用方差分析,两两组间比较采用Bonferroni检验,以P<0.05为差异有统计学意义。
结 果
一、重组噬菌体目的基因鉴定与测序
将重组噬菌体阳性克隆进行PCR扩增,成功扩增出IN5基因,扩增产物分子长度250 bp,与目的条带分子长度一致(图2)。ECORI单酶切酶将重组噬菌体阳性克隆DNA分成3个片段,分子长度分别为4 827、2 622、13 bp(拷贝数太少,电泳结束时已脱胶,所以曝光分析时未见该条带)(图3)。基因测序显示,重组噬菌体含有目的IN5环序列。
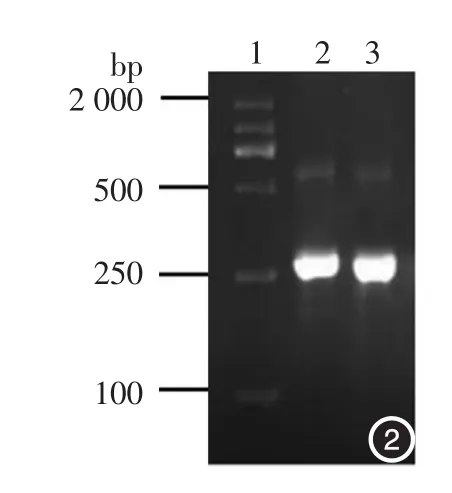
图2 PCR扩增鉴定重组噬菌体 1:DNA标准参照物;2:阳性对照(本实验室前期成功构建的VP1质粒IN5环基因PCR片段);3:M13-IN5重组噬菌体
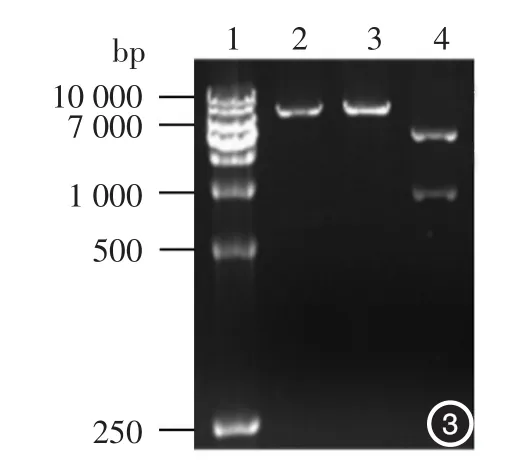
图3 重组噬菌体酶切鉴定 1:DNA标准参照物;2:M13噬菌体(7 225 bp);3:M13-IN5重组噬菌体(7 462 bp);4:M13-IN5重组噬菌体单酶切后形成的DNA片段,长度分别为4 827、2 622 bp
二、重组噬菌体活性
LB平板培养显示,M13-IN5重组噬菌体效价为3.05×1011PFU/ml,提示重组噬菌体具有生物活力。
三、噬菌体对细胞的毒性作用
处理24 h后,CCK8试剂盒检测显示,空白对照组、M13噬菌体组、M13-IN5重组噬菌体组A450值分别为3.63±0.01、3.55±0.02、3.70±0.01,差异无统计学意义(F=12.0,P>0.05)。
四、重组噬菌体目的蛋白的表达
M13-IN5重组噬菌体在相对分子质量约55000处有一较浓的蛋白条带(图4),其大小正好与IN5环和M13噬菌体pIII外壳蛋白的融合蛋白(相对分子质量582 000)大小相当,M13噬菌体和大肠杆菌ER2738在相应位置无条带。

图4 重组蛋白免疫印迹鉴定 M:蛋白分子量标记物;1:IN5环/pIII融合蛋白;2:M13噬菌体;3:大肠杆菌ER2738
五、共聚焦显微镜定位噬菌体
噬菌体和衣原体同时干预Hela细胞36 h后,在共聚焦显微镜下观察噬菌体的定位情况,结果见图5。衣原体对照组中衣原体绿色荧光分布在Hela细胞核附近,M13噬菌体组和M13-IN5噬菌体组中衣原体和噬菌体荧光均分布在Hela细胞核附近,并且部分衣原体荧光和噬菌体荧光有重合。
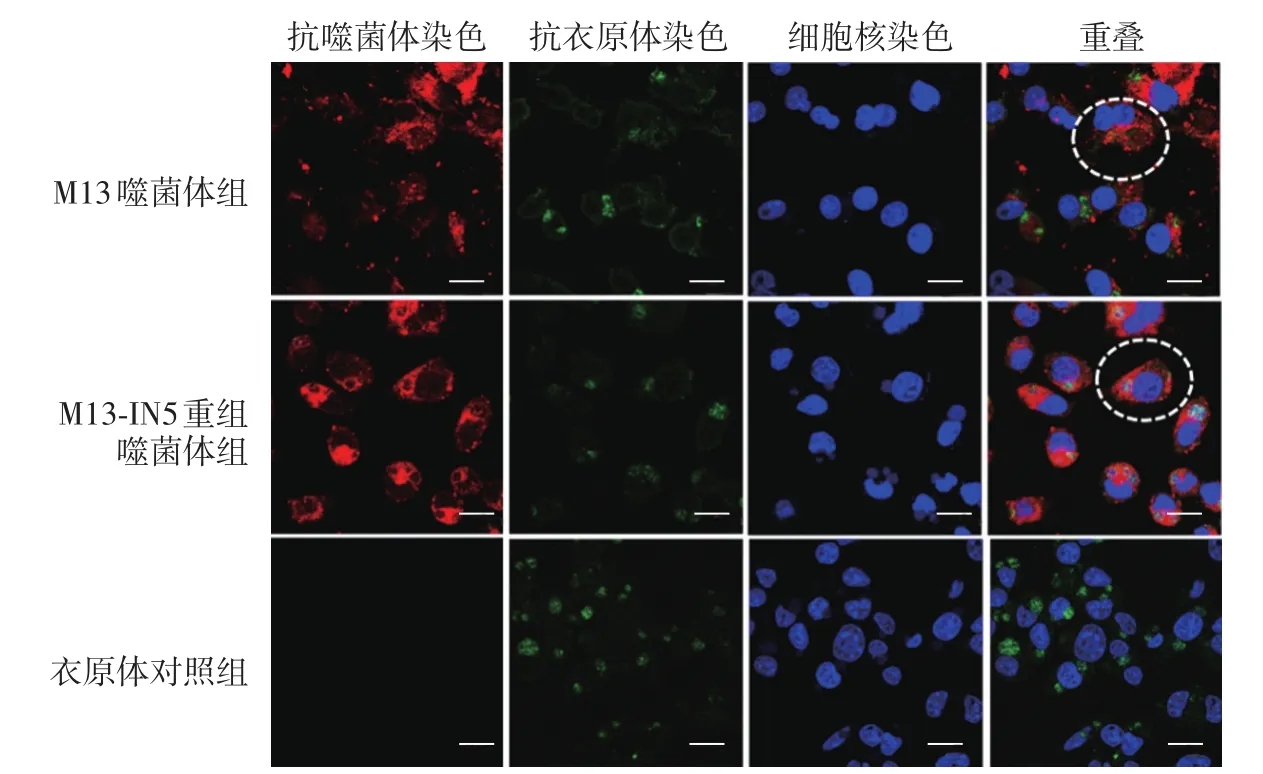
图5 共聚焦显微镜定位噬菌体(63×油镜) 红色代表噬菌体,绿色代表沙眼衣原体,蓝色代表Hela细胞核。衣原体对照组中沙眼衣原体分布在Hela细胞核周围,两噬菌体组中沙眼衣原体和噬菌体均分布在Hela细胞核周围,并且部分噬菌体和衣原体荧光相互重叠。图中标尺=20 μm
六、重组噬菌体对衣原体生长的作用
见图6、表1。衣原体感染后36、72 h,M13噬菌体组、M13-IN5噬菌体组包涵体数目较衣原体对照组降低(均P<0.05),且M13-IN5噬菌体组包涵体数目较M13噬菌体组降低明显(均P<0.05);而衣原体感染后48、60 h,M13噬菌体组、M13-IN5噬菌体组与衣原体对照组包涵体数目差异无统计学意义(P>0.05)。
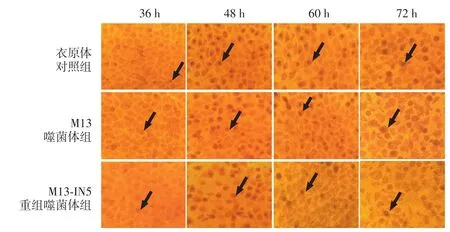
图6 噬菌体干预沙眼衣原体实验(碘染色,×400) 黑色箭头示沙眼衣原体包涵体
表1 噬菌体干预实验中各时段Hela细胞中包涵体数(±s)
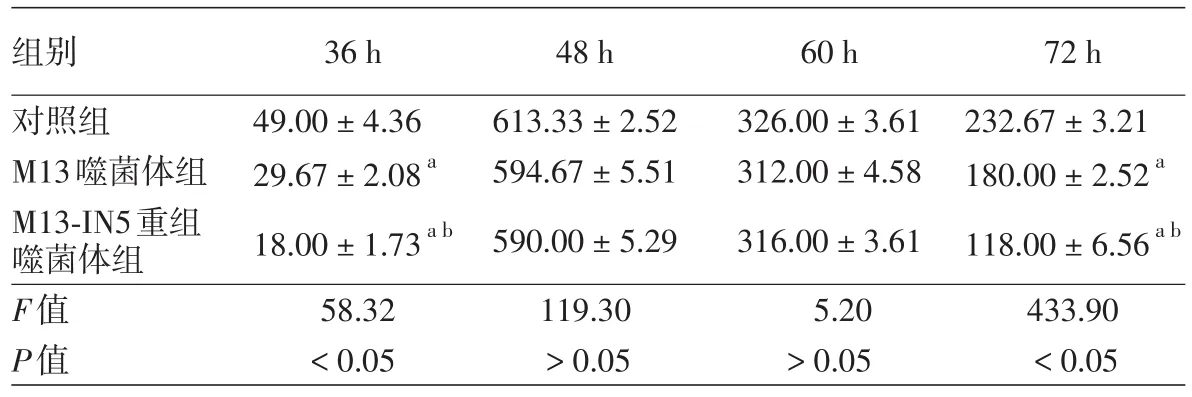
表1 噬菌体干预实验中各时段Hela细胞中包涵体数(±s)
注:n=3。a与对照组比较,P<0.05;b与M13噬菌体组比较,P<0.05或0.01
组别对照组M13噬菌体组M13-IN5重组噬菌体组F值P值36 h 49.00±4.36 29.67±2.08a 18.00±1.73a b 58.32<0.05 48 h 613.33±2.52 594.67±5.51 590.00±5.29 119.30>0.05 60 h 326.00±3.61 312.00±4.58 316.00±3.61 5.20>0.05 72 h 232.67±3.21 180.00±2.52a 118.00±6.56a b 433.90<0.05
七、干预实验各时段噬菌体效价
随着干预时间的增加,噬菌体滴度有所降低,结果见图7。

图7 干预实验各时段噬菌体效价测定
讨 论
1985年,Smith首次将外源基因插入丝状噬菌体基因Ⅲ,使目的基因编码的多肽以融合蛋白的形式展示在噬菌体表面,从而创建了噬菌体展示技术[8],现已广泛应用于抗原抗体库的建立、药物设计、疫苗研究、病原检测、基因治疗、抗原表位研究及细胞信号转导研究等[9]。M13噬菌体是一种温和噬菌体,是较常见的噬菌体展示系统,包含PⅢ、PⅧ及其他展示系统等,并且容易扩增[10]。
目前在鹦鹉热衣原体、家畜衣原体与肺炎衣原体中已经成功发现其对应噬菌体的存在,但是Ct的对应噬菌体却仍未发现。近来,Ct抗生素耐药与持续感染报道屡见不鲜,由于治疗效果欠佳、缺少有效疫苗,对Ct有治疗作用的噬菌体成为研究的重点。目前已知Vp1蛋白是衣原体噬菌体中最大的衣壳蛋白,前期关于衣原体噬菌体phiCPAR39和phiCPG1对衣原体的研究显示,衣原体噬菌体能引起网状体停止分裂,但是不停止复制,不能产生新的原体,电镜下可以观察到形态异常且体积明显增大的形式,称为变异体,从而导致衣原体进入持续感染[11-12]。我们前期实验发现,衣原体噬菌体phiCPG1的衣壳蛋白Vp1对Ct有较强抑制作用,可能在噬菌体的黏附、侵袭、毒力等生物学特性方面具有重要作用,其中IN5环部分可能是潜在的特异结合区[13]。
我们利用基因重组技术,成功构建M13-IN5重组噬菌体,酶切、PCR、测序、Western印迹显示,IN5片段成功连接至M13噬菌体,且IN5-pIII融合蛋白在噬菌体装配过程中展示在噬菌体表面,重组噬菌体效价达1011PFU/ml,提示构建的M13-IN5重组噬菌体具有生物活性。通过共聚焦显微镜观察噬菌体在Hela细胞中的位置,发现衣原体的荧光和噬菌体荧光存在很大程度的重叠,提示噬菌体不仅进入细胞,而且进入衣原体包涵体内。且衣原体干预实验各时段噬菌体效价均大于2×108PFU/ml,提示噬菌体的活性可以维持一定时间。
我们在噬菌体干预实验中发现,衣原体感染36、72 h时,M13-IN5噬菌体组和M13噬菌体组的包涵体数目较衣原体对照组降低,而且M13-IN5噬菌体组包涵体数目较M13噬菌体组有明显降低,而感染48、60 h时M13-IN5噬菌体组、M13噬菌体组、衣原体对照组包涵体数目无明显区别。衣原体感染36 h时处于网状体时期,为衣原体增殖时期,此时噬菌体对衣原体的抑制作用明显;感染48~60 h时衣原体处于原体时期,不增殖,噬菌体对衣原体无明显抑制作用;而72 h衣原体又重新处于增殖期[14],因此,我们认为噬菌体对增殖期的衣原体抑制作用更明显。衣原体增殖阶段,重组噬菌体较M13噬菌体的抑制作用更明显,可能的机制为重组噬菌体进入包涵体内,其衣壳蛋白中表达的IN5蛋白促进重组噬菌体与Ct识别[15],加速噬菌体对衣原体的侵袭过程,噬菌体引起网状体停止分裂,不能产生新的原体,从而导致衣原体感染率降低,然而是否形成与其他衣原体噬菌体类似的变异体以及具体机制还需要更加深入的探索。
Ct感染一直是全球性的医疗难题,我们构建的重组噬菌体对Ct有明显的抑制作用,为临床治疗Ct慢性感染、持续感染及应对治疗抵抗提供了新的思路,但是重组噬菌体的作用机制还未明确,需要进一步研究。
