成人脊柱朗格汉斯细胞组织细胞增生症的18F-FDG PET/CT 表现
2019-01-21张彦彦张卫方
张彦彦,张卫方
(北京大学第三医院核医学科,北京 100191)
朗格汉斯细胞组织细胞增生症(Langenhans cell histiocytosis, LCH)是一组活化的树突状细胞及巨噬细胞克隆增殖紊乱性疾病[1],其病因及发病机制尚未明确。LCH可累及任何组织器官,最常见发病部位为骨骼、垂体柄及皮肤[2],在脊柱的发生率为6.5%~25.0%[3]。该病可发生于任何年龄人群,最常见于1~4岁儿童;成人LCH少见,发病率约1/1 000 000~2/1 000 000[4],其中发病部位为脊柱者临床更为少见。目前鲜见有关成人脊柱LCH18F-FDG PET/CT表现的国内外研究。本研究回顾性分析9例成人脊柱LCH的18F-FDG PET/CT表现。
1 资料与方法
1.1 一般资料 回顾性分析2015年10月—2018年1月于我院接受18F-FDG PET/CT检查、经组织病理学确诊的脊柱LCH患者9例,男8例,女1例,年龄20~54岁,平均(34.4±11.0)岁;临床表现主要为患处疼痛,部分伴四肢麻木及放射痛。确诊所取的病理组织来源:CT引导下穿刺活检7例,手术切除椎体肿物1例,刮取病变部位局部皮疹组织1例。
1.2 仪器与方法 采用Siemens Biograph 64 PET/CT扫描仪,其中PET扫描仪为52环LSO晶体,CT为64排螺旋CT。18F-FDG由原子高科股份有限公司提供,放射化学纯度>95%。检查前嘱患者禁食6 h以上,使空腹血糖保持4.4~9.3 mmol/L;扫描前 30 min常规口服2%泛影葡胺溶液800~1 000 ml以充盈胃肠道。静脉注射18F-FDG 3.70~4.44 MBq (0.10~0.12 mCi)/kg体质量,60 min后行PET/CT扫描。先行CT扫描,管电压140 kV,管电流100 mAs,螺距0.9,层厚3 mm,间距3.0,扫描范围自颅顶至股骨上段;再以3D采集模式行PET数据采集,采集范围同CT,头部扫描为8分钟/床位,体部扫描为3分钟/床位,共采集6~7个床位。将CT及PET图像传至MedEx影像信息系统进行处理与分析,使二者匹配、融合,并进行迭代重建,最终获得轴位、冠状位及矢状位CT、PET及PET/CT融合图像。
1.3 图像分析 由2名高年资核医学科医师独立阅片,意见不同时由科室讨论决定。观察病灶数目、位置、形态、边缘、密度及周围软组织情况。在病变部位FDG摄取最高的层面沿病灶边缘勾画ROI,由Siemens Syngo MMWP后处理工作站自动获得病灶的最大标准摄取值(maximum standardized uptake value, SUVmax)。
2 结果
9例成人脊柱LCH中,6例为单发病灶,3例为多发病灶(病灶呈跳跃分布);共18个病灶位于脊柱,其中位于颈椎4个、胸椎8个、腰椎4个、骶椎2个。CT:18个病灶中,16个表现为不同程度的溶骨性骨质破坏及软组织密度肿块,边缘清楚,其中7个病灶边缘可见硬化,3个累及椎间孔、横突孔或椎管,9个累及附件;1个病灶表现为片状稍高密度影;1个病灶密度未见明显异常。PET:18个病灶18F-FDG摄取均可见不同程度增高,病灶SUVmax为9.07±4.99。除骨骼受累外,2例(5号、6号)见肺内多发结节伴空洞形成,未见明显异常FDG摄取;1例(9号)垂体代谢略高于正常脑实质。见表1。
1例患者(2号)为L5椎体及颅骨LCH术后3年复查18F-FDG PET/CT,发现L5椎体及颅骨未见异常。1例患者(5号)首次18F-FDG PET/CT检查后接受激素治疗16个月,本次复查18F-FDG PET/CT发现右侧股骨上段及T10椎体FDG摄取增高灶消失,骨质破坏面积缩小、密度增高(图1);左侧坐骨病灶FDG摄取减低、病灶缩小。
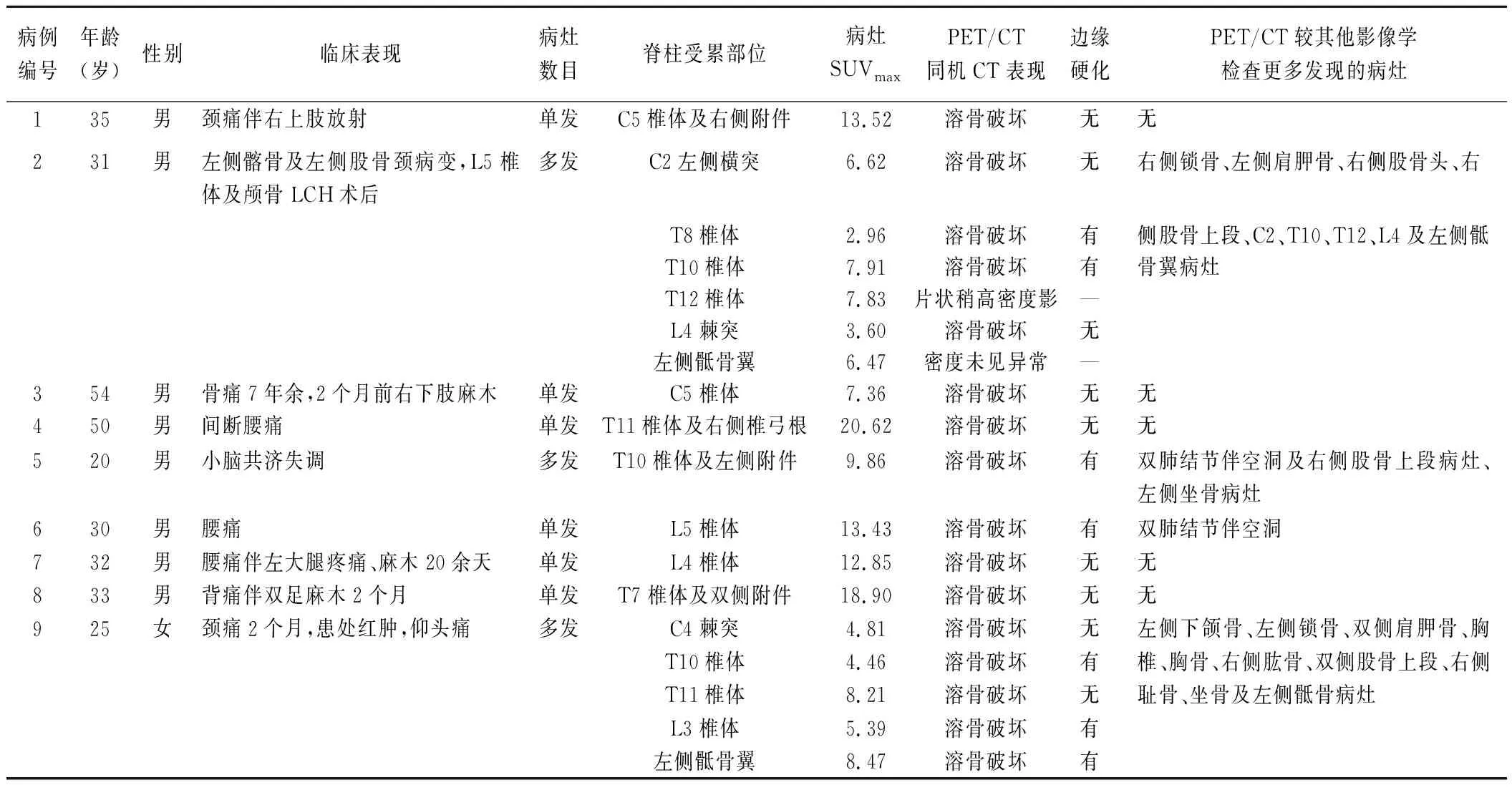
表1 9例(18个病灶)成人脊柱LCH患者一般资料及18F-FDG PET/CT表现
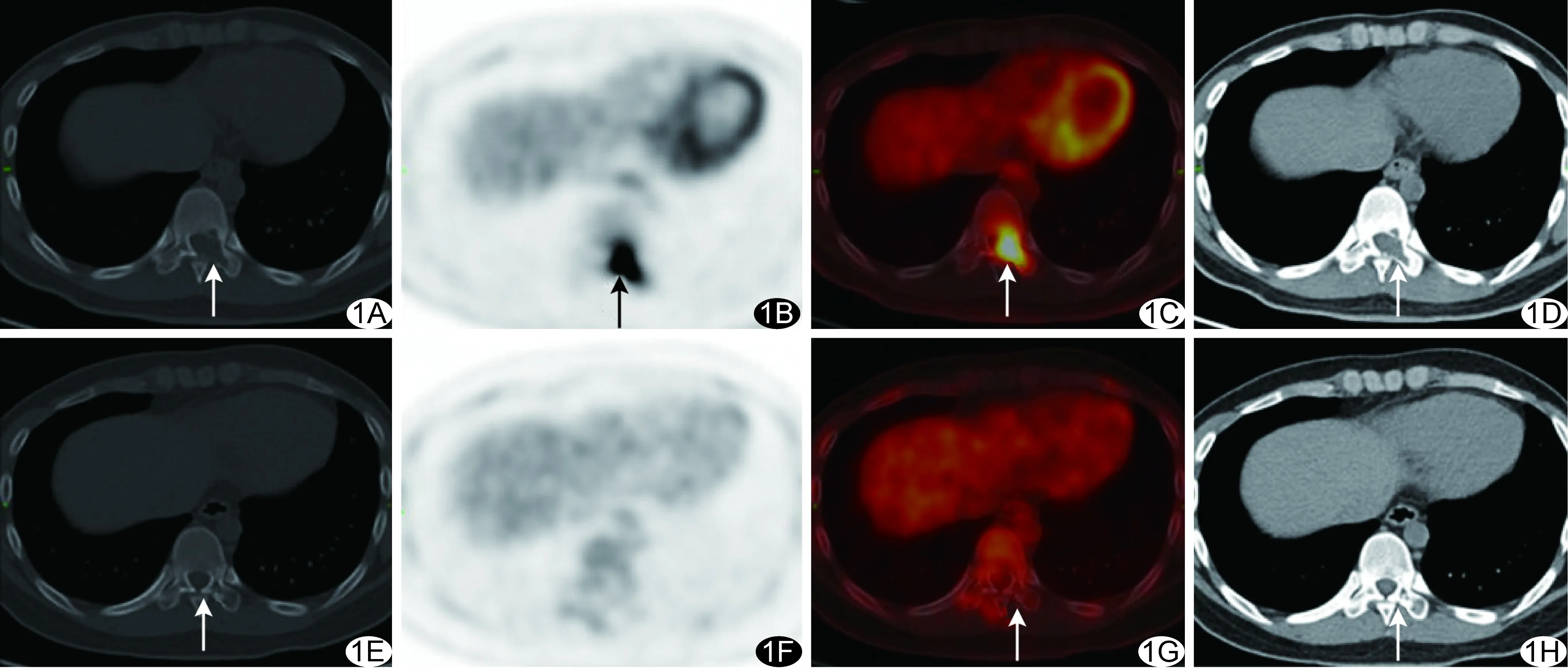
图1 5号患者,男,20岁,T10椎体LCH A~D.首诊时CT示T10椎体后缘及左侧附件溶骨性骨质破坏,无明显硬化边(A);PET示病灶18F-FDG高代谢(B);PET/CT融合图像(C);软组织窗示病变被软组织填充(D); E~H.激素(醋酸泼尼松)治疗16个月复查,CT示T10椎体后缘及左侧附件溶骨性骨质破坏范围明显缩小,边缘明显硬化(E);PET未见明显异常代谢(F);PET/CT融合图像(G);软组织窗示软组织密度影明显缩小,被骨质密度替代(H) (箭示病灶)
3 讨论
成人脊柱LCH是病因不明的罕见疾病,可分为单系统(仅累及一个器官或系统,尤其是骨及肺)及多系统(累及器官或系统≥2个)两类。根据是否累及风险组织器官(如血液系统、脾脏、肝脏及中枢神经系统等),多系统LCH又分为低风险型及高风险型[2]。不同类型LCH患者的治疗方案及预后不同,单系统LCH呈自限性,可自愈;多病灶及多系统LCH需化疗[5],且复发率较高[6];单系统及低风险LCH患者预后较好,多系统及高风险者预后较差。因此,对成人脊柱LCH进行早期诊断及分型,对优化治疗方案、改善患者预后意义重大。
PET/CT是代谢与解剖影像相结合的多模态成像检查方法,病灶代谢变化通常与疾病状态变化的趋势一致,可反映疾病的活动性[2,7-8];在显示病灶代谢情况的同时,还可提供解剖信息。本研究中9例成人脊柱LCH患者PET/CT均表现为不同程度的18F-FDG摄取增高;1例L5椎体及颅骨LCH术后3年复查18F-FDG PET/CT,结果示L5椎体及颅骨未见异常FDG摄取。LCH骨病变主要CT表现为不同程度的溶骨性骨质破坏,以地图样和虫蚀样多见,疾病活动期可见骨质破坏,边界不清,易突破骨皮质,多见椎旁软组织肿块,部分伴有椎旁软组织肿胀;修复期骨破坏边界清楚,周围可见硬化,椎旁软组织肿块减小或消失,椎体高度增加[9]。本组18个病灶中,16个病灶的CT表现为溶骨破坏,与既往研究[9]报道相符;1个病灶CT表现为片状稍高密度影,另1个病灶密度未见明显异常,二者18F-FDG PET/CT均表现为FDG摄取增高,经穿刺组织病理及免疫组化检查诊断为LCH,提示PET/CT有利于发现CT阴性或表现不典型的LCH病灶。
PET/CT全身显像可显示全身各部位的葡萄糖代谢情况,明确病灶部位,有助于病变分类。本研究中PET/CT于编号2、5、6、9号患者均较其他影像学检查发现了更多病灶,其中对5号患者因另外发现了右侧股骨上段、左侧坐骨病灶而将治疗方案由随访观察改为激素治疗。LCH的溶骨性病变一般需要治疗数个月才能愈合,常规影像学检查方法如X线、CT等很难早期评估治疗效果。作为一种功能成像技术,PET/CT可用于监测LCH的早期治疗效果[1,2,7,10]。经过治疗后,LCH病灶的FDG摄取一般会明显下降甚至消失[2,11]。本组1例(5号)激素治疗16个月后复查18F-FDG PET/CT,结果显示右侧股骨及T10代谢活跃灶消失,左侧坐骨病灶缩小、代谢减低,提示18F-FDG PET/CT可用于观察成人脊柱LCH的治疗效果。
尽管18F-FDG PET/CT显像辅助诊断脊柱LCH具有以上优点,但其仍属非特异性显像,多种疾病的征象常存在重叠。采用18F-FDG PET/CT辅助诊断脊柱LCH时,需要与其他疾病相鉴别,如有虫蚀样骨质破坏及椎旁软组织肿胀时,需与脊柱结核、骨髓瘤及溶骨性转移瘤相鉴别。Mueller等[1]对53个脊柱LCH病灶进行评估,发现PET/CT诊断脊柱LCH的敏感度低于MRI(67% vs 81%),而特异度高于MRI(76% vs 47%)。Phillips等[7]认为PET/CT可较CT、MRI发现更多的LCH病变,但在诊断脊柱LCH方面不及其他影像学方法敏感,原因可能在于PET/CT不能识别面积小于1 cm2的病灶,且椎体完全塌陷时,病变组织代谢可能不再活跃,病灶对FDG的异常摄取消失。
综上所述,18F-FDG PET/CT可辅助诊断成人脊柱LCH,并对疾病分型、判断活动度、监测早期治疗效果等具有一定应用价值。但PET/CT检查费用昂贵,且有辐射性,临床不作为脊柱LCH的常规一线检查项目。此外,本研究样本量小,结果尚需大样本研究证实。
