CT评估主动脉缩窄患儿主动脉弓发育情况
2019-01-21吕莹,陈欣,田露,张黎,张挺,何玲*
吕 莹,陈 欣,田 露,张 黎,张 挺,何 玲*
(1.重庆医科大学附属儿童医院放射科,重庆 400014;2.儿童发育疾病研究教育部重点实验室 重庆市儿童发育重大疾病诊治与预防国际科技合作基地儿科学重庆市重点实验室,重庆 400014)
主动脉缩窄(coarctation of aorta, CoA)属于梗阻类主动脉弓疾病,发病率为0.03%[1],占所有先天性心脏病的5%~7%[2];早期狭窄不严重时较难发现,常至出现心前区杂音及高血压等临床表现时才被重视。CoA伴主动脉弓发育不良时,病情更复杂,病死率较高[3],故评估CoA时主动脉弓发育情况对临床具有重要意义。本研究通过CT评估CoA患儿主动脉弓的发育情况,以期提高对本病的认识。
1 资料与方法
1.1 一般资料 收集2014年10月—2017年4月于我院经病理确诊的CoA患儿47例(CoA组),男26例,女21例,年龄4天~10岁,中位年龄2个月。纳入标准:合并动脉导管未闭、房间隔缺损、室间隔缺损或永存左上腔静脉;排除主动脉弓分支发育变异及主动脉弓其他相关性疾病,如双主动脉弓、血管炎症及动脉瘤等。选取同期47例因呼吸系统疾病接受胸部CT检查的患儿作为对照组,男23例,女24例,年龄1个月~14岁,中位年龄10个月,排除心血管疾病及主动脉弓分支发育变异。
1.2 仪器与方法 采用GE LightSpeed 64排VCT或Philips Brilliance iCT机,对无法配合的患儿,检查前予以10%水合氯醛(0.5 ml/kg体质量)口服或苯巴比妥钠针(5 mg/kg体质量)肌肉注射镇静,扫描范围从下颈部至膈肌水平。扫描参数:管电压80~100 kV,管电流35~85 mAs,螺距0.2 mm,层厚 5.0 mm、层间距5.0 mm,图像重建层厚0.625 mm。增强扫描采用高压注射器经手、足背静脉注入碘海醇(300 mgI/ml)、碘克沙醇(270 mgI/ml)2 ml/kg体质量,流率0.6~3.0 ml/s。
1.3 图像分析 采用MPR、MIP等图像后处理技术,使升主动脉、主动脉弓、降主动脉及胸主动脉穿横膈处在斜矢状位上位于最大层面。测量肺动脉主干层面升主动脉最大内径(ascending aorta, AOA)、横弓前部最大内径(D1)、横弓后部最大内径(D2)、峡部最大内径(D3)及穿横膈处降主动脉最大内径(descending aorta, DA),见图1。由2名从事心血管疾病研究的高年资医师采用盲法阅片并测量,意见不一时经讨论达成一致;测量2次,取平均值。计算D1/AOA、D2/AOA、D3/AOA及DA/AOA的比值。根据先天性心脏病数据库分类标准[4]:D1/AOA≤0.6、D2/AOA≤0.5或D3/AOA≤0.4,三者满足其一时,即认为合并主动脉弓发育不良。
1.4 随访 对于术后接受随访的主动脉弓发育不良患儿,以上述方法再次测量AOA、D1、D2及D3,计算D1/AOA、D2/AOA或D3/AOA比值,若上述比值大于先天性心脏病数据库分类标准[4],则认为主动脉弓术后再发育。
1.5 统计学分析 采用SPSS 22.0统计分析软件,对数据进行正态分析(Kolmogorov-Smirnov检验)和方差齐性(Levene检验)检验,计量资料以±s表示;采用独立样本t检验比较2组D1/AOA、D2/AOA、D3/AOA及DA/AOA的差异。以线性相关分析法观察2组D1/AOA、D2/AOA、D3/AOA及DA/AOA与年龄的相关性,其中∣r∣≤0.3时,相关性较差;0.3<∣r∣≤0.6时,中度相关;0.6<∣r∣<0.8时,相关性较高;∣r∣≥0.8时,高度相关。P<0.01为差异有统计学意义。
2 结果
CoA组D1/AOA、D2/AOA、D3/AOA均低于对照组(P均<0.001),但2组DA/AOA差异无统计学意义(P=0.326),见表1。CoA组中,26例合并主动脉弓发育不良,其中11例D1/AOA≤0.6,15例D2/AOA≤0.5,13例D3/AOA≤0.4。
表1 2组主动脉内径参数比较(±s)

表1 2组主动脉内径参数比较(±s)
组别D1/AOAD2/AOAD3/AOADA/AOACoA组0.70±0.110.56±0.110.47±0.100.73±0.14对照组0.87±0.080.79±0.080.75±0.090.71±0.08t值-8.196-10.329-13.2690.993P值<0.001<0.001<0.0010.326
CoA组D1/AOA(r=0.159)、D2/AOA(r=0.239)、D3/AOA(r=0.168)、DA/AOA(r=0.348)与年龄均无显著相关性(P均>0.01)。对照组D1/AOA(r=0.165)、D2/AOA(r=0.229)、D3/AOA(r=0.373)、DA/AOA(r=0.118)亦与年龄均无显著相关性(P均>0.01)。
术后9例患儿接受随访,其中5例术前合并主动脉弓发育不良(1例D1/AOA≤0.6、5例D2/AOA≤0.5、1例D3/AOA≤0.4),随访时间20天~15个月,中位时间7个月。5例主动弓发育不良患儿术后D1/AOA、D2/AOA或D3/AOA均大于先天性心脏病数据库分类标准,见表2、图2。
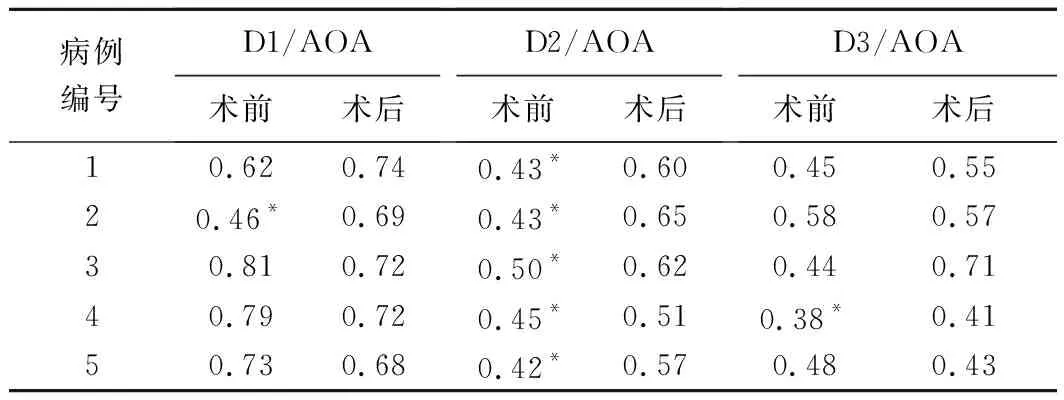
表2 5例主动脉弓发育不良患儿手术前后主动脉弓内径参数结果
注:*:小于先天性心脏病数据库分类标准
3 讨论
CoA指主动脉先天性管腔狭窄,常见于近动脉导管处。多项研究[5-7]显示CoA患儿常合并主动脉弓发育不良。本研究中,CoA组D1/AOA、D2/AOA、D3/AOA均低于对照组,与既往研究[7]相符,表明CoA组主动脉弓(横弓前部、横弓后部及峡部)发育较对照组差。分析原因:①胚胎发育异常;②CoA引起血流阻力增大,随着梗阻程度加重,血管壁弹性降低。正常情况下,从缩窄远端进入降主动脉的血流量减少,可致降主动脉发育亦较差。本研究中2组DA/AOA差异无统计学意义(P=0.326),提示降主动脉穿横膈层面发育未受影响,可能是动脉导管开放或侧支血管建立使流经降主动脉的血流量增加得以代偿所致。虽然主动脉随年龄增长而逐步发育,其管径亦相应增大,但本研究中,2组D1/AOA、D2/AOA、D3/AOA、DA/AOA均与年龄无显著相关,原因可能与样本量较少有关。目前对于主动脉弓发育不良的诊断标准尚存争议[7-8],国内研究[9-11]多采用先天性心脏病数据库分类标准。本研究以此标准诊断主动脉弓发育不良,CoA组26例合并主动脉弓发育不良,以横弓后部发育不良最多见(15例D2/AOA≤0.5)。与单纯CoA相比,合并主动脉弓发育不良的CoA不仅在形态学上表现为主动脉弓管径变小,血流动力学亦存在差异;且与横弓后部、峡部发育不良相比,横弓前部发育不良引起心脏做功量增加更明显[12],原因可能在于发育不良的主动脉弓管径变小,致左心室后负荷增大,而左心室血流在心脏收缩期不能全部通过狭窄的主动脉弓进入降主动脉,导致左心室容量负荷进一步增大。
儿童处于生长发育阶段,主动脉弓发育呈动态变化,且主动脉弓发育不良可能是CoA术后再狭窄及远期高血压等的危险因素,故应定期随访CoA患儿术后主动弓发育情况[13]。本组术后9例患儿接受随访,其中5例术前合并主动脉弓发育不良,术后D1/AOA、D2/AOA或D3/AOA均大于先天性心脏病数据库分类标准[4],原因可能是缩窄解除后,血流动力学的变化促使主动脉弓进一步发育,但能否发育至正常水平尚有待进一步观察。但也有学者[14]认为术前发育不良的主动脉弓术后发育受阻可能与存在弹力蛋白及胶原蛋白异常导致血管壁顺应性降低有关。本研究术后接受随访的5例合并主动脉弓发育不良患儿未出现上述情况,可能与患儿发病年龄小、病程较短、血管弹力膜结构变形不严重或修复能力较强有关。

图1 斜矢状位MIP图像数据测量示意图 A.CoA组; B.对照组 (AOA:升主动脉最大内径;D1:横弓前部最大内径;D2:横弓后部最大内径;D3:峡部最大内径;DA:降主动脉穿横膈处最大内径) 图2 患儿女,1岁,主动脉弓容积再现图 A.术前横弓后部及峡部发育不良; B.术后15个月随访,横弓后部及峡部较术前再发育
综上所述,CoA患儿常合并主动脉弓发育不良,以横弓后部发育不良多见。外科手术解除缩窄后,CoA患儿的主动脉弓可再发育,但能否发育至正常水平尚需进一步观察。观察主动脉弓发育情况对评估CoA具有重要意义,临床应重视定期随访。
