一种印制电路板含镍废水处理工艺及应用
2019-01-17刘庆辉
陈 刚 刘庆辉 莫 凡
(深南电路有限公司,广东 深圳 518117)
0 前言
镀镍作为一种常用的表面处理技术,被广泛应用于电子、汽车、机械等多种行业。印制电路板制程中的镀金工艺,会使用化学镀镍或电镀镍工艺,为了保证镀液的稳定性、使用寿命和镀层质量,化学镀镍溶液中除需加入大量的可溶性镍盐和次亚磷酸盐外,还需加入大量的络合剂、加速剂、稳定剂、光亮剂和pH 值缓冲剂等[1]。在化学镀镍溶液中,应用的络合剂大多为有机酸,如柠檬酸等[2]。镍属于一类污染物,法规要求镀镍工艺中产生的含镍废水需单独收集、处理、达标。由于化学镀镍溶液中的络合剂中含有多种配位体,这些配位体与镍离子结合,形成稳定的络合物,采用常规的重金属氢氧化物沉淀工艺,难以实现含镍废水处理稳定达标。含硫沉淀剂能提高镍的去除率,但加入量必须合适,实际操作中,因各批次废水的组成有差异,因此,Na2S往往需要过量加入,从而会产生大量的H2S气体,污染大气,增加污水中COD(化学需氧量)的浓度。为了避免这些不良后果,Na2S沉淀剂通常不宜作为主沉淀剂,只能在氢氧化物沉淀后作补充沉淀剂使用。
如果在沉淀镍之前,先进行高效率的氧化反应,在大幅度降低COD的同时破坏络合物的结构,使绝大多数的镍从络合物中游离成镍离子,再使用氢氧化物沉淀法将游离镍离子沉淀出来,这应当是解决问题的最好方法即是本文处理工艺的基本思路[3]。本文通过工艺组合,提供一种含镍废水处理工艺:在使用化学方法将镍转化成沉淀之前,采用氧化的方法将含镍废水中有机类络合物氧化分解,一方面能大幅降低废水的COD,另一方面能破坏有机类络合物的结构,解除其与镍的络合状态,使络合态镍转化成游离态镍。使用氢氧化物沉淀方法将大部分镍去除,废水中剩余的镍再采用离子交换树脂吸附废水中剩余的镍。此工艺可实现出水总镍含量达到《电镀污染物排放标准》中的要求。
1 工艺流程
通过研究各种水处理工艺,结合印制电路板含镍废水水质情况,确定一种稳定可行的处理工艺(如图1)。

图1 含镍废水处理工艺流程图
2 工艺原理
2.1 芬顿氧化破络和降解COD
芬顿氧化是指在酸性条件下,向水体中投加FeSO4和H2O2,利用Fe3+(Fe2+)催化H2O2高效率分解生成具有强氧化能力和高电负性或亲电子性的羟基自由基(·OH,电极电势2.80 EV,仅次于F2),羟基自由基(·OH)可以氧化降解水体中的有机污染物,使其最终矿化为CO2、H2O 及无机盐类等小分子物质。
芬顿氧化反应是以亚铁离子为催化剂的一系列自由基反应,反应机理如下:

通过以上反应,不断产生羟基自由基(·OH),使得整个体系具有强氧化性,可以氧化难以被一般氧化剂(氯气、次氯酸钠、臭氧)氧化的物质。
芬顿氧化具有高效、选择性小的特点,在含镍废水处理中首先采用芬顿氧化的工艺,主要有三个目的:
(1)利用芬顿氧化的强氧化性破络。芬顿反应过程中产生的强氧化性羟基自由基(·OH),能将含镍废水中的有机酸络合剂,氧化成甲醇、乙醇、乙酸等小分子有机物和CO2、 H2O,降低废水COD的同时,起到破络的作用:

(注:R为有机物的分子)
此类小分子有机物不能与镍形成络合物,使得原废水中络合态的Ni2+转换成游离态Ni2+,继而通过后续的化学沉淀方法将游离态Ni2+除去:
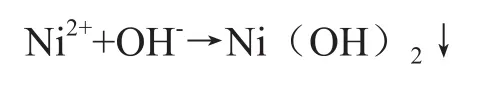
(2)提高废水的可生化性。由于含镍废水中含有部分有机酸等添加剂,COD一般在80~200 mg/L之间,达不到直接排放的要求(《电镀污染物排放标准》表3要求为COD<50 mg/L),通常是将含镍废水的总镍处理达标后,混入有机废水或综合废水进一步处理,通过生化处理降解COD使其达标。通过芬顿氧化处理后,部分大分子有机物被氧化成小分子有机物,可提高废水BOD5(生化需氧量)/COD值,提高可生化性,便于后续生化处理。
(3)氧化次亚磷酸盐为正磷酸盐。芬顿氧化反应过程中,能将废水中的次亚磷酸盐氧化成正磷酸盐

在后续化学沉淀工艺中,通过投加钙盐、铁盐、铝盐等,使正磷酸根(PO43-)与Ca2+、Fe3+、Al3+等形成磷酸盐沉淀,达到降低总磷的目的:
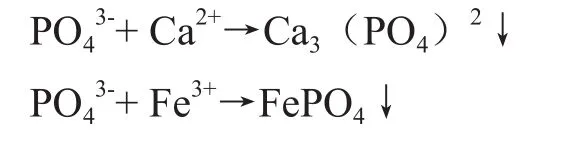

可以看出,芬顿氧化效果的好坏是影响整个工艺的关键因素之一。芬顿氧化的影响因素较多,包括溶液pH、反应温度、H2O2投加量及投加方式、催化剂种类、催化剂与H2O2投加量之比等,不同的水质反应参数也有所不同,需要通过DOE实验确定最佳投药量、pH等反应条件,从而达到最佳反应效果。
2.2 电催化氧化深度破络和降解COD
电催化氧化是利用具有催化性能的金属氧化物电极,在电场作用下,产生具有强氧化能力的羟基自由基或其它自由基和基团攻击溶液中的有机污染物,使其完全分解为无害的H2O和CO2的绿色化学技术[4]。
电催化氧化原理是利用电极分解H2O和H2O2,产生具有强氧化能力的羟基自由基(·OH基团),从而使许多难以降解的有机污染物分解为CO2、H2O和其他简单有机物[5],其反应机理如图2。

图2 电催化氧化反应机理图
首先溶液中的H2O或H2O2在阳极上放电并形成吸附的氢氧自由基(下列式中MOx为氧化电极):

当溶液中存在可氧化的有机物R时,则发生如下反应:

在电解过程中,采用铁质的可溶性阳极,通以直流电后阳极材料会在电解过程当中发生溶解,形成金属阳离子Fe3+、Al3+等,溶液中形成具有絮凝作用的胶体物质,这些物质可促使水中的胶态杂质絮凝沉淀,从而促进污染物的去除。含镍废水处理工艺中,在芬顿氧化后增加了电催化氧化工艺,其目的与芬顿氧化类似,起到破络、提高可生化性和氧化磷酸盐的目的。而电催化氧化能提高芬顿反应效率,减少芬顿氧化反应的加药量,且可进行深度氧化难降解有机物。
2.3 氢氧化物沉淀工艺去除大部分镍离子
重金属氢氧化物沉淀法,是指将重金属废水的pH调节至碱性,使重金属生成难溶性盐沉淀下来,达到去除重金属目的的方法。
水中的难溶盐服从溶度积原则,即在一定温度下,在含有难溶盐MmNn(固体)的饱和溶液中,各种离子浓度的乘积为一常数,称为溶度积常数,记为LMmNn

式中 Mn+代表水中金属阳离子,Nm-代表水中阴离子,[ ]表示摩尔浓度(mol/L)。
上式对各种难溶盐都成立。而当[Mn+]m·[Nm-]n>LMmNn 时,溶液超过饱和那部分将析出沉淀,直到符合上式时为止。如果[Mn+]m·[Nm-]n<LMmNn,溶液不饱和,难溶盐将溶解,直到符合上式时为止。
根据这种原理,可用它来去除废水中的金属离子Mn+,为了去除废水中的Mn+离子,向其中投加OH-离子,使其发生反应:

当溶液加入适量的OH-,使溶液中[Mn+]·[OH-]n>L M(OH)n时,金属离子形成M(OH)n沉淀,从而降低废水中的Mn+离子的浓度,产生的氢氧化物沉淀与悬浮物一起参加混凝反应,形成絮凝体后,在沉淀池内沉淀去除。氢氧化物的沉淀与pH有很大关系(如图3)。
含镍废水经过芬顿氧化和电催化氧化工艺处理后,水中镍以游离态Ni2+存在,采用重金属氢氧化物沉淀的工艺,将废水pH调节至10~12,可使水中绝大部分Ni2+以Ni(OH)2沉淀的形式析出,然后再经固液分离装置去除沉淀物,从而达到去除镍的目的。

图3 重金属离子溶解度与 pH 值的关系图
2.4 离子交换法去除残余镍离子
离子交换法,是借助于固体离子交换剂中的离子与稀溶液中的离子进行交换,以达到提取或去除溶液中某些离子的目的的方法,离子交换是可逆的等当量交换反应。通常的固体离子交换剂为离子交换树脂,是具有三维空间结构的不溶高分子化合物,其功能基可与水中的离子起交换反应。
含镍废水中的Ni2+离子为正二价的金属阳离子,可采用阳离子交换树脂来吸附。当含镍废水流经阳树脂层时,发生如下交换反应:
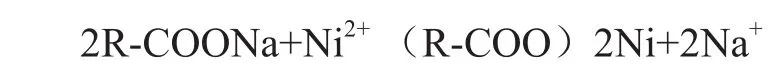
水中的Ni2+被吸附在树脂上,而树脂上的Na+便进入水中,水中Ni2+得以去除。
当全部树脂层与Ni2+交换达到平衡时,用一定浓度的HCI或H2S04再生,反应式如下:

此时树脂为H型,需用NaOH转为Na型,反应为:
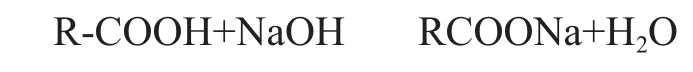
如此树脂可重新投入运行,进入下一循环[6]。该工艺中最后一步采用除镍专用离子交换树脂吸附残余的镍,是为了确保出水总镍指标能稳定达到标准小于0.1 mg/L的要求。使用离子交换工艺处理含镍废水,适用于处理浓度低而废水量大的含镍废水,进水镍离子浓度建议不超过10 mg/L。若再高,则再生周期短,再生时间和再生消耗药剂增加。
3 工程应用结果
某印制电路板车间产生的含镍废水,采用该工艺处理,检测流程中各段水中总镍浓度变化,每4 h检测一次,每天检测6次,一周水质检测结果平均值如图4。(注:总镍检测采用原子吸收分光光度法)

图4 总镍浓度变化趋势图
4 总结
通过对实际工程运行情况进行分析,结果表明:(1)对于总镍浓度小于60 mg/L的印制电路板含镍废水,采用该工艺可实现总镍指标稳定达标。(2)芬顿氧化和电催化氧化的应用,提高了废水B/C值,提高了废水可生化性,有利于后续深度生化处理降解COD。(3)印制电路板废水的磷大部分存在于含镍废水中,在除镍的同时除去了大部分的磷,降低了后续工艺中总磷的处理难度,有利于总排水磷含量达标。
