氢气菌群制剂对急性缺氧大鼠的抗氧化效应
2019-01-17陈郁龚亮李海波罗勇军
陈郁,龚亮,李海波,罗勇军
高原地区由于其特殊的地理环境,以及近年来的建设发展和交通设施的逐渐完善,吸引着越来越多的人群从平原进入高原从事相关活动,其中绝大部分为短期旅游者[1]。高原地区空气稀薄、氧分压低,是进入高原的平原人群发生急性高原反应最主要的原因,但是其导致损伤的具体机制仍未完全阐明[2-4]。氧化应激和自由基代谢异常是低氧引起损伤的重要因素,故适度应用抗氧化剂是防治低氧损伤的重要考虑方向[5]。在众多的抗氧化剂中,氢具有极强的还原性,能够选择性地与氧自由基结合而减弱其作用,在抗氧化应激、对抗自由基代谢和抗炎方面发挥着重要作用,对机体重要器官具有显著的保护效应[6]。为评估氢在急性缺氧过程中的抗氧化作用,本研究将大鼠暴露在模拟海拔5000m的高原环境中,构建大鼠急性缺氧模型,探讨不同剂量氢气菌群制剂对急性缺氧大鼠重要器官氧化应激指标和抗氧化指标的影响,为应用氢气菌群及氢气相关制品预防和治疗急性高原病提供依据。
1 材料与方法
1.1 实验动物 10~12周龄健康雄性SD大鼠共40只,体重200~220g,购自陆军军医大学实验动物中心。动物饲养于陆军军医大学高原军事医学系动物房,所有动物均自由摄食、饮水,控制室温在20~24℃。本实验经陆军军医大学动物伦理委员会批准。
1.2 药物及主要试剂、仪器 氢气菌群制剂购自日本D&D TRINITY公司(http://ddtrinitylab.shopselect.net/items/3183023)。丙二醛(malonaldehyde,MDA)、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)检测试剂盒均购自南京建成生物工程研究所。血浆肿瘤坏死因子α(tumour necrosis factor-α,TNF-α)检测采用ELISA试剂盒完成(武汉博士德生物工程有限公司)。Multiskan GO全自动多功能酶标仪购自美国Thermo公司。动物模型制备采用高原环境模拟舱(DYC-2842T型低压氧舱),由贵航集团风雷机械厂建造。
1.3 动物模型制备 将40只SD大鼠随机分为平原生理盐水(normoxic saline,NS)组、高原生理盐水(high-altitude saline,HS)组、高原低剂量(highaltitude low-dose,HL)组、高原中剂量(high-altitude medium-dose,HM)组、高原高剂量(high-altitude high-dose,HH)组,每组8只。低剂量组、中剂量组和高剂量组的给药剂量分别为10、20、40mg/(kg·d),于每天上午固定时间灌胃给药,1次/d。高原组的动物在海拔4000m灌胃给药、换水、食物及新鲜干净垫料,在30min内完成,给药完毕后动物上升至海拔5000m,连续3d,其中HS组每只大鼠灌胃2ml生理盐水。NS组每只大鼠亦灌胃2ml生理盐水,不进入低压氧舱。
1.4 实验动物处理 第3次给药后1d,在模拟海拔4000m处,将所有高原组动物处死取材。采用14%乌拉坦腹腔注射麻醉大鼠,剂量以1ml/100g计。取材时剪开胸腔,用注射器心脏采血,注意防止大出血导致采血失败。取血完毕后将血液转移至EDTA钠抗凝管中,3000r/min离心10min,留取血浆,分装冻存,–80℃备用。分别获取肝、肺及心脏组织,转移至冻存管中,于液氮中冻存,再转移至–80℃备用。NS组取材在高原组取材后完成,样品处理同高原组。
1.5 实验指标检测 血浆在室温解冻,采用ELISA法检测血浆中的TNF-α含量,单位为pg/ml。采用比色法测定肝、肺、心肌组织中的MDA、CAT、SOD和GSH含量。将肝、肺、心肌组织4℃解冻后,每个标本剪取0.1g的组织,放入2ml的EP管中,再加入0.9ml的生理盐水。采用预冷的眼科剪剪碎组织,匀浆机匀浆结束后置于冰上。待全部样品匀浆完成后,以2500r/min的速度于4℃条件下离心10min,制备10%组织匀浆液置于4℃备用。采用BCA法测定组织匀浆液蛋白含量。在预实验中,对每个器官的每个检测指标均测定了最佳检测浓度,故在获取10%的组织匀浆液后,采用生理盐水稀释至最佳浓度,分装置于4℃备用。
1.6 统计学处理 采用软件SPSS 20.0进行统计分析。所有数据均以表示,多组间比较采用单因素方差分析,进一步两两比较时方差齐采用SNK-q检验,方差不齐采用Tamhane'T2分析。均为双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 给药后大鼠血浆TNF-α含量变化 在模拟海拔5000m的低氧环境暴露3d后,与NS组[(36.24±3.92)pg/ml]相比,高原各组的TNF-α含量[HS组为(39.89±5.38)pg/ml,HL组为(32.59±1.97)pg/ml,HM组为(39.89±5.38)pg/ml,HH组为(35.43±2.09)pg/ml]无明显差异;与HS组相比,HL组的TNF-α含量明显下降(P<0.01)。
2.2 肝、肺、心肌组织各氧化应激指标的最佳测量浓度 由于不同组织的MDA、CAT、SOD及GSH含量不同,为保证最佳检测效果,在正式检测之前,先摸索了不同组织不同指标的最佳检测浓度,结果见表1。在正式检测前,将匀浆组织上清用生理盐水稀释至目标浓度,存于4℃备用。
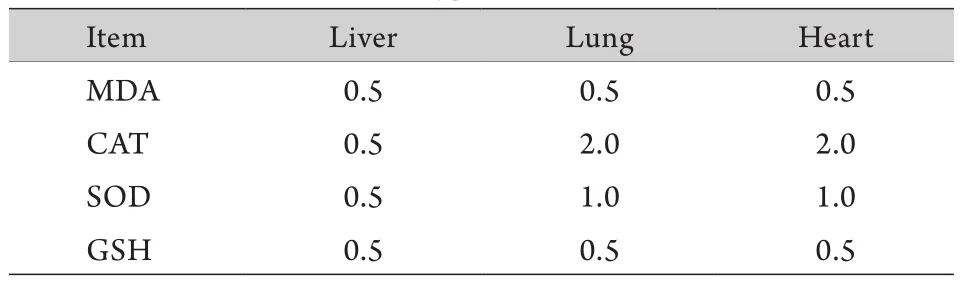
表1 急性缺氧大鼠各组织氧化应激指标的最佳检测浓度(%)Tab.1 Optimal concentrations of MDA, SOD, CAT and GSH of different tissues in acute hypoxia rats (%)
2.3 给药后大鼠肝组织MDA、CAT、SOD和GSH含量变化 与NS组相比,HS组及高原各药物组大鼠肝组织MDA含量无明显变化,与HS组相比,高原各药物组大鼠肝组织DMA含量无明显变化,提示氢气菌群制剂在降低肝组织MDA含量方面无明显效果。与NS组相比,HS组、HL组及HH组大鼠肝组织CAT含量均明显下降(P<0.01),而与HS组相比,高原各药物组大鼠肝组织CAT含量均无明显变化,提示氢气菌群制剂在提高肝组织CAT含量方面无明显效果。NS组、HS组及高原各药物组大鼠肝组织SOD含量比较均无明显差异,提示氢气菌群制剂对改善肝组织SOD无明显效果。与NS组相比,HS组及高原各药物组大鼠肝组织GSH含量明显下降(P<0.01),与HS组相比,HL组和HH组大鼠肝组织GSH含量均明显升高(P<0.05),HL组、HM组和HH组之间无明显差异,提示低、中、高剂量的菌群制剂均可改善肝组织中GSH代谢,而高剂量的菌群制剂效果较好(表2)。
表2 急性缺氧大鼠各组给药后肝组织氧化应激相关指标的变化(±s,n=8)Tab.2 Changes of indicators in liver tissue of acute hypoxia rats in different groups after administration (±s, n=8)
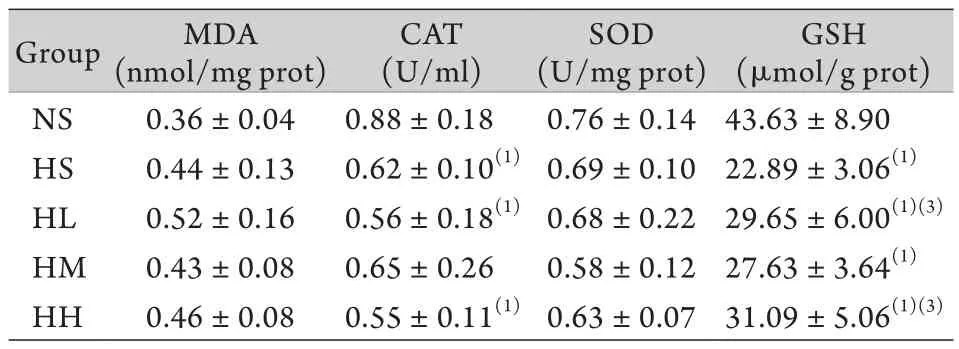
表2 急性缺氧大鼠各组给药后肝组织氧化应激相关指标的变化(±s,n=8)Tab.2 Changes of indicators in liver tissue of acute hypoxia rats in different groups after administration (±s, n=8)
MDA. Malonaldehyde; CAT. Catalase; SOD. Superoxide dismutase; GSH. Glutathione; NS. Normoxic saline group; HS. High altitude saline group, HL. High altitude low-dose group, HM. High altitude medium-dose group; HH. High altitude high-dose group. (1)P<0.01 compared with NS group; (2)P<0.01, (3)P<0.05 compared with HS group
GSH(μmol/g prot)NS 0.36±0.04 0.88±0.18 0.76±0.14 43.63±8.90 HS 0.44±0.13 0.62±0.10(1)0.69±0.10 22.89±3.06(1)HL 0.52±0.16 0.56±0.18(1)0.68±0.22 29.65±6.00(1)(3)HM 0.43±0.08 0.65±0.26 0.58±0.12 27.63±3.64(1)HH 0.46±0.08 0.55±0.11(1)0.63±0.07 31.09±5.06(1)(3)Group MDA(nmol/mg prot)CAT(U/ml)SOD(U/mg prot)
2.4 给药后大鼠肺组织MDA、CAT、SOD和GSH含量变化 与NS组相比,HS组大鼠肺组织MDA含量明显增加(P<0.01),与HS组相比,HL组及HM组大鼠肺组织MDA含量明显下降(P<0.05),HL组则明显低于HH组(P<0.01)而明显高于HM组(P<0.01),HM组明显低于HH组(P<0.01),提示在肺组织中,低剂量和中剂量的菌群制剂均有较好的抑制脂质过氧化的效果。与NS组相比,HS组大鼠肺组织CAT含量无明显变化,与HS组相比,HL、HM和HH组大鼠肺组织CAT含量明显上升(P<0.01),HL、HM和HH组之间CAT含量无明显差异,提示氢气菌群制剂能够改善大鼠肺组织的CAT含量。与NS组相比,HS组与高原各药物组大鼠肺组织SOD含量均无明显变化,与HS组相比,HM组大鼠肺组织SOD含量明显增加(P<0.01),HM组明显高于HL组和HH组(P<0.01),HH组与HL组比较无明显差异,提示氢气菌群制剂能够提高缺氧大鼠肺组织SOD的含量,且中等剂量效果最佳。与NS组相比,HS组大鼠肺组织GSH含量明显下降(P<0.05),而高原各药物组无明显变化,与HS组相比,HM组大鼠肺组织GSH含量明显升高(P<0.01),且HM组明显高于HL组及HH组(P<0.01),提示氢气菌群制剂能够改善肺组织GSH含量,且中等剂量效果最好(表3)。
表3 急性缺氧大鼠各组给药后肺组织氧化应激相关指标的变化(±s,n=8)Tab.3 Changes of indicators in lung tissue of acute hypoxia rats in different groups after administration (±s, n=8)
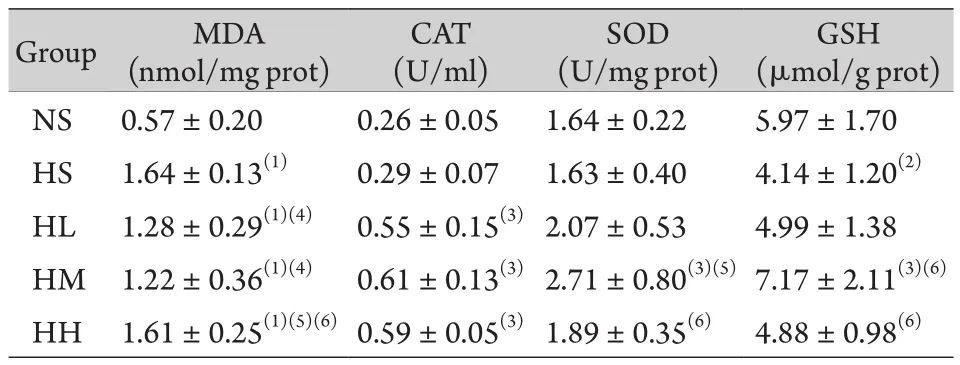
表3 急性缺氧大鼠各组给药后肺组织氧化应激相关指标的变化(±s,n=8)Tab.3 Changes of indicators in lung tissue of acute hypoxia rats in different groups after administration (±s, n=8)
MDA. Malonaldehyde; CAT. Catalase; SOD. Superoxide dismutase; GSH. Glutathione; NS. Plain saline group; HS. Plateau saline group, HL. Plateau low dose hydrogen group, HM. Medium dose hydrogen group; HH. High dose hydrogen group. (1)P<0.01, (2)P<0.05 compared with NS group; (3)P<0.01, (4)P<0.05 compared with HS group; (5)P<0.01 compared with HL group; (6)P<0.01 compared with HM group
GSH(μmol/g prot)NS 0.57±0.20 0.26±0.05 1.64±0.22 5.97±1.70 HS 1.64±0.13(1) 0.29±0.07 1.63±0.40 4.14±1.20(2)HL 1.28±0.29(1)(4) 0.55±0.15(3)2.07±0.53 4.99±1.38 HM 1.22±0.36(1)(4) 0.61±0.13(3)2.71±0.80(3)(5)7.17±2.11(3)(6)HH 1.61±0.25(1)(5)(6)0.59±0.05(3)1.89±0.35(6) 4.88±0.98(6)Group MDA(nmol/mg prot)CAT(U/ml)SOD(U/mg prot)
2.5 给药后大鼠心肌组织MDA、CAT、SOD和GSH含量变化 与NS组相比,HS组与高原各药物组大鼠心肌组织MDA含量均明显增加(P<0.01),与HS组相比,HL组、HM组及HH组大鼠心肌组织MDA含量均明显下降(P<0.05或P<0.01),HL组、HM组及HH组之间比较无明显差异,提示氢气菌群制剂可改善缺氧大鼠心肌组织的MDA含量增加。与NS组相比,HS组及高原各药物组大鼠心肌组织CAT含量无明显变化,与HS组相比,HH组大鼠心肌组织CAT含量明显下降(P<0.05),HL组和HM组均明显高于HH组(P<0.01),HL组与HM组比较无明显差异,提示氢气菌群制剂在改善缺氧大鼠心组织的CAT含量方面无明显效果,且高剂量组还可导致CAT含量进一步下降。与NS组相比,HS组、HL组及HH组大鼠心肌组织SOD含量无明显变化,HM组大鼠心肌组织SOD含量明显增加,与HS组相比,HL组及HM组大鼠心肌组织SOD含量明显增加(P<0.05或P<0.01),而HH组无明显变化,HL、HM及HH组之间比较无明显差异,提示氢气菌群制剂能够改善大鼠心组织SOD含量,且以中等剂量为最佳。与NS组相比,HS组大鼠心肌组织GSH含量明显下降(P<0.01),而高原各药物组无显著改善,与HS组相比,HL组、HM组及HH组大鼠心肌组织GSH含量均明显增加(P<0.05或P<0.01),且HH组明显高于HL组及HM组(P<0.01),HL组与HM组之间比较无明显差异,表明氢气菌群制剂能够提高缺氧大鼠心肌组织的GSH含量,且高剂量组的效果较好,优于低剂量组与中剂量组(表4)。
表4 急性缺氧大鼠各组给药后心肌组织氧化应激相关指标变化(±s,n=8)Tab.4 Changes of indicators in heart tissue of acute hypoxia rats in different groups after administration (±s, n=8)

表4 急性缺氧大鼠各组给药后心肌组织氧化应激相关指标变化(±s,n=8)Tab.4 Changes of indicators in heart tissue of acute hypoxia rats in different groups after administration (±s, n=8)
MDA. Malonaldehyde; CAT. Catalase; SOD. Superoxide dismutase; GSH. Glutathione; NS. Normoxic saline group; HS. High altitude saline group, HL. High altitude low-dose group, HM. High altitude medium-dose group; HH. High altitude high-dose group. (1)P<0.01 compared with NS group; (2)P<0.01, (3)P<0.05 compared with HS group; (4)P<0.05 compared with HL and HM group
GSH(μmol/g prot)NS 0.68±0.23 1.57±0.34 0.95±0.30 4.02±1.40 HS 1.94±0.71(1) 1.64±0.12 0.90±0.10 2.09±0.44(1)HL 1.52±0.28(1)(3) 1.72±0.26 1.14±0.19(3) 2.39±0.42(3)HM 1.33±0.36(1)(3) 1.72±0.21 1.36±0.22(1)(2)2.47±0.52(3)HH 1.25±0.43(1)(3) 1.42±0.13(3)0.97±0.16 3.38±0.91(2)(4)Group MDA(nmol/mg prot)CAT(U/ml)SOD(U/mg prot)
3 讨 论
正常情况下,机体不断生成自由基,同时也存在自由基的清除体系如抗氧化酶等,使自由基的产生与清除处于动态平衡中,以保证机体不受自由基的损伤[7]。在高原低氧环境中,自由基代谢紊乱,自由基生成明显增多,过多的自由基可造成组织损伤[5]。肝脏是机体最重要的代谢器官,肺脏是最主要的气体交换场所,而心脏是对氧代谢特别敏感的器官,因此,本研究验选择了肝脏、肺脏和心脏作为靶器官,观察氢气菌群制剂在大鼠急性缺氧后对机体氧化指标和抗氧化指标的影响。MDA是脂质过氧化的终产物之一,其含量高低可提示机体的自由基代谢状态并能够间接反映自由基对组织的损伤程度[8]。SOD、CAT及GSH是机体重要的抗氧化系统,在机体拮抗氧化应激损伤和清除自由基的过程中发挥着重要作用[9]。本研究选择的是能够在肠道中代谢产生氢气的菌群,进入消化道之后可在肠道定居并增殖以增加体内氢气的产量,促进机体对氢气的吸收以拮抗自由基的生成。本研究发现,在模拟海拔5000m暴露3d,应用氢气菌群制剂后,能够降低缺氧大鼠血浆TNF-α含量,降低缺氧大鼠肺组织和心肌组织的MDA含量,增加缺氧大鼠肝、肺以及心肌组织的GSH含量,增加肺组织CAT含量与肺、心肌组织SOD含量。上述结果表明,氢气菌群制剂能够在一定程度上中和缺氧导致的氧代谢自由基增加,对心肌组织和肺组织都有一定程度的保护作用。此外,本研究还观察到,在单纯缺氧组中各组织的MDA、CAT、SOD和GSH指标反应并不一致,考虑一方面可能与动物实验中个体对药物的反应不同有关,另外也可能与各组织对氢气代谢反应的不一致有关。给予氢气菌群制剂后经代谢产生氢气,但是每只动物的产氢气的量不一致,氢气通过各种中间过程到达各组织的途径不一致,到达的量也不一样,从而使得HS组中MDA以及各抗氧化的指标反应并不一致。
目前针对抗缺氧的药物研究较多,以各种植物提取物以及小分子化合物为主,如槲皮素[10]、黄芪甲苷[9]、苯乙醇苷[11]、天麻素[12]、醋甲唑胺[13]、四甲基哌啶衍生物[14]及单硝酸异山梨酯化合物等[15]。现有研究多为观察自由基及抗缺氧物质等氧化损伤/抗氧化指标在细胞水平[11]或者动物组织中的含量变化[9-10,12-15]以评估抗缺氧物质的效应,本研究选取的MDA、CAT、SOD及GSH等也是动物实验较多采用的指标,而部分细胞实验则采用细胞活力等指标。目前的抗氧化指标虽然多,但仍缺少敏感、特异的抗缺氧指标,这也是筛选抗缺氧药物的重要方向之一。抗缺氧效应是一个整体效应,是在面对低氧环境时整个机体的活动能力,而不是仅仅停留在细胞或者组织层面。因此,针对药物的抗缺氧效应,可考虑以动物的整体表现为评估指标,如在低氧环境中的认知能力和运动能力等行为学特征,并以此为基础在组织、细胞及分子层面深入研究其机制。
氢气是自然界中最小、结构最简单的分子,无色无味,具有极强的还原性。此外,由于其分子量小和电中性特点,能够穿透生物膜到达细胞质、线粒体、细胞核等部位,因此很有可能作为一种小分子生命信号传递物质,在机体内传递信息。人体内的氢气有两个来源:一是皮肤从外界吸收,但是通过此途径获得的氢气量非常少,二是肠道菌群代谢产生的氢气,这也是人体内氢气最主要的来源。研究表明,氢气能够对氧自由基进行有针对性的清除,尤其是中和体内氧化性较强的活性氧(reactive oxygen species,ROS)如羟基等而发挥作用[6]。而且大量研究表明,氢气相关制剂如富氢水等能够抑制炎症因子如TNF-α、IL-1β的生成,并降低自由基的含量,进而减轻缺血再灌注损伤[16]。此外,富氢水还可通过抗炎抗氧化作用,减轻炎症性肠病损伤[17],改善多发性硬化模型小鼠的症状和减轻脱髓鞘病变[18]。除了炎症病变外,富氢水还可通过促进干扰素的表达来减低肿瘤的质量和体积[19],改善因化疗导致的肝功能损伤[20]。上述研究结果提示,氢气及其相关制剂有望在多种疾病的治疗中得到进一步应用,改善机体症状。
本研究使用的是氢气菌群制剂,依赖于肠道菌群代谢产生氢气,这种方式不稳定,易受原有的肠道菌群和饮食的影响。在后期的进一步实验中,可考虑直接应用富氢水腹腔注射处理动物模型,对急性高原病动物模型应有较好的效果。此外,虽然本研究使用的是急性动物模型,但是在高原红细胞增多症和高原肺动脉高压等慢性缺氧模型中,也可针对性使用氢气菌群或者富氢水制剂,以观察其对低氧损伤的拮抗作用。目前,尚无高原现场条件下制备富氢水的报道,在高原条件下富氢水的保存也存在一定难度,因此使用氢气菌群制剂以改善高原地区人群的肠道菌群,增加高原人群肠道氢气的生成,也是未来可以考虑的方式。值得注意的是,由于高原低氧环境会对肠道菌群的组成和含量造成明显的影响[21],因此针对需要长期在高原停留的人群,建议考虑长期应用氢气菌群制剂以获得较好的效果。
综上所述,本研究表明,使用氢气菌群制剂可改善缺氧环境对心脏以及肺脏的损伤,通过拮抗自由基而对上述器官发挥保护作用。此外,氢气菌群制剂的应用方式还可进一步优化调整以发挥其最大效应。而氢气在这其中发挥作用的机制如何,是否还有其他因子也参与了这一过程,我们将在后期实验中进一步关注。
