Duchenne型肌营养不良患儿认知功能特点及与Dp140表达的关系
2019-01-17马沛沛董玉茹吴士文
马沛沛,董玉茹,吴士文
Duchenne型肌营养不良(Duchenne's muscular dystrophy,DMD)是一种以进行性肌肉萎缩为主要临床特征的X连锁隐性遗传的神经肌肉病,是最常见的肌营养不良类型之一[1],新生儿男婴中的发病率为1/3500[2]。Dystrophin基因的突变可引起Dystrophin蛋白表达的缺失,而Dystrophin蛋白对维持肌肉收缩时肌细胞膜的完整性非常重要,因此,其缺失可引起肌肉损伤、慢性炎症反应和肌肉纤维化[3],最终导致进行性的肌纤维坏死、萎缩。除了肌肉无力,DMD的另一个特点是非进展性认知损害。早在1868年Duchenne描述该病时就已经提出DMD患者可出现认知功能的下降。Dystrophin蛋白在很多负责大脑高级执行功能(如学习、记忆)的区域表达,如大脑皮质、海马和小脑[4]。DMD患者大脑中Dystrophin蛋白是缺失的,尸检神经病理学提示神经胶质细胞增生和神经元丢失[5],异位和皮质增厚[6]。一些神经影像学的研究也发现了DMD患者大脑功能的异常,2002年一项用正电子发射断层成像(positron emission tomography,PET)进行的研究发现DMD患者大脑中糖代谢降低,尤其在Dystrophin蛋白富集的区域,如大脑皮质和小脑[7]。此外,既往报道约30%的DMD患者存在智力受损,其总平均智商较正常水平下降约一个标准差[8-9]。DMD患者智力缺陷可呈现从轻微的边缘状态到严重的智力缺陷,IQ<70者占19%~35%,而IQ<50者约3%[8-9]。国外研究表明,认知功能损害在DMD基因远端突变的患者中表现更为突出,可能是由于DMD基因远端缺失影响Dp140的表达,提示基因型与认知功能损害之间的关联性[10]。国内目前关于基因型与认知功能损伤相关性的研究较少,因此,本研究评估了DMD患儿的认知功能水平、特点及与Dp140表达的相关性,以明确DMD患儿智力水平,探讨智力水平与基因突变位置的关系,帮助临床早期发现智力受损患儿,及早给予干预和生活帮助。
1 资料与方法
1.1 研究对象 选取2014年10月-2017年12月在武警总医院DMD多学科联合门诊就诊,经基因检测或肌肉活检确诊为进行性肌营养不良的患儿143例。纳入标准:①经基因确诊为进行性肌营养不良;②年龄6岁以上,能配合完成韦氏儿童智力量表测定;③3~6岁发病,临床表现为进行性四肢近端肌肉无力,腓肠肌假性肥大,Gowers征阳性。排除标准:①存在精神病及其他神经遗传性疾病病史;②因肌无力等原因无法配合韦氏儿童智力量表检查;③资料不完整的患者。最终纳入DMD患儿122例,均为男性,年龄6.0~13.3岁,平均8.1岁。本研究经武警总医院伦理委员会审核批准,所有患儿及其监护人均知情同意并签署知情同意书。
1.2 研究方法
1.2.1 确诊标准 所有患儿均通过基因检测或肌肉活检初步发现基因突变或者Dystrophin蛋白表达缺失,再由专业医生根据患儿症状、体征、家族史等综合诊断确诊为DMD。采用多重连接探针扩增技术(multiplex ligation -dependent probe amplification,MLPA)及二代测序法检测DMD基因79个外显子的大片段缺失、重复及小的点突变等。
1.2.2 认知评估 在安静的条件下,由同一名接受过专业培训的医生对符合条件的患儿进行评估,采用韦氏儿童智力量表第Ⅳ版测试版进行测试,30~40min完成测试。韦氏儿童智力量表第Ⅳ版于2003年出版,后由我国京美测验公司与美国原出版公司合作,于2007年张厚粲先生主持下完成其中文版的修订,现已通过中国心理学会专家鉴定[11],是目前中国市面上使用最多的一种韦氏评分方法。采用韦氏智力量表进行智力评估时,最终分数概括为全量表智商(full scale intelligence quotient,FSIQ),FSIQ包括两部分:语言智商(verbal intelligence quotient,VIQ)和操作智商(perform intelligence quotient,PIQ)。智力评分70分以下定义为智力缺陷,70~79分为临界状态,80~89分为中下(迟钝),90~109分为中等状态,110~119分为中上(聪明),120~129分为优秀,130分及以上为非常优秀。本研究正常儿童智力(90~110)按平均值100计算;国外数据来自于Cotton等[9]对1960-1999年的32项共1146例患者IQ数据进行Meta分析的结果:FSIQ为(80.2±19.3)分,VIQ为(80.4±18.8)分,PIQ为(85.4±16.9)分。
1.2.3 疾病严重程度评估 根据Vignos量表[12]进行疾病严重程度评估:1级,能够独立行走,上下楼梯不需要协助;2级,可以独立行走,爬楼梯需要扶护栏协助;3级,可独立行走,爬楼梯需要协助,且四阶梯试验时间>12s;4级,可独立行走,不能爬楼梯;5级,可独立行走,不能爬楼梯,也不能从椅子上站起来;6级,无法独立行走。
1.2.4 分组 根据患者基因分析结果,将突变发生在51号外显子远端的突变定义为Dp140阴性突变[Dp140(-)组],将突变发生在45号外显子近端的定义为Dp140阳性突变[Dp140(+)组][13],而位于44~51外显子的突变由于不能预测是否影响Dp140的表达均不纳入两组[10]。
1.2.5 分析方法 本研究分析了122例DMD受试者的智力水平,并与正常儿童和国外既往研究报道的数据进行对比;同时将本组患者的智力水平与年龄、疾病严重程度进行相关性分析。此外,将DMD-Dp140(+)组和DMD-Dp140(-)组患儿的FSIQ、VIQ、PIQ进行比较,以探讨Dp140表达对智力的影响。
1.3 统计学处理 采用SPSS 19.0软件对数据进行统计分析。计量资料以表示,受试者与正常儿童或国外研究的FSIQ、VIQ、PIQ智力的比较采用单样本t检验;IQ与年龄、疾病严重程度的相关性分析采用Pearson双变量相关分析;DMD-Dp140(+)组患儿与DMD-Dp140(-)组患儿FSIQ、VIQ、PIQ的比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 突变类型 122例DMD患儿中缺失突变89例,重复突变11例,小缺失突变10例,无义突变9例,剪切突变、错义突变、小插入突变各1例。
2.2 认知功能水平 122例患儿的FSIQ、VIQ、PIQ均低于正常儿童水平100分(P<0.01),FSIQ得分为[54~131(93.34±16.31)分],其中FSIQ<70者共13例(10.66%),低于国际上1/3水平[8];VIQ得分为[57~130(91.52±15.97)]分,其中VIQ<70者共13例(10.66%);PIQ得分为[57~145(96.70±17.37)分],其中PIQ<70者共10例(8.20%,图1,表1)。
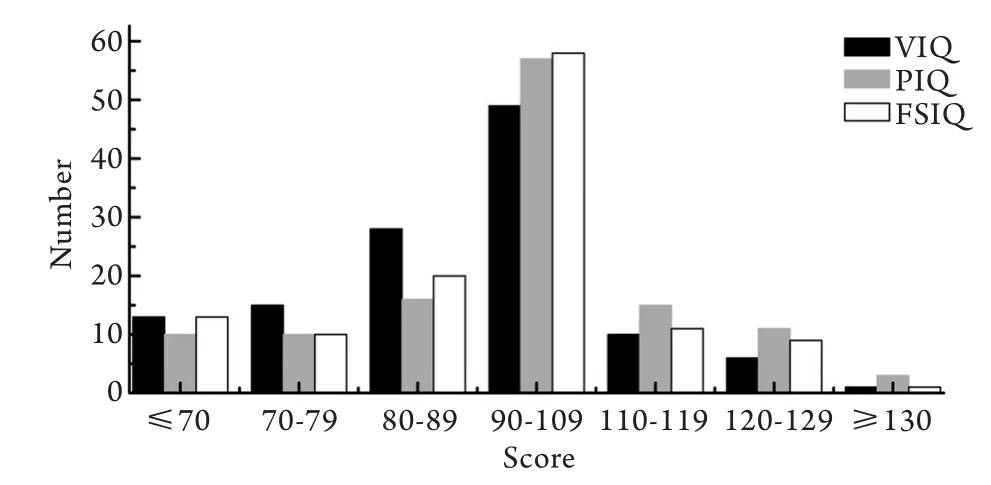
图1 DMD患儿FSIQ、VIQ、PIQ分布表Fig.1 FSIQ, VIQ and PIQ distribution in DMD children
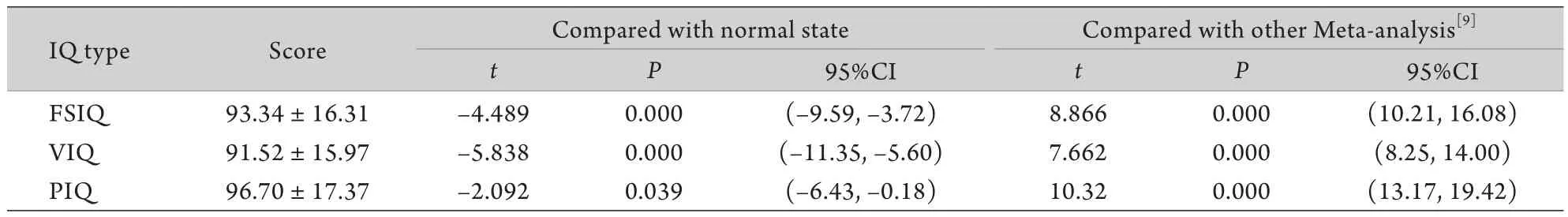
表1 DMD患儿韦氏儿童智力量表结果及比较(n=122)Tab.1 Results and comparison of Wechsler Intelligence Scale results in DMD children (n=122)
2.3 认知水平与年龄和疾病严重程度的相关性患儿年龄与Vignos量表等级呈正相关(r=0.365,P<0.01)。年龄与FSIQ、PIQ呈负相关,与VIQ和VIQ-PIQ无相关性。疾病严重程度与FSIQ、VIQ、PIQ呈负相关,与VIQ-PIQ无相关性(表2)。

表2 DMD患儿IQ与年龄/Vignos量表评分等级相关性检验结果(n=122)Tab.2 Correlation between DMD children IQ and age/Vignos score grade (n=122)
2.4 Dp140(+)与Dp140(-)患儿智力水平的比较Dp140(-)组患儿的FSIQ、VIQ、PIQ得分均明显低于Dp140(+)组患儿,差异有统计学意义(表3)。
表3 Dp140(+)与Dp140(-)患儿智力水平比较(±s)Tab.3 Comparison on intelligence levels between Dp140 positive/negative DMD children (±s)
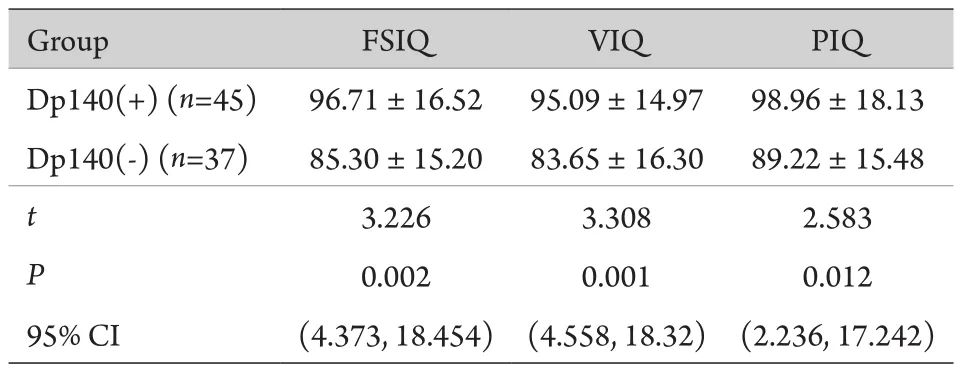
表3 Dp140(+)与Dp140(-)患儿智力水平比较(±s)Tab.3 Comparison on intelligence levels between Dp140 positive/negative DMD children (±s)
Group FSIQ VIQ PIQ Dp140(+) (n=45) 96.71±16.52 95.09±14.97 98.96±18.13 Dp140(-) (n=37) 85.30±15.20 83.65±16.30 89.22±15.48 t 3.226 3.308 2.583 P 0.002 0.001 0.012 95% CI (4.373, 18.454) (4.558, 18.32) (2.236, 17.242)
3 讨 论
3.1 认知功能水平 DMD患者的认知行为学研究始于20世纪60年代。Cohen等[14]在1968年报道,从IQ得分来看,DMD患儿出现智力受损的比率比正常儿童高很多(20.9%±3.0%),该研究的有效性有限,因为部分测试是由家长、医师或者教师完成的;1969年Prosser等[15]的研究再次验证了这个观点。这些研究都排除了经济社会学的影响,比如家庭收入、父母受教育程度等。Cotton等[9]Meta分析比较了DMD患者智力水平和智力缺陷的发生率及严重程度。他们将1146例患者的FSIQ、VIQ、PIQ与给定的标准值进行比较,发现患者FSIQ、VIQ、PIQ这三项的平均值较正常水平均低一个标准差(MFSIQ=80.2,MVIQ=80,MPIQ=85.4),其中智力缺陷占34.8%。进一步证实了早期几十年关于DMD患者一般智能下降的结论。
国内外关于DMD患者VIQ与PIQ水平的报道不全一致。部分研究认为,DMD患者言语智力与操作智力大致持平[16],但多数研究报道认为DMD患者言语智力比操作智力差[17-19]。Cotton等[9]的Meta分析的结果不仅证实DMD患者一般智能下降,同时支持DMD患者言语智力受损较操作智力受损更为严重。本组DMD患儿PIQ为(96.70±17.37)分,VIQ为(91.52±15.97)分,支持言语能力受损较执行能力更重,与Cotton等[9]的研究一致。
既往研究认为,DMD患者IQ<70的占比19%~35%,IQ<50的患者约3%[8]。本研究中IQ<70仅有13例,占10.66%,明显低于国际上1/3水平。而本组DMD患儿FSIQ平均值93.34,明显高于国外的平均水平[9,17-19]。
造成这种差异考虑与以下几方面有关: 数据来源的差异。我们收集的DMD患儿认知功能数据是2014-2017年来联合门诊就诊的患儿,随着近年来经济的发展和生活水平的提高,DMD患儿受教育程度显著提高,父母文化程度也相对较高,这些均会影响到认知功能评估。而Cotton等[9]2001年发表的Meta分析结果是基于过去40年间DMD患者的认知数据。入组年龄的差异:Cotton的Meta分析纳入的1146例患者的年龄在2~27岁,使用智力测试量表版本也不一样,且随着患者年龄增大,运动功能下降,会影响智力量表测试得分。而本研究纳入的122例患儿年龄6.0~13.3岁,大多集中在8~10岁,该年龄段的患儿运动功能保存尚好,肌力受损较轻,大多仍在接受学校教育,可较好地完成智力量表的测试;ƒ种族和地域的差异:既往有报道黑种人与白种人的IQ值相差达15分,提示种族之间有明显的智力水平差异[20]。
3.2 认知水平与年龄和疾病严重程度的相关性国外很多报道认为年龄与患者认知功能减退没有相关性[8],而本研究结果提示,DMD患儿认知功能与年龄有一定的相关性:FSIQ、PIQ与年龄呈负相关,而VIQ与年龄无相关性。分析原因可能是随着年龄增长,患儿的运动功能减退,导致在进行智能评估时其配合度下降,同时随着运动功能的下降,社会参与度减少、接受教育机会的限制和环境剥夺越来越严重,这些均会影响智力测试的结果。
本研究结果提示,认知与Vignos量表等级呈负相关。而国外关于认知功能与年龄、疾病相关程度的关系的研究结果不一致。Cohen[14]和Prosser等[15]认为智力水平与疾病严重程度无明显的相关性,也不会随着年龄的增长逐渐恶化,并指出患者智力水平的下降不是由于肌力的减退或者环境的剥夺(受教育和社交机会减少)引起的,而是与中枢神经系统受损有关。为了阐明DMD智力受损与肌力减退、环境剥夺的关系,Ogasawara等[21]比较了两组来自同一个住宅区/校区的脊髓性肌萎缩症(SMA)患者与DMD患者,结果发现DMD患者的FSIQ得分明显低于SMA患者的得分。该结果是对DMD患者原发性智力损害的最强有力的支持,提示DMD患者智力损害不能归因于骨骼肌功能障碍、运动损伤,或者其他社会、环境剥夺。当然也有研究与本研究结果一致,认为随着年龄的增长和疾病严重程度的加深,DMD患者的认知评分会更低,认知损害会更重[22-23]。
3.3 Dp140对智力的影响 Dystrophin蛋白的表达由7个高度复杂的启动子调控,负责表达3个全长的Dystrophin蛋白亚型Dp427c(主要在大脑皮层表达),Dp427m(主要在骨骼肌和心肌表达),Dp427p(主要在小脑浦肯野细胞表达)和4个较小的亚型Dp260(主要在视网膜表达),Dp140(主要在脑、肾和视网膜表达),Dp116(主要在婴儿脑和成人的周围神经表达),Dp71(除了肌肉,在各组织中广泛表达)[3]。在中枢神经系统中,全长的Dystrophin蛋白主要在皮质神经元和小脑浦肯野细胞中表达,关于它们的功能知之甚少[24]。4种较小亚型的Dystrophin蛋白起源于不同的组织特异的启动位点,氨基末端(N端)也各不相同,如:exon30为Dp260的起始外显子,exon45为Dp140的起始外显子,exon56为Dp116的起始外显子,exon63为Dp71的起始外显子[25]。
既往关于DMD的研究提出,发生在DMD基因远端的突变由于影响Dp140和Dp71的表达,更容易引起认知缺陷[26-28]。也有部分研究证实Dp140表达的缺失与DMD患者颅脑磁共振改变的相关性[10,29],同时,缺乏Dp140亚型的DMD与保留Dp140亚型的DMD患者相比,不仅在全智力和言语智力上表现更差,同时在语言学习、记忆、执行功能上表现也更差[30-32]。更有一项DMD患者头颅MRI的研究表明,缺乏Dp140亚型的DMD患者其大脑灰质减少[13]。
本研究通过对DMD患者认知功能与Dp140表达相关性的分析,探讨了DMD基因突变位点与认知功能的相关性,结果显示,Dp140(+)组患儿FSIQ、VIQ、PIQ得分[分别为(96.71±16.52)分,(95.09±14.97)分,(98.96±18.13)分]明显高于Dp140(-)组患儿[分别为(85.30±15.20)分,(83.65±16.30)分,(89.22±15.48)分],且与国外多项研究[9,17]结果一致。这些数据提示,DMD基因远端的突变尤其是影响Dp140表达的突变与DMD患者智力受损有一定的相关性。
综上所述,本研究DMD患儿智力水平较正常儿童水平下降,但比国外一般水平高;DMD患儿言语智力受损较操作智力受损更严重;Dp140表达与否与患者智力水平明显相关,由此我们可以推测,DMD患儿智力受损主要与中枢Dystrophin蛋白表达缺失有关,而运动功能的减退、社会参与度减少或者环境剥夺可能是智力测试的影响因素而非智力受损的决定因素。因此,当神经科或儿科医生面对DMD患儿时,需要更加关注患儿的智力发展情况,以早期发现异常并及时采取针对性的康复、干预措施及治疗,提高患儿的生存质量。由于本研究样本量偏少,有关智力水平与Dp71表达相关性的研究无法开展,未来有待扩大样本量进行进一步研究。同时,所有患儿来自门诊,结果可能存在一定局限性,尚需在以后的研究予以进一步完善。
