神经节苷脂GD3合酶缺失加重DSS诱导的小鼠炎症性肠病①
2019-01-17闫风连董冠军张俊凤宁召臣李春霞朱玉贞姚潇颖李学慧王玉忠司传平熊化保
闫风连 董冠军 张 惠 张俊凤 史 慧 宁召臣 李春霞 朱玉贞 姚潇颖 李学慧 王玉忠 司传平 熊化保
(济宁医学院免疫学与分子医学研究所,济宁272067)
炎症性肠病(Inflammatory bowel disease,IBD)是一种慢性易复发的胃肠紊乱疾病,由两种主要亚型组成:溃疡性结肠炎(Ulcerative colitis,UC)和克罗恩病(Crohn′s disease,CD)[1]。UC主要影响结肠,其特征是在黏膜以及黏膜下层产生炎症。 CD是一种透壁性的炎症,对从口腔到肛门的整个消化道都可能产生影响[1]。IBD最初主要在北美和欧洲一些发达国家高发,最近一些年在亚洲其发病率也持续增高[2,3]。目前普遍认为IBD的发生与环境、遗传、肠道微生物以及免疫等多方面因素的相互作用密切相关[2,4,5]。但其具体的发病机制尚不清楚。
神经节苷脂是一类非常重要的含有唾液酸的鞘糖脂,广泛分布于细胞的外表面,在脑组织中含量丰富[6]。GD2和GD3分别是含有两个糖基和三个糖基的双唾液酸神经节苷脂,在正常人的组织中不表达,或者低水平表达,一般只有在病态下才高水平表达,例如癌症以及神经退行性疾病等[6]。GD3和GD2在肿瘤的增殖、迁移、侵袭、黏附、血管生成以及肿瘤的免疫抑制中发挥着重要作用[6]。GD3合酶(GD3 synthase,GD3S)是一种调控GD3和GD2合成的酶,在肿瘤的发生发展以及神经退行性疾病中具有重要作用[6,7]。目前以GD3合酶为药物靶点开发治疗肿瘤新药具有广阔前景。有研究表明,具有炎症的肠黏膜中GD3的含量比正常肠黏膜要低,而且通过饮食在结肠细胞中增加神经节苷脂的含量可以降低促炎细胞因子信号通路[8],在培养的婴儿结肠中可以阻止低氧诱导的肠坏死以及细胞损伤[9]。但是具体的有关GD3合酶是否直接参与IBD还鲜有报道。因此本研究选择利用经典小鼠IBD模型以及GD3合酶缺陷小鼠来探索GD3合酶是否参与IBD以及在其中的作用。
1 材料与方法
1.1实验材料、试剂 C57BL/6小鼠购于济南朋悦实验动物繁育有限公司;神经节苷脂GD3合酶缺失小鼠(GD3S-/-)由济宁医学院附属医院王玉忠副主任提供,繁殖并饲养于本实验室SPF级动物房。DSS购自MP Biomedicals公司;IL-6 ELISA检测试剂盒购自BioLegend公司;结肠组织病理切片由济南金域医学检验中心有限公司制备;RIPA强裂解液、BCA检测试剂盒购自上海碧云天生物技术有限公司;TUNEL凋亡检测试剂盒购自Roche公司。酶联免疫检测仪购自BIOTEK公司;倒置荧光显微镜Ti-E购自日本NIKON公司;台式高速冷冻离心机Multifuge×1R购自ThermoFisher公司。
1.2方法
1.2.1小鼠IBD模型死亡率检测 于济南朋悦购买6周雄性C57BL/6小鼠,在本实验室SPF级动物房内适应1周,GD3S-/-小鼠繁殖并饲养于本实验室SPF级动物房,饲养至7周,与C57BL/6小鼠同时开始建立DSS诱导的小鼠IBD模型。实验分为两组:C57BL/6 DSS模型组(WT DSS组)以及GD3S-/-DSS模型组(GD3S-/-DSS组),各8只小鼠。两组小鼠均给予2.5%的DSS饮水,每天记录小鼠死亡数量,并绘制小鼠生存率曲线。
1.2.2小鼠IBD模型分组与样品采集 实验分为4组:C57BL/6对照组(WT组)、C57BL/6 DSS模型组(WT DSS组)、GD3S-/-对照组(GD3S-/-组)、GD3S-/-DSS模型组(GD3S-/-DSS组)。DSS模型组给予2.5%DSS饮水7 d、对照组给予正常饮水7 d,期间每天记录小鼠体重变化以及便血情况。7 d 后眼球取血,4 500 r/min离心10 min收集小鼠血清。解剖分离小鼠全结肠,测量结肠长度。将结肠内容物用医用棉签处理干净后备用。
1.2.3肠蛋白的提取及浓度测定 取结肠近肛门端2 cm结肠,加入1 ml RIPA强裂解液,用匀浆器进行匀浆,然后4℃静置裂解2 h,每15 min上下颠倒混匀,4℃ 12 000 r/min离心10 min,取上清。严格按照碧云天生物技术有限公司BCA蛋白浓度测定试剂盒说明书中操作步骤,检测各样品的蛋白浓度。
1.2.4肠匀浆上清以及血清中IL-6蛋白表达水平检测 包被:加入100 μl稀释好的 IL-6的包被抗体,在2~8℃包被过夜;封闭:用配好的清洗液洗板4次,加入200 μl assay diluent 在微孔板振荡器上室温孵育1 h;加样:洗板4次,加入100 μl稀释好的标准品以及样品,在微孔板振荡器上室温孵育2 h;加检测抗体:洗板4次,加入100 μl稀释好的检测抗体,在微孔板振荡器上室温孵育1 h;加酶:洗板4次,加入100 μl稀释好的Avidin-HRP,在微孔板振荡器上室温孵育30 min;显色:加入清洗液微孔板振荡器上振荡1 min后弃去孔内液体,清洗5次,加入100 μl TMB,室温避光孵育 15~30 min,根据孔内颜色的深浅(深蓝色)来判定;终止反应:迅速加入100 μl 终止液终止反应;读板:终止后15 min内,用检测波长450 nm 读值。
1.2.5TUNEL法检测细胞凋亡 结肠组织石蜡包埋切片,65~70℃脱蜡2 h;将组织切片置于染色缸中,用二甲苯洗2次,每次10 min;用无水乙醇洗2次,每次5 min。用95%、90%、85%、80%、75%乙醇各洗1次,每次3 min;用PBS于脱色摇床上洗2次,每次5 min;加入200 μg/ml蛋白酶K工作液于20~37℃水解 30 min,去除组织蛋白;用PBS于脱色摇床上洗3次,每次5 min;滴加试剂盒内的TUNEL检测液;将切片放于湿盒内37℃避光孵育1 h;用PBS于脱色摇床上避光清洗3次,每次5 min;擦净玻片,滴加防淬灭剂;封片。
1.3统计学处理 统计学分析实验数据应用GraphPad prism 6软件分析处理,两组之间比较采用非配对t检验,P<0.05为差异具有统计学意义。
2 结果
2.1GD3S缺失导致IBD模型小鼠生存率降低 与WT小鼠相比,GD3S-/-小鼠在给予2.5%DSS饮水第12天时全部死亡,而WT小鼠在建模16 d后仍有一半小鼠存活,经统计学分析显示其生存率差异有统计学意义(P<0.05,图1),说明神经节苷脂GD3或GD2在DSS诱导的IBD小鼠中具有一定的保护作用。
2.2GD3S缺失加重IBD模型小鼠的炎症表型 DSS诱导的IBD小鼠模型的典型特征是在饮用2%~5% DSS 5~7 d后出现便血、体重减轻,结肠长度变短的现象[10]。因此分别给予WT小鼠以及GD3S-/-小鼠2.5%DSS饮水7 d,期间每天记录小鼠体重变化以及便血情况,并检测7 d后其结肠长度。结果显示GD3S-/-小鼠在第5天时出现血便,而WT小鼠明显晚于GD3S-/-小鼠。且与WT小鼠相比,GD3S-/-小鼠其体重下降更快,在第4天时与对照组相比即有极显著差异(P<0.01,图2A)。GD3S-/-小鼠其结肠长度也显著短于野生型小鼠(P<0.01,图2B、C)。
2.3GD3S缺失加重IBD模型小鼠结肠黏膜的损伤 DSS诱导的IBD小鼠在建模6~10 d时结肠黏膜结构会出现明显溃疡,表现为紧密排列的单层管状细胞、隐窝层和扁平上皮层,逐渐出现肌层变厚,隐窝被中性粒细胞渗透,出现上皮层细胞大量死亡,隐窝结构消失且伴随大量炎症细胞的浸润[11]。通过HE染色以及TUNEL法分别观察WT小鼠以及GD3S-/-小鼠结肠黏膜损伤以及细胞死亡情况。HE染色结果显示GD3S-/-小鼠已无紧密排列的单层管状细胞,而且炎症细胞浸润更为严重。TUNEL结果显示GD3S-/-小鼠凋亡细胞明显增多。
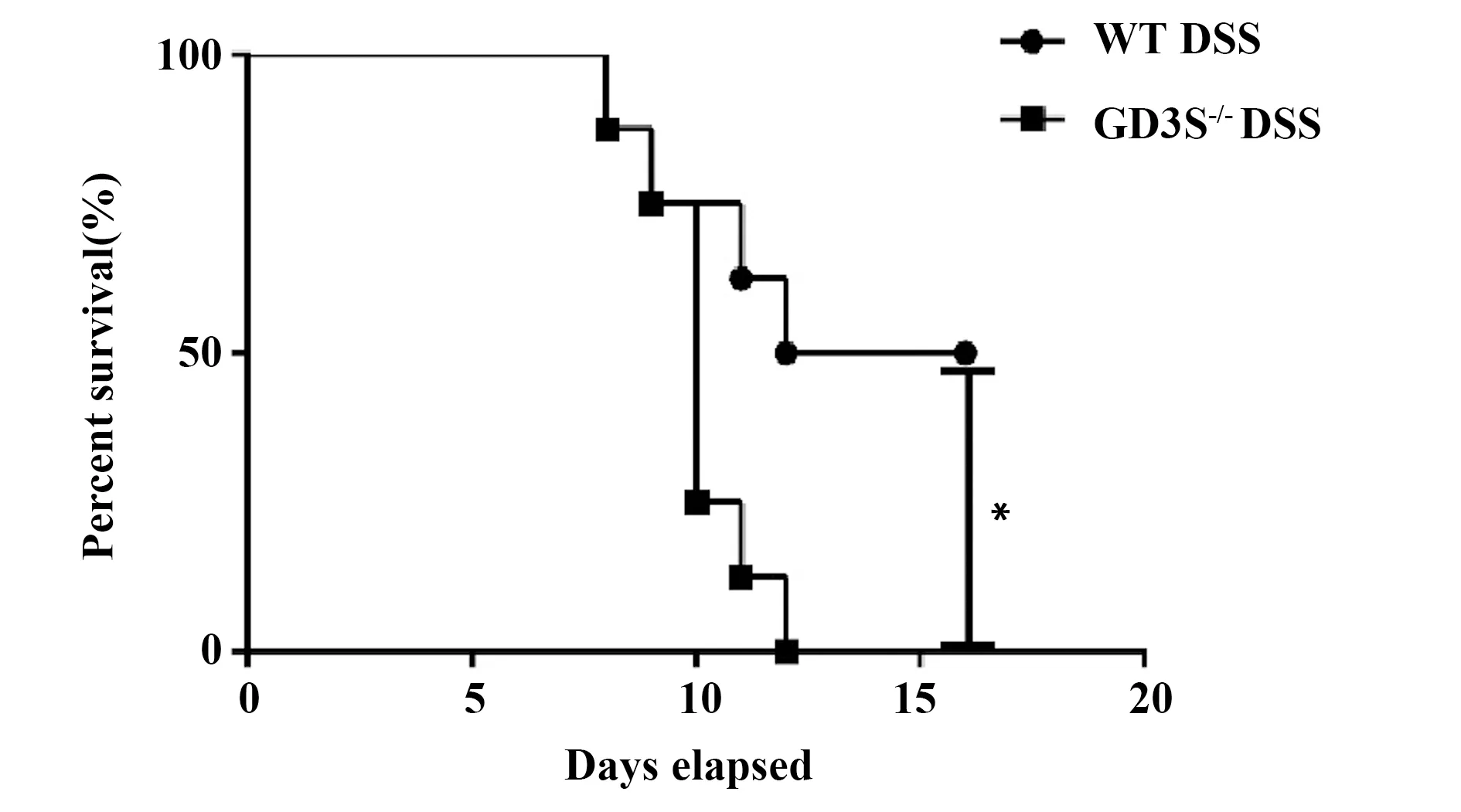
图1 神经节苷脂GD3合酶缺失降低IBD模型小鼠生存率Fig.1 Ganglioside GD3 Synthase deficiency decreased survival rate of IBD mouseNote: Kaplan-Meier method was used to estimate overall survival and the survival rates were determined by Log-rank test.Compared to WT DSS group,*.P<0.05.
2.4GD3S缺失使IBD模型小鼠炎性因子的分泌增加 DSS诱导的IBD的发生发展伴随着大量炎性因子的释放,结肠组织中炎性因子的表达水平也能反映结肠炎症的状态。检测了WT小鼠以及GD3S-/-小鼠血清和结肠组织匀浆中IL-6的表达,结果显示GD3S-/-小鼠血清以及结肠组织匀浆中IL-6的表达明显升高,与WT组相比具有极显著差异(P<0.01,图4A、B)。

图2 GD3S缺失加重IBD模型小鼠的炎症表型Fig.2 Ganglioside GD3 Synthase deficiency aggravated dextran sodium sulfate (DSS)-induced colitisNote: A.Loss of basal body weight of WT and GD3S-/-mice;B.Colon length of WT and GD3S-/-mice;C.The statistical result of Colon length.Compared to WT DSS group,**.P<0.01.

图3 GD3S缺失加重IBD模型小鼠结肠黏膜的损伤(HE,TUNEL,×200)Fig.3 Ganglioside GD3 Synthase deficiency increased pathological damage of colonic mucosa in inflammatory bowel disease(HE,TUNEL,×200)Note: HE (above) and TUNEL(below) methods were used to detect the pathological damage of colonic mucosa.
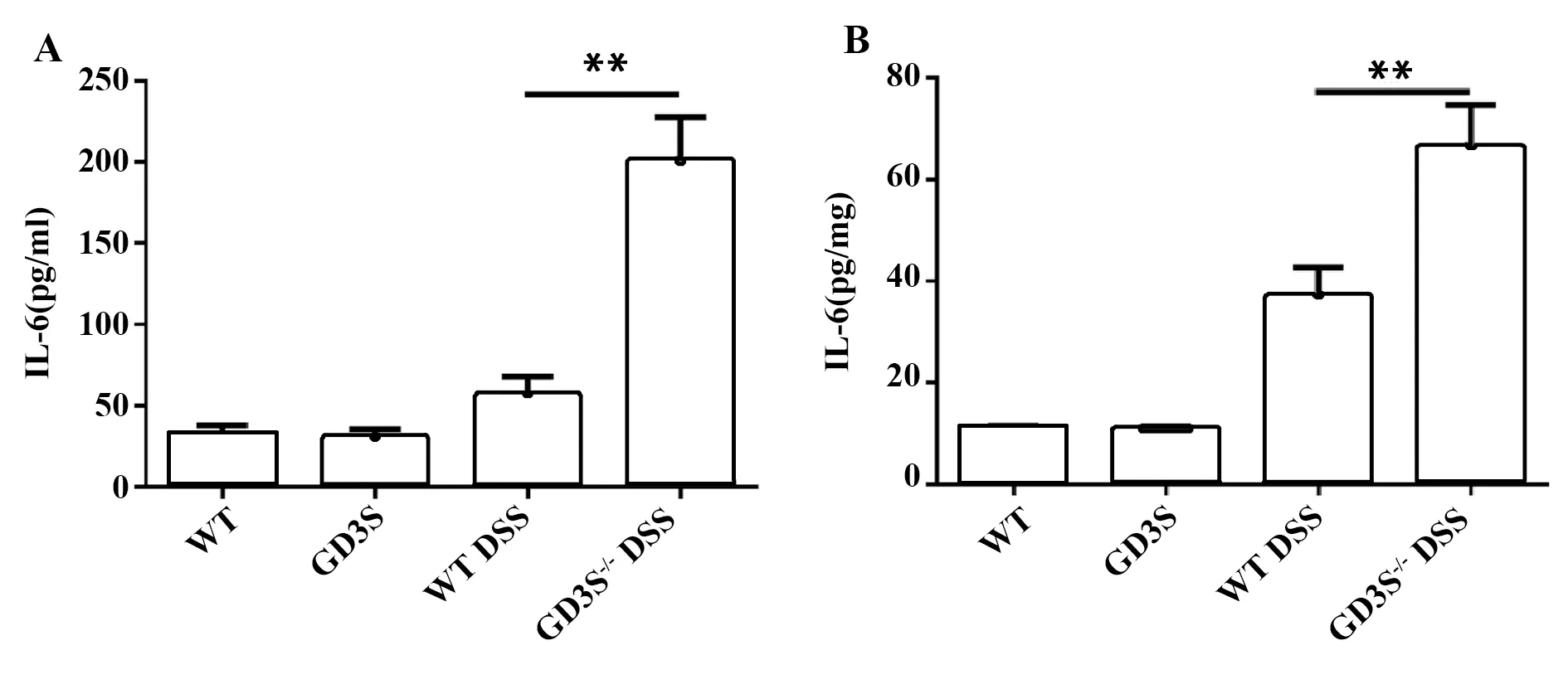
图4 GD3S缺失使IBD模型小鼠炎性因子的分泌增加Fig.4 Increased inflammatory cytokine production of Ganglioside GD3 Synthase deficiency mice in inflammatory bowel diseaseNote: A.Cytokine level in blood serum of WT and GD3S-/-mice;B.Cytokine level in colonic homogenate of WT and GD3S-/-mice.Compare to WT DSS group,**.P<0.01.
3 讨论
IBD是一种由环境、基因、免疫等多种因素相互作用导致的疾病。IBD患者会有规律地出现慢性炎症、过度活化的免疫应答、肠结构损伤、渗透性改变等症状,对于患者的生活质量具有很大的影响。目前主要通过类固醇类、免疫抑制剂类或抗生素等一些昂贵的药物来控制该疾病,严重者需要进行手术去除病变的结肠,但是这些手段均不能使该疾病完全治愈[12]。因此目前急需一种新的治疗方式来解决这一问题。神经节苷脂对于细胞膜结构和功能的完整性具有重要作用,是小肠纹状缘细胞以及结肠顶端表面细胞的组成成分,可以影响到多种细胞进程,包括微生物附着、细胞分裂、分化以及信号通路[13]。有研究表示神经节苷脂在肠黏膜中的新陈代谢可能是IBD发病的基础[14]。在肠黏膜中神经节苷脂含量较低,往往会伴随着炎症标志分子表达增加、容易感染致病菌、肠完整性被破坏等[13]。GD3、GD2作为神经节苷脂中的重要一员,目前其研究主要集中于对各种肿瘤以及神经退行性疾病的影响[6],在IBD中的作用还很少有报道,有报道指出IBD患者肠黏膜中GD3含量降低[14],但是具体GD3是否参与IBD的发生发展,还是IBD导致GD3含量的降低目前均还不清楚。GD3S是唯一的调控GD3和GD2合成的酶,已被认为是癌症治疗药物新的靶点[6],因此通过研究GD3S在IBD中的作用,可以为GD3、GD2是否参与IBD提供直接依据,也为IBD的治疗提供新的研究方向以及实验依据。
我们利用GD3S缺失小鼠,诱导IBD模型,发现GD3S-/-DSS模型组与WT DSS组相比,其生存率显著降低,体重下降明显加快,血便早于WT DSS组;结肠长度也显著短于WT DSS组;HE染色显示GD3S-/-DSS模型组结肠黏膜组织损伤较重,TUNEL染色显示GD3S-/-DSS模型组凋亡细胞显著增加;GD3S-/-DSS模型组血清以及结肠黏膜组织匀浆IL-6表达明显高于WT DSS。说明GD3S缺失会加重DSS诱导的IBD,GD3、GD2在IBD的发生发展中具有重要作用。但是GD3、GD2参与IBD的具体机制还未有报道,仍需进一步的研究。
目前已知的GD3可能参与IBD的机制包括以下几方面:①通过间接影响整合素进而影响免疫细胞向肠道的募集。趋化因子受体9可以使免疫细胞募集于肠道,但趋化因子9受体阳性免疫细胞主要分布在小肠,而整合素α4β7阳性的免疫细胞倾向于募集在小肠以及结肠[13],GD3可以和β1整合素聚集影响整合素介导的信号通路[15],这就提示GD3有可能通过影响整合素进而影响免疫细胞向肠道的募集。②影响NF-κB信号通路。CARD15[Nucleotideoligomerization domain-containing protein 2 (NOD2)]被认为是CD的一种遗传风险因子,CARD15 缺陷会导致NF-κB 持续激活,引发慢性炎症以及肠黏膜损伤[13]。GD3可以抑制有丝分裂原激活的T细胞中NF-κB 的激活[16]。NF-κB 的激活会促进环氧酶(Cyclooxygenase,COX) 以及脂氧合酶(Lipoxygenase,LOX)增加,促进花生四烯酸向促炎介质白三烯B4以及前列腺素E2的转化,进而促进炎症。说明GD3有可能通过NF-κB信号通路影响IBD。③影响肠黏膜通透性以及完整性。 肠黏膜的通透性是由紧密接头蛋白介导的,它主要位于脂筏上[17]。在肠黏膜中GD3含量低会导致紧密接头蛋白的降解,增加肠黏膜中GD3含量可以减少接头蛋白的降解从而减少肠黏膜渗透性、改善肠结构的完整性[14]。这些都为后续研究提供了一定的方向。
综上所述,GD3S缺失会加重DSS诱导的炎症性肠病,为GD3、GD2在炎症性肠病的发生发展中具有重要作用提供了实验依据,虽然其具体机制仍然需要进一步深入研究,但是也为IBD的治疗提供了新的方向。
