PinX1过表达对人卵巢癌细胞SKOV3增殖及侵袭的影响
2019-01-17朱静杨鹰
朱 静 杨 鹰
(陆军军医大学第二附属医院妇产科,重庆400037)
卵巢癌是严重威胁女性身心健康的恶性肿瘤之一,其发病率居女性生殖系统恶性肿瘤的第3位,而其致死率却位列首位[1]。近年来,临床上卵巢癌的治疗虽然在传统手术、化疗及放疗技术上有所改进,但晚期患者的5年生存率仍不容乐观,其主要原因是由于卵巢癌早期症状不明显,患者就诊时已至进展期,延误了最佳诊治时机[2]。因此,寻找新的、有效的卵巢癌分子标志物,对提高卵巢癌早期筛查与诊断具有重要意义。
人 Pin2 结合蛋白 X1 ( PIN2-interacting protein X1,PinX1)定位于人染色体8p23,是端粒和端粒酶的调控基因[3]。近年来研究显示,PinX1是一种潜在的抑癌基因,其表达水平的改变可能与多种肿瘤的发生、发展密切相关,在包括膀胱癌、食管癌、乳腺癌、宫颈癌等多种实体瘤中表达明显降低或不表达[4-7]。过表达PinX1可明显抑制肿瘤细胞的生长、降低裸鼠体内的成瘤性[8,9]。然而PinX1在卵巢癌细胞中的研究较少,PinX1 在卵巢癌的发生、发展进程中是否发挥着同样的重要作用目前尚不清楚。为此,本研究分别在 mRNA 及蛋白水平上检测了PinX1 在人卵巢癌细胞中的表达,并通过构建PinX1过表达重组载体,进一步探讨过表达PinX1对卵巢癌细胞SKOV3增殖及迁移的影响,旨在初步阐明PinX1在卵巢癌发生、发展过程中发挥的作用,为寻找卵巢癌有效的诊断及预后靶点提供实验依据。
1 材料与方法
1.1主要试剂 蛋白质提取试剂盒购自上海碧云天生物技术有限公司;兔抗人PinX1单克隆抗体、兔抗人c-myc单克隆抗体均购自美国Abcam公司,兔抗人MMP2单克隆抗体购自美国CST公司,GAPDH 抗体购自美国Sigma 公司,Lipofectamine 2000转染试剂购自美国Invitrogen 公司,总RNA 提取试剂盒购自美国OmegaBio-Tek公司。
1.2方法
1.2.1细胞培养 人卵巢癌细胞(Caov3、OVCAR3、A2780、SKOV3)及人正常卵巢上皮细胞株IOSE80由第三军医大学新桥医院中心实验室储存。细胞经复苏后培养于含 10% 胎牛血清的RPMI1640培养基中,于37℃、5%CO2孵箱中培养,2~3 d传代。
1.2.2PinX1真核过表达载体的构建与转染 根据PinX1基因在Genebank中的cDNA序列(NO:NM_017884.5) 设计上下游引物,并由上海生工合成,同时提取卵巢癌细胞SKOV3 总RNA,逆转录获得cDNA,以其为模板,进行PCR扩增并胶回收,按照pCMV-N-Flag操作手册构建重组载体,酶切鉴定并测序。
将SKOV3细胞以 2×105个/孔接种于 6 孔培养板中培养过夜,当细胞达80%~90% 融合时,参照 Lipofectamine 2000产品说明书,分别将pCMV-N-Flag-PinX1和空载体转染至6孔培养板中,4 h后更换新鲜培养基。实验分组为:vector组(转染空载体),PinX1组(转染pCMV-N-Flag-PinX1重组载体)。
1.2.3Real-time PCR 按照RNA 提取试剂盒说明书提取已收集的各组细胞总 RNA。采用SYBR Green 法 进 行Real-time PCR,用于扩增PinX1 cDNA的上游引物为:5′-GGGTGGTCTAAAGGA-AAGGGTT-3′,下游引物:5′-CGCCCTCGGGAGTCTT-CTTAC-3′;GAPDH上游引物:5′-GCACCGTCAAGGCTGAGAAC-3′,下游引 物:5′-ATGGTGGTGAAGACGCCAGT-3′,反应条件为:94℃ 2 min预变性;94℃ 30 s变性,55℃ 30 s退火,72℃ 30 s延伸,共 35 个循环,采用 2-ΔΔCT法计算并分析实验结果。
1.2.4Western blot 收集各组细胞,加入990 μl细胞裂解液及10 μl PMSF提取细胞总蛋白,采用BSA 法测定蛋白浓度,按1∶4加入适量上样缓冲液于100℃煮沸5 min变性;每孔 40 μg,采用80 V恒压、10%分离胶 SDS-PAGE 进行电泳,100 V 100 min 恒压将蛋白印迹电转至PVDF膜上,5% 脱脂牛奶室温封闭1 h,加入一抗( PinX1 1∶1 000、 c-myc 1∶500、MMP2 1∶1 000) 4℃ 孵育过夜,次日 TBST 漂洗 5 min×5次,加入 HRP 标记的二抗(1∶3 000) 室温孵育40 h,TBST 漂洗5 min×5次,ECL化学发光显影,使用 Quantity One 软件分析并统计数据。
1.2.5CCK-8增殖实验 以2×103个/孔将已转染24 h 的细胞接种于96孔板中,待细胞完全贴壁后记为 0 h,分别在 24、48、72、96 h 时间点,加入10 μl的CCK-8溶液,37℃孵育1.5 h,检测 450 nm 处光密度值。
1.2.6Transwell 侵袭实验 Transwell 小室上室加入60 μl Matrigel,下室中加入含15%胎牛血清的PRMI1640培养液,收集已转染24 h的各组细胞,计数,并以2×104个/孔接种入小室,37℃过夜培养24 h 后取出上室,4%多聚甲醛固定、结晶紫染色,观察并计数。

2 结果
2.1Real-time PCR、Western blot检测PinX1在卵巢癌细胞系及正常卵巢上皮细胞系中的表达 结果显示,人卵巢癌细胞OVCAR-3、A2780、SKOV3、Caov3中PinX1 mRNA、蛋白表达水平(依次为0.203±0.099、0.381±0.087、0.172±0.121、0.292±0.069)明显低于人正常卵巢上皮细胞IOSE80(0.69±0.156),尤其在 SKOV3 细胞中表达最低(图1)。

图1 Real-time PCR、Western blot检测不同卵巢癌细胞系及正常卵巢上皮细胞系中PinX1的表达水平Fig.1 Expression of PinX1 level was detected by Real-time PCR and Western blot in four ovarian cancer cells and a normal ovarian epithelial cellsNote: A.mRNA level;B.Protein level.*.P<0.05 vs IOSE80 cells,n=3.
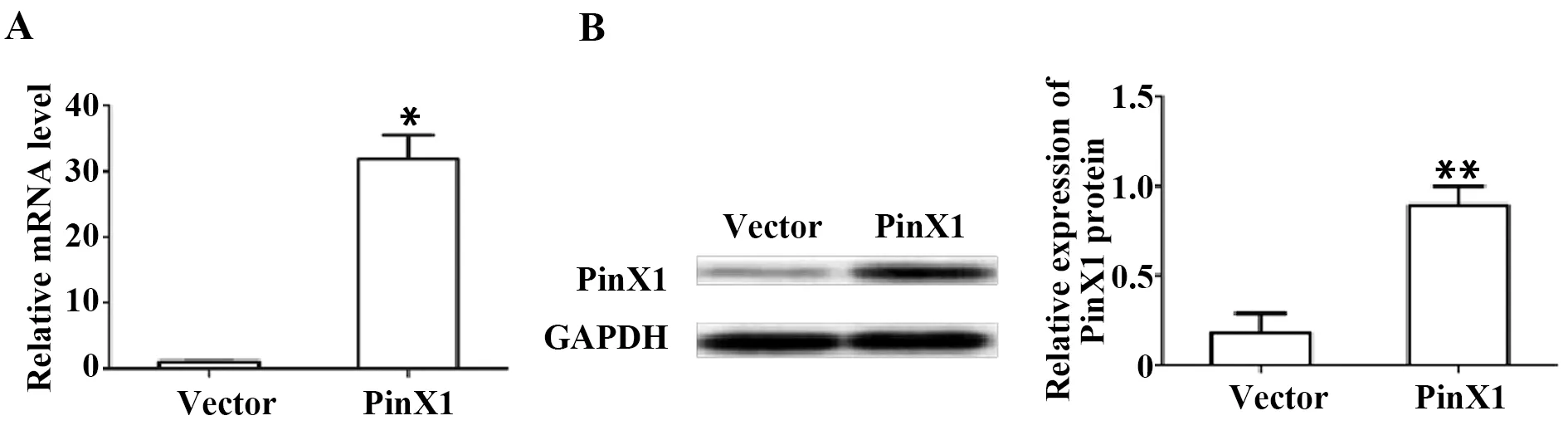
图2 Real-time PCR、Western blot 分别在mRNA与蛋白水平检测 PinX1过表达效率Fig.2 Expression of PinX1 mRNA and protein levels was detected by Real-time PCR and Western blot,respectivelyNote: A.mRNA level;B.Protein level.*.P<0.05 vs vector group,n=3.

图3 CCK-8 检测过表达PinX1 基因对SKOV3 细胞增殖的影响Fig.3 SKOV3 cells were transfected with vector or pCMV-N-Flag-PinX1 plasmid and cell proliferation was evaluated by CCK-8 assayNote: **.P<0.01,vs vector group,n=3.
2.2Real-time PCR、Western blot 验证PinX1 过表达效率 结果显示,PinX1组中PinX1基因的相对表达量明显高于对照组,对照组中PinX1蛋白表达为0.181±0.109,过表达组为0.892±0.094,差异具有统计学意义(图2,P<0.05),提示PinX1 基因被有效过表达。
2.3过表达PinX1对人卵巢癌SKOV3 细胞增殖能力的影响 采用 CCK-8 法检测细胞贴壁后24、48、72、96 h的光密度值并绘制生长曲线,结果显示与vector组相比,PinX1组中细胞生长速率明显下降,提示过表达 PinX1对SKOV3细胞生长存在抑制作用,差异具有统计学意义(图 3,P<0.01)。
2.4过表达PinX1对人卵巢癌SKOV3 细胞侵袭能力的影响 Transwell实验结果显示,PinX1组中细胞量较对照组明显减少,差异具有统计学意义(图 4,P<0.05),提示过表达PinX1可抑制 SKOV3 细胞侵袭能力。
2.5过表达PinX1对卵巢癌 SKOV3 细胞c-myc,MMP2 表达的影响 结果显示, 对照组与过表达组中c-myc蛋白表达分别为0.871±0.09、0.435±0.141,MMP2蛋白表达分别为0.622±0.11、0.312±0.08,PinX1组中c-myc、MMP2表达水平明显低于vector 组(图 5),提示过表达PinX1能抑制 c-myc 和MMP2的表达。

图4 过表达PinX1对SKOV3 细胞侵袭能力的影响Fig.4 Results of Transwell Matrigel invasion assay of SKOV3 cells with PinX1 up-regulationNote: **.P<0.01 vs vector group,n=3.

图5 过表达PinX1对c-myc、MMP2表达的影响Fig.5 Expression of MMP2 and c-myc detected by Real-time PCR and Western blotNote: A.c-myc expression;B. MMP2 expression;*.P<0.01 vs vector group,n=3.
3 讨论
癌基因的激活、抑癌基因的失活以及它们彼此相互作用的失衡是肿瘤形成的主要原因,因而,探索与卵巢癌发生、发展相关重要基因及其所介导的信号通路将有助于揭示卵巢癌的发病机制,为卵巢癌的诊疗提供重要的分子生物学依据。
前期研究显示,与正常卵巢上皮组织相比PinX1在卵巢癌组织中明显低表达,且与肿瘤的淋巴结转移、FIGO分期密切相关[10],然而其具体的分子作用机制却鲜为人知。为此,本研究首先分析了PinX1在人正常卵巢上皮细胞和不同卵巢癌细胞中的表达,Real-time PCR、Western blot结果显示 PinX1在卵巢癌细胞中表达明显降低,提示其可能作为抑癌基因,参与肿瘤的发生发展,与先前在临床组织的研究结果一致。为了进一步探讨其对卵巢癌细胞生物学行为的影响及其相关分子机制,本研究通过构建pCMV-N-Flag-PinX1过表达重组载体,采用脂质体瞬时转染入人卵巢癌细胞SKOV3中,并分别在mRNA 和蛋白水平检测PinX1在细胞中的表达变化,结果显示PinX1表达水平显著上调,提示PinX1基因被有效过表达,而稳定过表达PinX1载体的成功构建可能为基因的靶向治疗提供有力的工具。此外,CCK8、Transwell实验结果显示过表达PinX1后,SKOV3 细胞活力受到抑制,细胞侵袭能力显著降低,提示在卵巢癌细胞中,低表达的PinX1可能促进了卵巢癌的恶性增殖,且与肿瘤的浸润转移密切相关。
近年来研究显示,肿瘤的发生过程中涉及众多基因的表达异常,例如c-myc、MMP2在乳腺癌、肺癌、食管癌多种实体瘤组织中呈高表达趋势[11,12]。c-myc作为myc基因家族的重要成员之一,通过直接响应有丝分裂信号,参与肿瘤细胞周期进程。金属基质蛋白酶2(Matrix metalloproteinase 2,MMP2) 通过降解细胞外基质中的各种蛋白成分,破坏肿瘤细胞侵袭的组织学屏障,在肿瘤侵袭转移过程中发挥着重要作用[13]。有报道发现下调c-myc、MMP2基因表达能明显抑制肿瘤细胞的增殖、侵袭能力[14-16]。在此基础上,本研究为了揭示过表达PinX1导致卵巢癌细胞增殖、侵袭能力下降的原因,进一步检测了c-myc、MMP2蛋白表达水平的变化,结果显示 c-myc、MMP2表达明显降低,提示PinX1可能通过调控c-myc、MMP2蛋白表达而影响卵巢癌的增殖、侵袭能力。此外,大量的研究证实c-myc、MMP2是Wnt/β-catenin信号通路下游重要靶基因,磷酸化的β-catenin通过与T细胞因子家族转录因子(TCF/LEF)相互作用,进入细胞核进而调控其表达,促进肿瘤细胞的增殖与侵袭[17,18]。由此提示我们,PinX1可能通过参与调控Wnt/β-catenin信号活化调节c-myc、MMP2的表达,促进卵巢癌的增殖与侵袭,而 PinX1 如何靶定其相关分子来介导这一过程目前仍不明确,有待更进一步的探索。
综上所述,卵巢癌中低表达的PinX1通过促进卵巢癌细胞的增殖与侵袭,参与了卵巢癌的发生发展,相信随着对PinX1基因功能研究的完善,其必将成为诊断和治疗卵巢癌的新靶点。
