五味子乙素对香烟烟雾提取物和脂多糖损伤的肺上皮细胞干预作用研究①
2019-01-17胡素珍黎宛妍敖然张大鹏张志敏
胡素珍黎宛妍敖然张大鹏张志敏
(广州医科大学附属第一医院,广州510030)
五味子乙素(Schisandrin B,Sch B)是中药五味子[Schisandra chinesis(Turcz.)Baill]木脂素类主要活性成分之一。多种研究表明,Sch B具有抗炎、抗氧化、抗肿瘤、抗衰老、抗心肌缺血、保肝利胆等生物活性[1,2]。慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是一种以进行性、不完全可逆性气流受限和肺部炎性病变为主要特征的慢性肺部疾病,具有反复发作、进行性发展的特点。其发病机制虽未完全清楚,但与烟雾或有害气体和颗粒引起的肺部或全身的炎症反应有关,炎症反应过程进一步可引起COPD急性发作(Acute exacerbation chronic obstructive pulmonary disease,AECOPD ),因此控制和减轻AECOPD 患者局部或全身的炎症反应对提高疗效具有重要意义。本实验以体外培养的人肺泡上皮细胞A549为研究对象,在体外成功建立了CSE联合LPS诱导A549细胞COPD急性加重期模型,以A549细胞相关增殖抑制、mRNA水平、蛋白水平为评价指标,初步探讨Sch B对CSE联合LPS对A549细胞炎症损伤及其作用机制。
1 材料与方法
1.1材料
1.1.1细胞 肺上皮细胞A549由广州医科大学国家重点实验室提供。
1.1.2药物及试剂 五味子乙素购自成都曼思特生物科技有限公司;胎牛血清、RPMI1640培养基、0.25 mg/ml 胰蛋白酶(美国Gibco);青-链霉素双抗(×100)、PBS(×1)(吉诺生物医药技术公司);二甲基亚砜(DMSO)(美国Sigma);RT-PCR引物由生工生物工程(上海)股份有限公司合成;NF-κB Pathway sampler Kit、GAPDH抗体(Cell Signaling Technology);IL-8、COX-2 ELISA试剂盒(武汉华美)。
1.1.3仪器及耗材 CO2培养箱( Thermo,311 型,美国); 超净工作台( ESCO,新加坡);荧光定量PCR仪( 7500,ABI,美国);高速冷冻离心机(Allegra X-22,BECKMAN,R美国);倒置显微镜(IX71,Olympus,日本)。
1.2方法
1.2.1细胞培养 将肺上皮细胞A549用含10%胎牛血清、1%双抗(青霉素100 U/ml、链霉素100 U/ml)的RPMI1640培养基,于37℃、5%CO2、饱和湿度条件下进行细胞培养,隔天更换新鲜培养基,待细胞融合70%~80%时,以0.25%胰酶消化,用于传代或种板。
1.2.2体外制备COPD急性加重期细胞模型(CSE联合LPS) 香烟烟雾提取物的制备 香烟为“红双喜”牌香烟(广东中烟工业有限责任公司,焦油量11 mg;烟碱量1.2 mg;一氧化碳量13 mg),5 ml无血清的RPMI1640培养基装入2个串联的气体采样管(大包氏管)内作为吸收液,点燃去掉过滤嘴的香烟,采集香烟主流烟雾。大包氏管一端连接香烟,另一端连接50 ml注射器,以50 ml/min的速度吸烟2支,每支烟吸10次,然后将该溶液pH值调整为7.40,并用0.22 μmol/L 滤孔直径的滤膜过滤,去除细菌和颗粒,制备成100%CSE溶液[3,4]。根据实验需要稀释成不同梯度浓度。30 min内用于实验。脂多糖(Lipoplysaccharide,LPS)使用终浓度为0.4 μg/ml。与CSE共同加入肺上皮细胞中作用 24 h 制备COPD急性加重期体外模型。
1.2.3细胞分组 细胞共分为4组,即空白对照组(CON)、模型组(CSE+LPS)、低剂量Sch B组(5 μmol/L)、高剂量Sch B组(20 μmol/L)[5,6]。当细胞生长至适合造模和给药时,CON用完全培养基培养,模型组给予4% CSE联合0.1 μg/ml LPS,给药组除造模外给予相应剂量Sch B。收集细胞或上清,检测相关指标。
1.2.4MTT法测定细胞活性 各组细胞培养至相应时间后,每孔加MTT溶液(5 mg/ml,用PBS配制,pH调整为7.4)继续培养4 h,终止培养,小心吸弃孔内培养上清液,每孔加150 μl DMSO,脱色摇床振荡10 min,使结晶物充分溶解,选择570 nm波长,在酶联免疫检测仪上测定各孔吸光度值(OD)并分析存活率,存活率=OD给药组/OD对照组×100%。
1.2.5荧光定量PCR法检测相关因子表达 各组细胞培养至相应时间后,吸弃上清,用预冷PBS(×1)溶液洗3次,然后加入1 ml Trizol,具体操作按试剂盒说明书进行,用紫外分光光度计测定总RNA的A260 nm、A280 nm,计算RNA样品的浓度和纯度,A260 nm/A280 nm在1.9~2.1之间视为合格。cDNA合成按照Prime ScriptTMRTreagent kit 说明书操作,总RNA取样2 μg,为有效地反转录全长mRNA。qPCR反应体系20 μl,扩增条件为95℃ 30 s 预变性,95℃ 5 s,60℃ 34 s,40个循环,每份样品做复孔检测。IL-8上游引物CCACCGGAGCACTCCATAAG,下游引物GATGGTTCCTTCCGGTGGTT;COX-2上游引物GTTCCACCCGCAGTACAGA,下游引物AGGGCTTCAGCA-TAAAGCGT;GAPDH上游引物GAAAGCCTGCCGGTGACTAA,下游引物AGGAAAAGCATCACCCGGAG。mRNA相对表达量用比较CT值法计算,以基因GAPDH为内参,即用内参基因和靶基因CT值差(ΔΔCT)计算靶基因相对内参基因的表达量(2-ΔΔCT),然后与对照组比较,计算实验组mRNA的相对表达量(RNA relative quantity)。
1.2.6ELISA检测相关指标 各组细胞培养至相应时间后,收集细胞上清,1 000 rcf,4℃,离心15 min取上清进行检测。具体操作步骤:将ELISA试剂盒中各种试剂移至室温(18~25℃)平衡至少30 min,按各自试剂配制方法配制试剂以备用;加样:分别设标准品孔、待测样本孔。每孔分别加标准品或待测样本100 μl,轻轻晃动混匀,覆上板贴,37℃温育2 h;弃去液体,甩干,不用洗涤;每孔加生物素标记抗体工作液100 μl,覆上新的板贴,37℃温育1 h;弃去孔内液体,甩干,洗板3次。每次浸泡2 min,200 μl/孔,甩干;每孔加辣根过氧化物酶标记亲和素工作液100 μl,覆上新的板贴,37℃温育1 h;弃去孔内液体,甩干,洗板5次。每次浸泡2 min,200 μl/孔,甩干;依序每孔加底物溶液90 μl,37℃避光显色15~30 min;依序每孔加终止液50 μl,终止反应;在反应终止后5 min内用酶标仪在450 nm波长依序测量各孔的光密度。
1.2.7免疫印迹实验(WB)法检测磷酸化蛋白水平 各组细胞培养至相应时间后,吸弃细胞上清,用冰冻PBS(×1)清洗3次,RIPA裂解液冰上裂解30 min,12 000 r/min,4℃离心20 min,取上清,BCA 法检测蛋白浓度,SDS-聚丙烯酰胺凝胶电泳,转膜,5%脱脂奶粉封闭1 h,GAPDH,NF-κB,pNF-κB抗体(1∶2 000)孵育4℃过夜,TBST(×1)洗涤,10 min/次,3次,鼠抗兔IgG二抗孵育1 h,TBST(×1)洗涤,10 min/次,3次,化学显影,检测蛋白表达。以GAPDH 为内参照计算相对灰度值,进行统计学分析。

2 结果
2.1五味子乙素抑制CSE联合LPS诱导的肺上皮细胞增殖 首先用1~60 μmol/L Sch B作用肺上皮细胞A549 48 h,观察Sch B对肺上皮细胞的直接抑制作用。结果见图1A。结果表明,不同浓度的Sch B均对A549细胞增殖有一定的抑制作用,且呈剂量依赖性(P<0.05)。其次用4%CSE联合0.1 μg/ml LPS作用A549细胞24 h后,制备COPD急性加重期模型,见图1B。结果表明,CSE联合LPS能够明显促进肺上皮细胞增殖,与正常组比较有统计学意义(P<0.01);加入5 μmol/L和20 μmol/L的Sch B后,逆转了4% CSE联合0.1 μg/ml LPS对细胞的过度增殖作用,与模型组比较有统计学差异(P<0.05)。
2.2五味子乙素抑制CSE联合LPS处理肺上皮细胞IL-8、COX-2 mRNA的表达 用4% CSE联合0.1 μg/ml LPS作用A549细胞24 h后,采用荧光定量PCR法检测细胞IL-8、COX-2 mRNA水平,见图2A、B。结果表明,CSE联合LPS能够促进细胞中IL-8、COX-2的表达水平,与正常组比较有统计学差异(P<0.05,P<0.01)。分别加入5 μmol/L和20 μmol/L的Sch B 作用72 h后,IL-8、COX-2的mRNA水平明显降低,特别是20 μmol/L的Sch B作用更加明显,与模型组比较差异具有明显的统计学意义。
2.3五味子乙素减少CSE联合LPS对A549细胞上清IL-8、COX-2的含量 用4% CSE联合0.1 μg/ml LPS作用A549 细胞24 h后,采用ELISA法检测细胞上清IL-8、COX-2的含量,见图3。结果表明,CSE联合LPS能够增加细胞上清IL-8、COX-2的含量,与正常组比较有统计学意义(P<0.05,P<0.05);分别加入5 μmol/L和20 μmol/L的Sch B 48 h后,细胞上清IL-8的含量均明显减少,与模型组比较差异有统计学意义(P<0.01,P<0.05),且成一定的剂量依赖性。分别加入5 μmol/L和20 μmol/L的Sch B 48 h后,细胞上清COX-2的含量均明显减少,与模型组比较差异有统计学意义(P<0.05,P<0.05)。
2.4五味子乙素下调CSE联合LPS对A549细胞磷酸化NF-κB蛋白水平 用4% CSE联合0.1 μg/ml LPS作用A549细胞24 h后,用蛋白印迹法检测细胞磷酸化NF-κB蛋白水平,见图4。结果表明,CSE联合LPS能够上调A549细胞磷酸化NF-κB蛋白水平,与正常组比较具有统计学差异(P<0.05); 分别给予5 μmol/L和20 μmol/L Sch B处理48 h后,A549细胞磷酸化NF-κB蛋白水平明显下调,其中以20 μmol/L 的Sch B作用更为明显。

图1 Sch B抑制CSE联合LPS诱导的肺上皮细胞增殖Fig.1 Sch B inhibits proliferation of lung epithelial cells induced by CSE combined with LPSNote: Compared with control group,**.P<0.05,***.P<0.01;compared with model group,#.P<0.01.

图2 Sch B抑制CSE联合LPS处理肺上皮细胞IL-8(A)、COX-2(B)mRNA的表达Fig.2 Sch B inhibits expression of IL-8(A) and COX-2(B)mRNA in lung epithelial cells induced by CSE combined with LPSNote: Compared with control group,**.P<0.05,***.P<0.01;compared with model group,#.P<0.05;ns.No statistical difference.

图3 Sch B减少CSE联合LPS对A549细胞上清IL-8(A)、COX-2(B)含量Fig.3 Sch B reduces content of IL-8(A) and COX-2(B) in supernatant of A549 cells by CSE combined with LPSNote: Compared with control group,**.P<0.05,***.P<0.01;compared with model group,#.P<0.05.
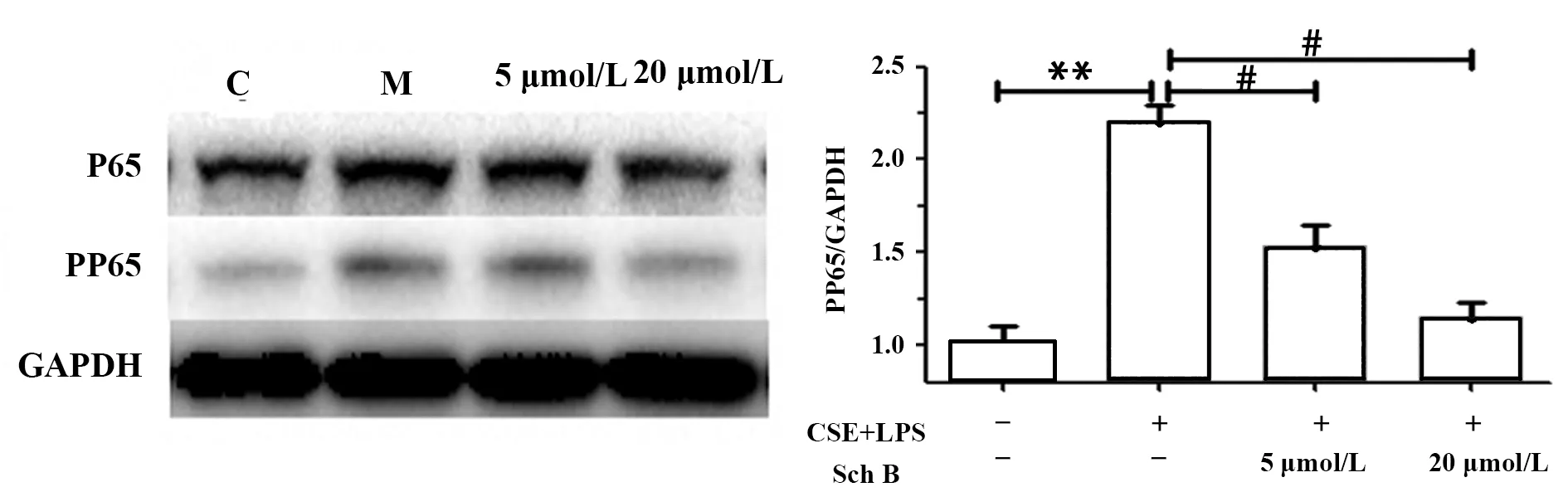
图4 Sch B下调CSE联合LPS对A549细胞磷酸化NF-κB蛋白水平Fig.4 Sch B down-regulates phosphorylation of NF-κB protein in A549 cells by CSE combined with LPSNote: Compared with control group,**.P<0.05;compared with model group,#.P<0.05.
3 讨论
五味子,习称“北五味子”,是木兰科植物五味子的干燥成熟种子,是著名的滋补性中药,功能收敛固涩,益气生津,补肾宁心;临床主要应用于久咳虚喘;梦遗滑精,遗尿尿频;久泻不止;自汗,盗汗;津伤口渴,内热消渴;心悸失眠。现代药理研究表明,五味子的主要活性成分是木脂素类,而Sch B是五味子木脂素的主要活性成分之一[7,8]。据报道,Sch B具有抗炎、抗氧化、抗肿瘤、抗衰老、保肝利胆等作用[9-12]。其中,Sch B抗炎作用已被用于哮喘,支气管扩张,慢性阻塞性肺气肿等疾病的治疗。对Sch B抗炎作用及机制的研究,有助于更加合理有效地运用Sch B以及开发五味子的临床应用。
COPD是一种以进行性、不完全可逆性气流受限和肺部炎性病变为主要特征的慢性肺部疾病,具有反复发作、进行性发展的特点[13]。各种有害气体和颗粒是诱发肺部炎性病变的主要原因,可引起COPD急性发作及加重病情。AECOPD过程中释放的炎症介质,可导致一系列的生理、病理变化,急性加重期可反复发作和渐进发展,导致病情逐步加重,引起呼吸衰竭,甚至危及生命。
AECOPD的病因及发病机制尚未完全清楚,目前研究认为气道和肺组织对香烟、烟雾、职业性粉尘等有害气体或有害颗粒所引起的异常炎性反应具有密切的关系。研究认为,有害气体或有害颗粒可以通过其毒性损伤、氧化应激等方式引发气道的异常炎症反应。单香烟而言,其烟雾含有500多种化学物质组成的高毒性复杂混合物,如尼古丁、一氧化碳、甲醛、乙醛、丙烯醛、苯酚和氰化物等有害成分。香烟烟雾暴露可激活并聚集气道及肺泡的炎性反应细胞,使其释放多种炎性反应递质及细胞因子,破坏气道和肺的结构,进一步促进炎性反应,造成气管狭窄、不完全堵塞,导致COPD的发生[14]。
LPS是细菌内毒素的主要成分之一,可以刺激组织细胞,进而释放出多种炎症介质(包括细胞因子和趋化因子等),诱导炎症反应,是常用的细胞炎症模型的造模工具。已有多项研究采用香烟烟雾提取物联合LPS制备COPD急性加重期体外模型[15],本研究结果也表明,香烟烟雾提取物联合LPS模型组细胞数明显增加,细胞炎症水平升高,与正常组比较具有统计学意义,说明CSE联合LPS可造成肺上皮细胞炎症性损伤,体外损伤模型制备成功。
IL-8和环氧合酶-2(COX-2)是重要的炎症介质[16,17],是参与AECOPD炎症反应过程的重要因子,大量文献报道研究表明,在AECOPD的炎症反应过程中,IL-8和COX-2水平是上调的,给予相应浓度的药物后,可以下调IL-8和COX-2的水平[18,19],本研究也表明,给予五味子乙素后,能够下调IL-8、COX-2的基因和蛋白水平,与其他人的研究结果相一致。
核因子-κB(Nuclear factor kappa B,NF-κB),是一类可与免疫球蛋白κB轻链基因增强子特异性结合的核蛋白因子,广泛存在于真核细胞中,是一种重要的核转录因子,激活后能够调控多种与细胞生长、生存、凋亡等相关的转录因子,参与细胞的炎症反应、免疫反应、增殖、凋亡等生理活动。研究发现,NF-κB在正常组织和癌旁组织中不表达或者微表达,并且处于激活和失活的平衡状态,从而使细胞处于生理平衡状态,维持正常的生理功能。但在病理情况下,NF-κB往往处于高表达状态。已有研究表明,香烟提取物可以明显上调肺上皮细胞NF-κB信号通路[20],下调磷酸化NF-κB蛋白水平,可能是COPD急性发作期的一种治疗策略。本实验提取了肺上皮A549细胞总蛋白,分别检测细胞中总的以及磷酸化NF-κB的表达水平。结果表明CSE联合LPS模型组磷酸化NF-κB表达水平增加,说明NF-κB通路参与了COPD炎症反应过程,通过调控这条信号通路,有望在COPD的发展过程中,减少或抑制炎症介质的释放,从而改善COPD的炎症微环境,降低COPD的发病[21]。本研究结果也证实,给予五味子乙素后,A549细胞磷酸化NF-κB蛋白表达水平明显下调,表明五味子乙素可能在COPD急性发作期有一定的治疗价值。
总之,采用CSE联合LPS诱导肺上皮细胞A549炎症损伤,以此建立COPD急性加重期细胞模型,并同时给予五味子乙素干预。本研究结果表明五味子乙素能够抑制CSE联合LPS诱导的肺上皮细胞的过度增殖,抑制模型细胞的炎症因子表达,显示具有较好的抗炎作用,其机制可能是通过调控NF-κB信号通路,下调与炎症密切相关的IL-8、COX-2等的表达,从而改善炎症微环境有关。本研究结果也与其他研究者发现的五味子乙素具有的抗炎以及抗氧化的结果相一致[22]。
