凡纳滨对虾商业苗种抗WSSV性能比较*
2019-01-17董丽君曹家旺陈宝龙曹宝祥孟宪红
董丽君 罗 坤 曹家旺 陈宝龙 栾 生 曹宝祥 隋 娟 孟宪红①
(1.农业农村部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;2.青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;3.上海海洋大学水产与生命学院 上海 201306)
凡纳滨对虾(Litopenaeus vannamei),俗称南美白对虾,原产于太平洋西岸水域秘鲁北部至墨西哥桑诺拉一带,具有营养价值高、生长迅速、抗逆性强等优点。自1988年由中科院海洋所的张伟权教授从美国引进中国并突破人工繁育技术,1999年从美国夏威夷海洋研究所引进SPF (无特定病原)亲虾后,其养殖规模和养殖产量逐年扩大(张伟权, 1990; 王兴强等,2004)。2016年凡纳滨对虾海水养殖产量达93万t,较 2015年增长 2%,占我国对虾海水养殖总产量的70%以上,成为我国对虾养殖产量最多的种类之一(农业部渔业渔政管理局, 2017)。但由于种源受控于其原产地国,国内苗种质量参差不齐,且养殖环境恶化、各种疾病频发,极大地限制了凡纳滨对虾养殖业健康快速发展。1992年,白斑综合征病毒(White spot syndrome virus, WSSV)在台湾地区首次发现,然后迅速遍布亚洲、欧洲等全球对虾养殖区域,迄今依然是影响对虾养殖业健康发展的主要因素(Hassonet al,2006; Nakanoet al, 1994)。WSSV不仅具有高致死率,且感染宿主范围非常广,除感染凡纳滨对虾、中华绒螯蟹(Eriocheir sinensis)等甲壳类动物(闫冬春, 2007;何培民等, 2016),还可以寄生在养殖池内的底栖桡足类动物、微藻和轮虫中,并以此为媒介进行传播,感染养殖动物(刘萍等, 2000; 戴俊逸等, 2013),大大增加了预防和控制白斑综合征的难度,极大限制了对虾养殖业的发展。
目前,我国进口凡纳滨对虾种源来自如夏威夷海洋研究所、美国迈阿密对虾改良系统公司(SIS)、正大、普利茂、科拿湾等10余家国外公司(邓涛等, 2013)。此外,我国科研工作者自主选育且经全国水产原种和良种审定委员会审定的凡纳滨对虾新品种有7个,分别是“科海1号”、“中科1号”、“中兴1号”、“桂海1号”、“壬海1号”、“广泰1号”和“海兴农2号”,也分别在国内市场上占有一定份额。但市场上各商业苗种质量参差不齐,如是否携带多种病原、抗WSSV性能及生长状况等也鲜见报道。
以市场上常见的 6个品牌凡纳滨对虾商业苗种(分别简称为海南Z、海南S、广州P、广州Z、黄骅R和东营M)为研究对象,其中的广州P以其抗病性强而著称(吕华当, 2016)。首先,对 WSSV、传染性皮下及造血组织坏死病毒(Infectious hypodermal and hematopoietic necrosis virus, IHHNV)、虾肝肠胞虫(Enterocytozoon hepatopenaei, EHP)、致急性肝胰腺坏死病副溶血弧菌(Acute hepatopancreatic necrosis disease causing-Vibrio parahaemolyticus, VPAHPND)、桃拉综合征病毒(Taura syndrome virus, TSV)、黄头病毒(Yellow head virus, YHV)、传染性肌肉坏死病毒(Infectious myonecrosis virus, IMNV)以及偷死野田村病毒(Covert mortality nodavirus, CMNV) 8种病原进行检测,确定对虾体内是否携带病原及携带病原种类,从而排除各对虾苗种体内原有病原对实验结果的影响。然后,进行 WSSV人工感染实验,评估凡纳滨对虾各商业苗种的抗 WSSV性能。本研究可为凡纳滨对虾抗病品种选育提供基础信息。
1 材料与方法
1.1 实验材料
2016年 8月,本研究在中国水产科学院黄海水产研究所对虾性状测试车间内进行。选购海南Z、海南S、广州P、广州Z、黄骅R、东营M共6个品牌凡纳滨对虾商业苗种的18个家系为实验材料进行病原检测。同一来源苗种的不同家系混养后,随机选若干尾进行WSSV人工感染实验,其平均体重为(0.49±0.29) g。
1.2 病原检测
针对6种凡纳滨对虾商业苗种的18个家系,从每个家系随机取15尾虾混成1个样品。其中,WSSV、IHHNV、TSV、YHV、IMNV和VPAHPND6种病原检测所用引物和检测方法参考《水生动物疾病诊断手册》(世界动物卫生组织, 2017),EHP和CMNV则分别参照Jaroenlak等(2016)、刘珍等(2016)和Zhang等(2014)的方法,引物序列见表1。TSV检测方法为常规PCR,而其他7种病原均利用巢式PCR检测。TSV、YHV、IMNV及CMNV属于RNA病毒,进行病原检测前需反转录成 cDNA,再进行 PCR检测(刘飞等,2014)。
1.3 材料暂养
将6个商业苗种共计717个个体分别置于81 cm×59 cm×51 cm的整理箱中,不断充气,暂养4 d,每个苗种设置3个平行组和1个对照组。每天早、中、晚各投喂 1次人工配合饲料,投喂量为对虾体重的3%~5%,排污换水各1次/天,换水量为30%~50%。养殖用水为砂滤自然海水,盐度为 30±1,实验期间水温维持在(27±2)℃。
1.4 制备毒饵
取感染 WSSV的濒死对虾的肌肉,放入组织匀浆机中打碎;利用实时荧光定量PCR (qRT-PCR)检测肌肉组织中的 WSSV病毒拷贝数,测得病毒载量为1×107copies/ng。参照孟宪红等(2013)的方法制备毒饵,将制好的毒饵放入-80℃冰箱保存待用。
1.5 WSSV感染
本研究采用单尾定量口饲感染 WSSV的方法(冯亚萍等, 2017),感染前2 h不投喂,实验组每尾虾投喂约 10 mg毒饵,观察其完全摄食后放回原整理箱。对照组正常投喂配合饲料,不感染WSSV。感染结束后,每天正常投喂、吸污和换水并观察对虾死亡情况。从出现第1尾因感染WSSV死亡的个体开始,每隔2 h捞取死虾,并分别记录死亡时间和体重,直至第10天实验结束。

表1 病原检测所用引物序列Tab.1 Sequences of PCR primers for pathogen detection
1.6 数据处理
利用Excel 2007和Origin 9.0统计凡纳滨对虾各商业苗种感染 WSSV后的平均存活时间,并做累积死亡率折线图。采用SPSS 19.0软件对平均存活时间做单因素方差分析(One-way ANOVA),对有显著性差异的苗种再作Tukey HSD多重比较分析。
2 结果
2.1 病原检测
本研究对6个对虾商业苗种的8种病原检测结果见表2。各品牌的商业苗种都不携带WSSV、IHHNV、TSV、VPAHPND、YHV、IMNV这 6种病原,但在黄骅R、广州Z和海南Z的所有家系以及广州P的F13、F14、F16家系中均检测出 EHP,东营 M、海南 S、黄骅R和广州Z的部分家系中检测出CMNV。
2.2 存活时间比较
6个品牌凡纳滨对虾商业苗种未感染WSSV的对照组存活率接近100%,感染WSSV的实验组存活时间如表3所示。东营M在感染WSSV后第12小时首先出现死亡个体,广州Z和黄骅R在感染后第22小时开始死亡,而海南Z在感染后第68小时才开始死亡,比东营M整整晚了56 h。比较各商业苗种感染WSSV后的平均存活时间发现,海南Z平均存活时间最长(150.18±25.92) h,其次是广州 P(122.32±43.59) h,平均存活时间最短的是东营M(71.70±23.79) h。6个品牌凡纳滨对虾商业苗种感染 WSSV后存活时间的差异显著性见表4。海南Z显著高于其他5个苗种,广州P显著低于海南Z、但极显著高于其他4个苗种,东营M极显著低于其他5个苗种,广州Z、海南S、黄骅R三者间无显著差异(P>0.05)。
2.3 累积死亡率和存活率比较
统计 6个品牌凡纳滨对虾商业苗种感染 WSSV后不同时间点的累积死亡率(图 1)。东营 M 从感染WSSV后第1天死亡率就急剧上升,并在第4天到达死亡高峰,直至第6天死亡速度开始减缓。海南Z在感染WSSV后前4 d死亡率一直维持在低水平,直至第6天累积死亡率迅速增加,第6~7天为死亡高峰期,到第8天时,累积死亡率基本不变,死亡速度减缓。海南 Z感染 WSSV后的死亡高峰期比东营 M晚了2~3 d。感染 WSSV后的第 5天,海南 Z、海南 S、广州P、广州Z、黄骅R、东营M累积死亡率分别为1.7%、23.9%、11.8%、25.6%、46.0%和 57.7%,第10天(实验结束)的累积死亡率依次为27.5%、31.6%、27.5%、30.8%、61.3%和 60.4%。实验结束后,海南Z、海南S、广州P、广州Z、黄骅R、东营M的存活率分别为 72.5%、68.4%、72.5%、69.2%、38.7%和39.6%、。其中,广州P和海南Z的存活率最高,黄骅R和东营M存活率最低。

表2 凡纳滨对虾病原检测结果Tab.2 Results of pathogen detection of L.vannamei
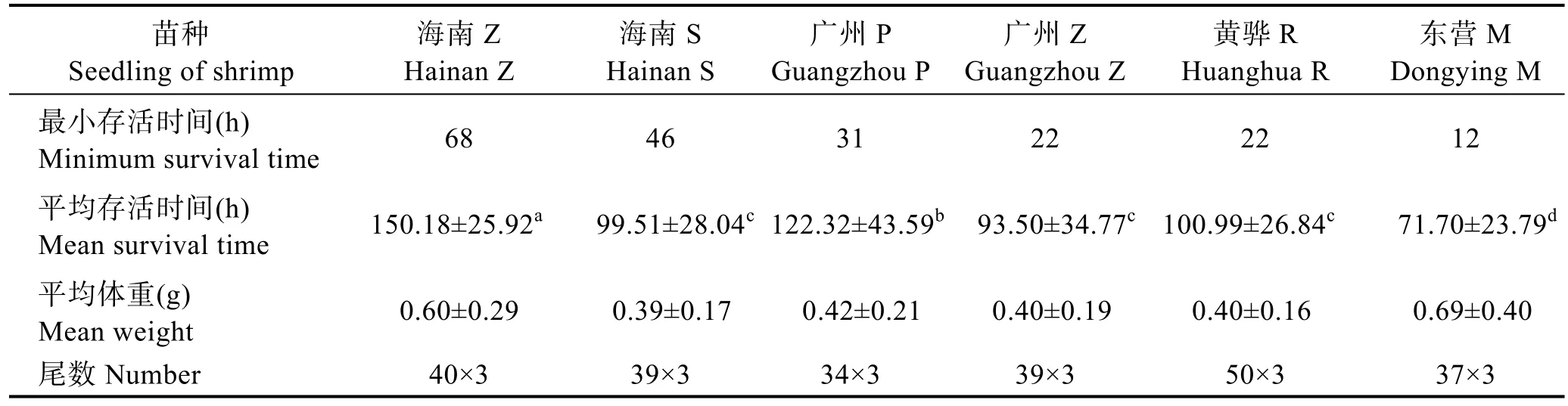
表3 凡纳滨对虾感染WSSV后的存活时间Tab.3 Survival time of L.vannamei after infected by WSSV

表4 凡纳滨对虾存活时间的差异显著性Tab.4 Significant differences on survival time of L.vannamei
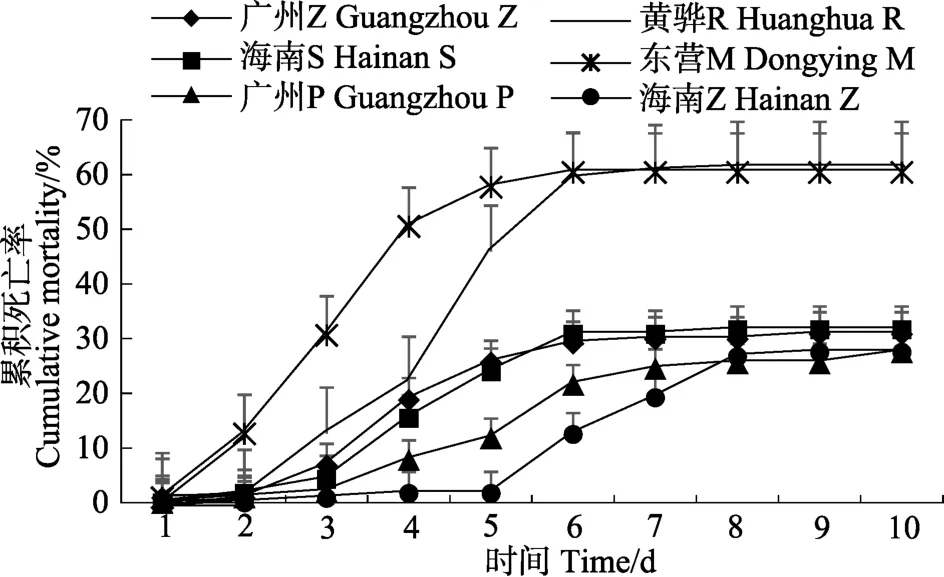
图1 凡纳滨对虾感染WSSV后累积死亡率Fig.1 Cumulative mortality of L.vannamei after infected by WSSV
3 讨论
本研究利用巢式 PCR与普通 PCR相结合的方法,对世界动物卫生组织(OIE)指定的 8种病原进行检测。结果显示,6个商业苗种都不携带WSSV,从而确保了抗 WSSV性状测试结果的可信度。但除东营M外,其他5个来源苗种的EHP均检测为阳性。EHP能够限制对虾的生长速度,导致对虾大小参差不齐,养殖中可通过控制养殖密度和盐度来抵御该病原体(Tanget al, 2015; 刘雅梅等, 2017)。在东营M、黄骅R、广州Z、海南S的部分家系中检测到CMNV。CMNV是一种可引发对虾“偷死病”的病原,其潜伏周期长且发病缓慢。发病前期对虾仅有少量死亡,无明显症状,后期死亡数量随养殖时间缓慢增多,所以,在养殖过程中要时刻注意及时捞取死虾避免污染水质(Pooljunet al, 2016)。虽然,6个苗种的部分家系中检测出EHP和CMNV,但根据对照组的死亡情况推测,它们仍处于潜伏期不会影响 WSSV感染实验结果(Zhanget al, 2017)。目前,由于养殖环境恶化,水体内有害病原种类繁多,对虾发病不再是由单一病原引起,导致疾病防治更加困难(黄志坚等, 2016)。故选育抗病性强的对虾新品种,是防治有害病原蔓延和减少养殖户经济损失的有效办法之一。
自1993年对虾养殖业遭受WSSV暴发性流行侵袭以来,很多科研团队陆续开展了对虾抗 WSSV家系选育工作。孔杰等(2012)以生长速度、抗WSSV能力和养殖存活率为目标性状,选育的中国对虾(Fenneropenaeus chinensis)新品种“黄海2号”已于2009年通过全国水产原良种委员会审定。美国PRIMO公司(2016)培育的高抗病凡纳滨对虾虾苗“普利茂”,于2015年进入中国市场,目前市场反响良好。黄永春等(2013)发现,经过连续多代凡纳滨对虾抗WSSV家系选育,对虾抗病性状逐代增强,这充分证明了家系选育的可行性。王成桂等(2015)综合分析了5个抗WSSV家系的生长、耐盐、耐氨氮、亚硝酸盐以及抗 WSSV性状的差异,并筛选出综合性状比较突出的家系作为以后抗WSSV家系选择的基础群体。本研究则在已有研究成果的基础上,设计实验筛选抗WSSV性能好的凡纳滨对虾商业苗种,为凡纳滨对虾抗病选育提供基础数据。
目前,国内市场上的对虾商业苗种质量良莠不齐,因此,对新苗种进行性能测定与评估具有重要意义。柴展等(2015)评估了8个中国的凡纳滨对虾群体家系间出肉率的差异,魏琳等(2016)比较了在低氧条件下 2个凡纳滨对虾品系的线粒体超微结构,Li等(2015)对凡纳滨对虾各家系的耐低温性状遗传参数进行了评估。本研究通过对6种凡纳滨对虾商业苗种喂食相同剂量(1×107copies/ng)的WSSV,并比较分析其感染 WSSV后的平均存活时间和累积死亡率,来评估 6个凡纳滨对虾商业苗种的抗WSSV性能。结果显示,海南Z和广州P的WSSV抗性在6个苗种中最强。其中,广州P是经过多年抗病选育出来的新苗种,与吕华当(2016)的研究结果是一致的。抗性选择育种是一个复杂的工程,本研究仅对6个商业苗种的某一子代进行选育,只能为进一步开展凡纳滨对虾抗病品种选育提供基础数据。培育抗病新品种还需要进一步深入开展多代选育,并了解其遗传背景及综合评估与生长、繁殖等性状的相关性。
