新辅助腹腔内联合全身化疗对胃癌晚期腹膜转移的疗效探讨
2019-01-16段新星淦锦张开华余雄潘华
段新星 淦锦 张开华 余雄 潘华


【摘要】 目的:探讨新辅助腹腔内联合全身化疗(NIPS)对胃癌腹膜转移患者的临床有效性及安全性。方法:收集2017年1月-2018年1月经本科诊治经病理证实为胃腺癌腹膜转移的69例符合条件的晚期转移性胃癌患者,以2︰1的比例随机到IP组和SOX组。其中IP组46例,SOX组23例,比较两组患者相关临床指标。结果:与SOX组相比,IP组近期疗效显著(P=0.043)。两组患者随访12个月的中位生存时间(9.14个月 vs 7.16个月)比较,差异有统计学意义(P=0.027)。两组毒副反应比较,差异无统计学意义(P>0.05)。结论:新辅助腹腔内联合全身化疗(NIPS)安全、可行,近期疗效显著。
【关键词】 替吉奥胶囊; 紫杉醇; 胃癌; 腹膜转移; 临床疗效; 转化治疗
Efficacy of Neoadjuvant Intraperitoneal Chemotherapy Combined with Systemic Chemotherapy in the Treatment of Advanced Peritoneal Metastasis of Gastric Cancer/DUAN Xinxing,GAN Jin,ZHANG Kaihua,et al.//Medical Innovation of China,2019,16(25):0-025
【Abstract】 Objective:To investigate the clinical efficacy and safety of neoadjuvant intraperitoneal chemotherapy combined with systemic chemotherapy (NIPS) in patients with peritoneal metastasis of gastric cancer.Method:From January 2017 to January 2018, 69 patients with advanced metastatic gastric carcinoma confirmed by pathology were randomly assigned to IP group and SOX group. There were 46 cases in IP group and 23 cases in SOX group,the related clinical indicators of two groups were compared.Result:Compared with the SOX group,the short-term curative effect of the IP group was significant(P=0.043). The median survival time of 12 months was significantly different between the two groups (9.14 months vs 7.16 months) (P=0.027). There was no significant difference in toxicity and side effects between the two groups(P>0.05).Conclusion:Neoadjuvant intraperitoneal chemotherapy combined with systemic chemotherapy (NIPS) is safe, feasible and effective in the near future.
【Key words】 Tigeo capsule; Paclitaxel; Gastric cancer; Peritoneal metastasis; Clinical efficacy;Transformation therapy
First-authors address:The First Peoples Hospital of Jiujiang City in Jiangxi Province,Jiujiang 332000,China
doi:10.3969/j.issn.1674-4985.2019.25.006
胃癌作為一种恶性程度高、侵袭性强的恶性肿瘤,具有较高的发病率及死亡率。位居全球肿瘤发病率第五位,肿瘤死亡率位列第三。相关文献报道指出,国内初诊胃癌患者中,大约14%伴有腹膜转移,在晚期胃癌患者中腹膜转移比例则高达50%~70%[1]。胃癌腹膜转移常易导致肠梗阻、难治性腹水、恶病质等,是晚期胃癌患者死亡的主要原因之一,相关研究表明,20%~40%胃癌患者死亡的直接原因系腹膜转移[2]。有10%~20%的T3或T4期胃癌患者在施行胃癌根治手术时已存在腹膜微小转移灶[3]。
依照国际抗癌联盟(UICC)或日本胃癌研究会(JGCA)有关胃癌临床病理分期方案,胃癌一旦发生腹膜转移则属于远处转移,则失去了手术根治的机会,预后极差,胃癌腹膜转移患者的生活质量差且生存期短,通常中位生存时间(Median survival time,MST)仅3~4个月,即使切除原发肿瘤并给予一般化疗也仅仅能将中位生存期提高至9~10个月[4]。目前,我国胃癌腹膜转移患者的1年总生存率仅为26.5%~44.0%[5-7]。尽管药物化疗已被证实可以有效提高晚期胃癌患者的生存期,但迄今尚无公认的一套标准化疗方案。
近年来,S-1口服联合紫杉醇(paclitaxe,PTX)经静脉(intravenous,IV)和腹腔内(intraperitoneal,IP)给药的新辅助腹腔内联合全身化疗(neoadjuvant intraperitoneal and systemic chemotherapy,NIPS)在胃癌腹膜转移中的疗效引起了广泛关注,P1-3期均有较好的转化治疗效果。相较于传统单纯静脉化疗对胃癌腹膜转移患者能进一步提高疾病控制率,有效改善生存质量,且不增加额外的药物毒性。本次研究纳入2017年
1月-2018年1月晚期胃癌腹膜转移患者69例进行对照研究,旨在探讨NIPS对胃癌腹膜转移患者的临床有效性及安全性,现报道如下。
1 资料与方法
1.1 一般资料 选取2017年1月-2018年1月经本科诊治且病理证实为胃腺癌腹膜转移的69例符合条件的晚期转移性胃癌患者,以2︰1的比例随机到IP组和SOX组。其中IP组46例,SOX组23例。(1)纳入标准:①经胃镜活检或组织病理学检查明确诊断为胃腺癌且无原发灶或转移灶切除史;②腹腔内至少存在1个可测量病灶;③心、肝、肾功能均大致正常,无重大基础疾病;④无或未进行短期(2个月内)化疗;⑤实验室检查提示可耐受化疗。(2)排除标准:①对铂类、紫杉类药物过敏;②近期(2个月内)使用过化疗药物或其他抗肿瘤药物;③肿瘤过大(腹腔内肿瘤最大直径≥10 cm,肝转移占肝总体积>50%);只有体腔积液(胸腔积液或腹腔积液)而无可测量的实体病灶;④伴有严重并发症(如消化道出血、穿孔等)和其他严重疾病或状况(如严重的心律失常、肝、肺、肾功能障碍和感染等);⑤已存在脑或软脑膜转移。本研究经伦理委员会批准并签署化疗知情同意书。
1.2 化疗方案 化疗药物包括:注射用紫杉醇酯质体30 mg/支(南京绿叶制药有限公司,国药准字H20030357)、替吉奥胶囊20 mg/粒(山东新时代药业有限公司,国药准字H20100150)、注射用奥沙利铂0.1 g/支[齐鲁制药(海南)有限公司,国药准字H20000686]。单药口服S-1并静脉于腹腔给予紫杉醇的试验组,以下简称IP组(第1天对患者应用紫杉醇20 mg/m2,第1~8天对患者应用紫杉醇
50 mg/m2,第1~14天对患者应用紫杉醇80 mg/m2,3周为1个周期)。单药口服S-1并静脉给予奥沙利铂的对照组,以下简称SOX组(第1天对患者应用奥沙利铂130 mg/m2,第1~14天对患者应用奥沙利铂80 mg/m2,3周为1个周期)。IP组患者常规行腹腔穿刺术,腹腔灌注化疗后嘱患者翻身30 min/次,共计4次,常规予以化疗药物的水化及利尿。每周复查血常规1~2次,治疗前均常规给予5-羟色胺3受体拮抗剂止吐,预防消化系统反应,治疗中出现骨髓抑制時予以细胞集落刺激因子,必要时予以输注红细胞、血小板治疗。
1.3 转化胃癌切除适应证及手术方式 转化胃癌切除手术适应证:经NIPS转化治疗后胃原发灶达到切除标准;腹膜转移灶消失或明显缩小;未发生除腹膜外的其他远处转移灶;患者临床症状明显好转。手术方式:常规选择传统开腹胃癌根治手术,胃切除范围及消化道重建方式经由术中实际情况决定。偶见合并脾脏、胰体尾等联合脏器切除。常规实施根治性胃癌R0切除,D2淋巴结清扫,姑息性胃癌切除则据术中情况决定。
1.4 观察指标及评价标准 入组患者于治疗2个周期后进行评估,并于4周后进行疗效确认。疗效依照WHO制定的实体瘤效标准(REIST)分为完全缓解(CR):所有病灶完全消失;部分缓解(PR):病灶最大直径减少>30%;病情稳定(SD):病灶有所减少,但未达到部分缓解状态;病情进展(PD):有新病灶出现或病灶增加>20%。总有效=CR+PR+SD。随访时间为治疗开始至随访截止日期、患者失访或死亡的时间。化疗前及化疗2个周期后随访CT,测量病灶大小变化情况,评价近期疗效。本研究随访截至2018年6月31日。常见的毒副反应包括:胃肠道反应、周围神经毒性反应、骨髓抑制、过敏反应等。毒副反应按反应按照美国国立癌症研究院通用毒性标准(National Cancer Institute Common Toxicity Criteria,NCI-CTC)进行评价,分为0~Ⅳ级。胃癌腹膜转移分级采用UICC第7版标准:(1)P0,胃浆膜、大网膜、小网膜、肠系膜、腹腔脏器浆膜以及腹壁、腹膜无播种性转移;
(2)P1,近胃癌腹膜(横结肠以上,包括大网膜)有播种,而远处腹膜(横结肠以下腹膜和膈面)无转移;(3)P2,远处腹膜少数转移(仅卵巢转移也记作P2),可计数;(4)P3,远处腹膜多数转移,无法计数[8-9]。腹水分级:少量腹水为<0.5 L,
中等量腹水为0.5~2.0 L,大量腹水为>2.0 L。Surgabakers腹膜转移指数(PCI):将腹部分为13个区,分别行各区域内的病灶体积(lesion size,LS)评分,LS-0表示未发现种植病灶,LS-1表示种植病灶<0.5 cm,LS-2表示0.5~5.0 cm,LS-3表示>5.0 cm,PCI值为各区域LS分值累计所得,范围为0~39分[10]。
1.5 统计学处理 使用SPSS 19.0统计学软件进行分析,计量资料采用(x±s)表示,比较采用t检验,计数资料采用率(%)表示,比较采用字2检验或确切概率法,总体生存率及中位TIP采用Kaplan-meier分析,并绘制生存曲线,不良反应采用Wilcoxon(Mann-Whitney)秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组基线资料比较 两组患者一般资料比较,差异均无统计学意义(P>0.05),具有可比性。见表1。
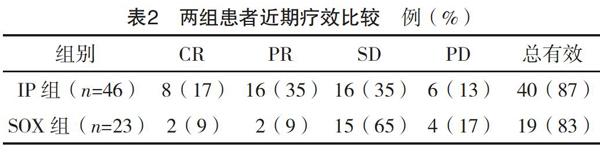
2.2 两组患者近期疗效比较 所有患者均成功完成4个周期的化疗,无患者因腹腔穿刺失败或穿刺引发相关并发症而退出研究,4个周期化疗结束后均可评估近期疗效。两组近期疗效比较差异有统计学意义(字2=8.161,P=0.043)。见表2。
2.3 转化胃癌根治 46例胃癌腹膜转移患者经NIPS转化治疗后,27例接受转化胃癌D2根治切除手术,其中11例达到R0切除,其余16例为R2切除。所有27例手术患者中,2例胃癌浸润脾门,遂行全胃联合脾脏切除手术,1例胃癌浸润胰尾,行全胃联合脾脏及胰体尾切除术,2例胃癌卵巢转移行胃癌根治+双侧附件切除术。未经NIPS转化治疗的SOX组患者均未进行转化胃癌手术治疗。
2.4 生存情况 本研究采用门诊及电话方式对患者予以随访,随访时间为12个月,其中IP组失访患者5例,SOX组失访患者4例,截止最后随访时间,IP组与SOX组中位生存时间分别为9.14[95%CI(8.23,10.06)]个月和7.16[95%CI(5.63,8.69)]个月,差异有统计学意义(字2=4.89,P=0.027)。
见图1。
图1 两组患者的中位生存时间比较
2.5 两组不良反应评价比较 结果显示多数为NCI-CTC Ⅰ~Ⅱ级毒性,经积极对症处理后均好转,且所有毒副反应均在治疗结束后很快消失,尚未发现无法耐受的毒副反应,未出现治疗相关性死亡。所有化疗患者中只有一例发生了化疗相关性肠梗阻,其他均未引起化学性腹膜炎或肠粘连引起的肠梗阻。对治疗后的毒副反应进行统计分析,结果显示IP组毒副反应发生率与SOX组比较,差异均无统计学意义(P>0.05)。见表3。
3 讨论
紫杉醇(PTX)作为一种抗实体肿瘤的化疗药物,通过抑制微血管蛋白聚集从而保持微管蛋白的稳定,有效抑制了肿瘤细胞的分裂,从而达到抑制肿瘤细胞增殖、组织肿瘤细胞扩散的作用[11]。紫杉醇作为高分子量、非水溶性化合物(分子量853.9),其不易被血管吸收的特征使其更为适合用于腹腔灌注化疗。此外,由于化疗药物浓度往往与肿瘤细胞的杀灭程度呈正相关趋势,研究结果证实,紫杉醇腹腔灌注给药时浓度峰值可达100 mg/L,相比静脉给药时血浆药物浓度高1 178倍[12]。日本学者Ishigami等[13]一项Ⅱ期临床实验结果证实,应用PTX腹腔和静脉双途径用药联合S-1治疗晚期胃癌腹腔转移患者的1年生存率为78%,RR为56%,且毒副作用可以耐受。
NIPS的主要优点在于通过术前全身性用药,可有效抑制原发肿瘤灶与淋巴结转移灶的增殖,达到降期效果。同时利用了腹膜-血浆屏障(peritonea-plasma barrier,PPB)现象,进行腹腔内化疗(intrapefitoneal chemotherapy,IPC),使得腹膜转移癌灶能直接受到较高浓度抗癌药物的作用,且由于藥物分子被吸收入血过程缓慢,在腹腔内作用持续时间明显延长,有利于减少腹膜转移灶,增加手术切除率。Kitayama等[14]在PHOEXIX Ⅱ期研究中得出与笔者类似的结果,他们对64例胃癌腹膜转移患者予以口服S-1并静脉于腹腔内给予PTX的NIPS治疗5个疗程后,其中有34例经NIPS治疗后因无其他远处转移,复查腹腔内游离癌细胞(free cancer cells,FCCs)转阴,胃癌原发灶与腹膜转移灶缩小或得到有效控制而分别施行了胃癌D1或D2切除术。2016年一项由日本发布的PHOENIX Ⅲ期临床研究也期望在进一步验证IP组NIPS方案的可行性与优越性方面取得更为显著的突破。另有Yamaguchi等[15]报道的一项临床注册研究﹙UMIN000002850)结果,对35例腹膜转移的晚期胃癌患者同样采取上述NIPS疗法,平均治疗11个疗程,腹水消失或明显减少率为68%,腹腔内FCC转阴性率达到97%,MST为17.6月,21例(60%)因肿瘤灶得到有效控制而施行全胃或次全胃切除术;全组1年和2年总生存率(overall survival rate,OS)分别达到77.1%和44.8%;其中腹膜癌症指数(peritoneal cancer index,PCI)低于15的患者预后较之大于15者更好,再次说明采用PTX联合S-1的NIPS能使胃癌腹膜转移患者有效延长生存期,这也与笔者结果类似。近年来,大量研究结果证实,存在腹膜转移的胃癌患者往往已不再具备直接手术指征,通常在积极予以NIPS转化治疗后可以争取到更为合适的手术机会甚至达到R0切除[16-18]。
NIPS治疗主要适用于晚期胃癌腹膜转移患者的转化治疗,相关数据表明,PCI≤15的患者转化治疗效果优于传统化疗方案[19]。但对于存在重大基础疾病或肝、肾功能损害严重患者,往往无法接受NIPS治疗。此外,PTX腹腔灌注化疗的腹腔毒性累计是否会进一步加重毒副反应有待进一步研究[20-22]。
综上所述,对于晚期胃癌腹膜转移的患者实施新辅助腹腔内联合全身化疗(NIPS)安全可行,治疗效果显著,能够显著抑制癌细胞的增长且不带来额外的药物毒性,有效提高了晚期胃癌患者的生活质量,延长了其生存时间,一部分患者更是可以获得转化手术治疗的机会,甚至达到R0切除,值得临床推广。
参考文献
[1]杨晓琳,殷先利,罗英,等.TS方案联合紫杉醇腹腔灌注化疗对胃癌合并腹膜转移的疗效观察[J].中国误诊学杂志,2017,8(4):1-4.
[2]朱正纲.诊治胃癌腹膜转移的有效方法及其临床意义[J].外科理论与实践,2015,20(1):8-12.
[3]严超,燕敏,朱正纲.胃癌腹膜转移的转化治疗策略:新辅助腹腔内联合全身化疗[J].外科理论与实践,2017,22(1):28-31.
[4]朱正纲.胃癌腹膜转移转化性治疗的临床意义[J].中国肿瘤外科杂志,2016,8(4):213-216.
[5]严超,石红鹏,刘瑩,等.胃癌腹膜转移的新辅助腹腔内联合全身化疗:初步研究[J].外科理论与实践,2017,22(1):32-39.
[6] Li C,Yan M,Chen J,et al.Surgical resection with hyperthermic intraperitoneal chemotherapy for gastric cancer patients with peritoneal dissemination[J].J Surg Oncol,2010,102(5):361-365.
[7]罗登,黄华,路明亮,等.胃癌腹膜种植转移的危险因素及预后分析[J].中国普通外科杂志,2012,21(10):1191-1195.
[8] Kajitani T.The general rules for the gastric cancer study in surgery and pathology[J].PartⅠ Clinical classification [J].Jpn J Surg,1981,11(2):127-139.
[9] Washington K.7th edition of the AJCC cancer staging manual:stomach[J].Ann Surg Oncol,2010,17(12):3077-3079.
[10] Jacquet P,Sugarbaker P H.Clinical research methodologiesin diagnosis and staging of patients with peritonealcarcinomatosis[J].Cancer Treat Res,1996,82(22):359-374.
[11]高鑫艳.替吉奥胶囊与紫杉醇治疗术后复发或转移性胃癌的效果探讨[J].中外医学研究,2017,15(35):27-28.
[12]黄万中,蒋华,刘燕文,等.紫杉醇腹腔灌注化疗联合LV/5-Fu/OXA静脉用药治疗晚期胃癌的疗效及安全性[J].实用医学杂志2010,26(17):3212-3214.
[13] Ishigami H,Kitayama J,Kaisaki S,et a.PhaseⅡstudy ofweekly intravenous and intraperitoneal paclitaxel combined with S-1 for advanced gastric cancer with peritoneal metastasis[J].Ann Oncol,2010,21(1):67-70.
[14] Kitayama J,Ishigami H,Yamaguchi H,et al.Salvage gastreetomy after intravenous and intraperitoneal paclitaxel (PTX)administration with oral S-1 for peritoneal dissemination of advanced gastric cancer with malignant ascites[J].Ann Surg Oncol,2014,21(2):539-546.
[15] Yamaguchi H,Kitayama J,Ishigami H,et al. A phase 2 trial of intravenous and intraperitoneal paclitaxel combined with S-1 for treatment of gastric cancer with macroscopic peritoneal metastasis[J].Cancer,2013,15(4):3354-3358.
[16] Li F,Shi J,Xu Z, et al.S100A4-MYH9 Axis Promote Migration and Invasion of Gastric Cancer Cells by Inducing TGF-β-Mediated Epithelial-Mesenchymal Transition[J].J Cancer,2018,9(21):3839-3849.
[17] Kim D W,Park D G,Song S,et al.Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy as Treatment Options for Peritoneal Metastasis of Advanced Gastric Cancer[J].J Gastric Cancer,2018,18(3):296-304.
[20] Shimizu D,Kanda M,Kodera Y.Emerging evidence of the molecular landscape specific for hematogenous metastasis from gastric cancer[J].World J Gastrointest Oncol,2018,10(6):124-136.
[21] Dahdaleh F S,Turaga K K.Evolving Treatment Strategies and Outcomes in Advanced Gastric Cancer with Peritoneal Metastasis[J].Surg Oncol Clin N Am,2018,27(3):519-537.
[22] Yoshioka R, Nagase H, Noguchi K, et al.A Case of Unresectable Advanced Gastric Neuroendocrine Cell Carcinoma Treated with Nivolumab[J].Gan To Kagaku Ryoho,2018,45(10):1530-1532.
(收稿日期:2019-01-13) (本文編辑:周亚杰)
