艳山姜挥发油对TGF-β1诱导内皮细胞氧化应激损伤的保护作用研究
2019-01-16张彦燕付凌云李佳川徐旖旎沈祥春
张彦燕,赵 爽,付凌云,何 丽,冉 新,李佳川,徐旖旎,沈祥春
(1.贵州医科大学临床药学教研室,贵州 贵阳 550025;2.贵州医科大学天然药物资源优效利用重点实验室,贵州 贵阳 550025;3.西南民族大学药学院,四川 成都 610041)
研究表明,氧自由基参与多种心血管疾病的发生发展过程,血管内皮细胞氧化应激损伤为动脉粥样硬化(Atherosclerosis,AS)的重要病理生理过程[1-2],动脉粥样硬化斑块形成学说也与之有着密切的联系[3].因此,以氧化应激损伤为切入点,寻找能够调控内皮细胞功能稳态的民族药物,对特色民族药物防治动脉粥样硬化的临床治疗具有积极意义[4].
艳山姜(AlpiniazerumbetPers.Burttet Smith)是姜科山姜属植物的干燥成熟果实[5],艳山姜挥发油(Essential Oil from FructusAlpiniaZerumbet,EOFAZ) 具有抗炎,镇痛,抗氧化,抗动脉粥样硬化等药理作用[6].前期研究表明,艳山姜挥发油可通过抑制核因子NF-κB的磷酸化入核,而抑制脂多糖(Lipopolysaccharide,LPS)诱导的血管内皮细胞炎性损伤[7]及抑制自发性高血压大鼠胸主动脉血管纤维化重塑,研究表明其为具有心血管活性的民族药物.但艳山姜挥发油是否对TGF-β1诱导的内皮细胞氧化应激损伤具有保护作用,目前未见相关报道.因此,本研究采用TGF-β1诱导建立内皮细胞氧化应激损伤模型,分析其对核转录因子E2相关因子2(Nrf2)蛋白表达的影响,以期分析艳山姜挥发油对血管内皮细胞的保护作用,为艳山姜防治心血管疾病的临床应用提供一定的实验基础.
1 材料与方法
1.1 试验药物
艳山姜药材果实采自贵州省贞丰县连环乡,经贵州医科大学生药学教研室龙庆德副教授鉴定为姜科山姜属植物的干燥成熟果实,水蒸气蒸馏法提取挥发油,收得率为1.3%.
1.2 细胞株
人脐静脉内皮细胞(Human Umbilical Vein Endothelial Cells,HUVECs)购于美国 Sciencell公司.
1.3 试剂
内皮细胞培养基购于美国Sciencell公司(批号:1001),转化生长因子-β1(TGF-β1)购于 Princeton business park公司(批号:0716209-1),胰蛋白酶购于GIBCO公司,四氮唑盐(MTT)购于Solarbio公司(批号:804W059),BCA蛋白定量试剂盒(批号:P0010)、活性氧检测试剂盒均购于碧云天生物技术研究所(批号:S0033),Immobilon western化学发光试剂购于Millpore公司(批号:1707901),Nrf2抗体购于 Santa Cruz公司(批号:16396-I-AP),抗兔二抗和抗小鼠二抗的抗体购于武汉博士生物技术有限公司.
1.4 仪器
XDS-1B倒置显微镜,日本尼康公司,ELX800型酶联免疫检测仪,美国GE公司,CFX型凝胶成像系统仪,美国BIO-RAD公司,5810R型冷冻离心机,德国Eppendorf公司.
1.5 方法
1.5.1 细胞培养
按常规方法复苏HUVECs,加入10%血清的完全培养基置于37℃,湿度饱和,含5%CO2的培养箱中培养,根据细胞生长密度进行换液和传代培养.取对数生长期的细胞约2×105个/mL接种到培养瓶或培养板中,待其生长状态达到实验要求后进行分组给药.
1.5.2 分组给药
实验分为4个组:(1)正常对照组:正常细胞培养(Control,10%ECM);(2) 模型组(Model,TGF-β1,10 ng/mL);(3)EOFAZ 高剂量组(EOFAZ-H,4 μg/L);(4)EOFAZ 低剂量组(EOFAZ-L,1 μg/L).预先加入艳山姜挥发油干预作用2 h,再加入TGF-β1共同孵育6 h,建立内皮细胞氧化应激损伤模型.
1.5.3 细胞存活率实验(MTT)
采用MTT比色法测定细胞存活率.取对数生长期细胞制备成细胞悬液,约1×105个/mL接种于96孔板内,待细胞贴壁生长至75% ~85%的覆盖密度,按1.5.2项下方法给药处理.到达观测终点时每孔加入20 μL 5 mg/mL MTT,继续置于培养箱内孵育,4 h后吸出上清液,每孔加入150 μL DMSO溶液,摇床震荡15 min,在490 nm波长处测定光密度值(OD).每组设6个平行复孔,实验重复3次.计算公式:细胞存活率(%)=给药组OD值/正常组OD值×100%.
1.5.4 ROS含量检测
细胞传代处理后,将细胞悬液接种于6孔培养板中,当细胞生长密度达到70% ~80%时,按1.5.2项下方法分组处理之后,置于培养箱内孵育6 h,用PBS清洗之后,向6孔培养板内加入10 μΜ的DCFH-DA,继续置于培养箱内培养30 min,用无血清ECM清洗3-4次,于倒置荧光显微镜下观察并拍照.
1.5.5 细胞划痕实验
细胞生长至传代密度后,进行传代和铺板操作.消化离心细胞后,加入培养基重悬,将悬液约1×104个/孔接种于24孔培养板中,按上述方法分组给药处理.观察细胞密度达80%左右即可进行划痕实验操作.用20μL的枪头在细胞生长中央区域划线,之后用PBS清洗脱落的细胞,加入无血清培养基置于培养箱中继续培养.于划痕后0 h和6 h两个时间点拍照,随机选择4-6个标记点,进行数据测定并计算迁移率.计算公式如下:迁移率=(0 h划痕距离平均值-6 h划痕距离平均值)/0 h划痕距离平均值.
1.5.6 Western blotting检测
采用蛋白免疫印迹法检测相关蛋白的表达.将不同给药组细胞用预冷的PBS清洗三次,加入新鲜配置的细胞裂解液(PMSF:RIPA=1:99),于摇床上裂解(冰浴)20 min.裂解后将细胞刮取下来收集到1.5 mL EP管内,冷冻离心20 min后采用BCA法进行蛋白定量.凝胶制备好后,每个泳道内加入20 μL分装好的蛋白样品,于90V电压下进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),待跑至下层胶时调节电压至120V.电泳结束后在恒流300 mA条件下,湿转1.5 h至偏氟乙烯膜(PVDF膜),采用5%脱脂牛奶(PBS/TBST配制)于摇床上室温封闭2 h.洗涤液清洗三遍后加入一抗(1:1000稀释)于4℃孵育过夜,第二天拿出洗涤后加入辣根过氧化物酶(HRP)偶联的二抗(1:7000),增强型化学发光(ECL)发光液暗室显影.应用Image Pro Plus 6.0软件分析灰度值,以Nrf2/β-actin的比值分析蛋白相对表达量,实验重复3次.
1.5.7 统计方法
实验数据均采用SPSS 17.0软件包进行统计学分析,数据以±s表示,组间比较采用多个样本均数比较的单因素方法分析(one-way ANOVA).以P<0.05表示差异具有统计学意义.
2 结果
2.1 MTT法分析细胞存活率
MTT法是常用的分析细胞损伤程度的指标之一.与正常对照组比较,TGF-β1作用6 h后,模型组细胞存活率显著降低(P<0.01),预先给予EOFAZ后,EOFAZ高低剂量组细胞存活率明显升高(P<0.05),结果见表1.
表1 MTT法分析艳山姜挥发油的保护作用(±s,n=6)Table 1 The protective effect of EOFAZ through MTT(±s,n=6)
与正常对照组比较,**P<0.01;与 TGF-β1模型组比较,*P<0.05,**P <0.01
组别 给药浓度(μg/L)OD(490nm)存活率(%)Control 0.598±0.55 100 TGF-β1 0.396 ±0.50** 66**EOFAZ-H 4 0.527±0.034* 88*EOFAZ-L 1 0.497±0.033 83*
2.2 活性氧试剂盒检测ROS的表达情况
与正常对照组相比,模型组细胞内ROS呈高表达水平,EOFAZ高低剂量干预作用后可不同程度降低ROS水平,结果见图1.

图1 HUVECs细胞中ROS水平的变化(200×)Fig 1 Changes of ROS level in HUVECs
2.3 划痕实验分析细胞迁移能力
采用划痕实验判断细胞的生长迁移能力.实验结果表明,正常对照组、模型组、EOFAZ-H组、EOFAZ-L组的迁移率分别为:(21.7±15.3)%、(71.9±1.2)%、(47.7±2.1)%、(53.5±5.8)%,实验结果表明 TGF-β1作用后细胞迁移能力显著增加(P<0.01),EOFAZ干预保护作用后,EOFAZ高、低剂量组可不同程度降低细胞迁移能力(P<0.01).见表2.
表2 划痕实验观察EOFAZ对TGF-β1诱导HUVECs的迁移能力的影响(±s,n=4)Table 2 The effect of EOFAZ on the migration of HUVECs induced by TGF-β1 using Scratch test(±s,n=4)

表2 划痕实验观察EOFAZ对TGF-β1诱导HUVECs的迁移能力的影响(±s,n=4)Table 2 The effect of EOFAZ on the migration of HUVECs induced by TGF-β1 using Scratch test(±s,n=4)
与正常对照组比较,**P<0.01;与TGF-β1模型组比较,**P<0.01
Control 0.977±0.021 0.767±0.125 21.7±15.3 1.10±0.082 0.307±0.009 71.9±1.2**EOFAZ-H 4 1.003±0.078 0.523±0.017 47.7±2.1**EOFAZ-L 1 1.003±0.078 0.467±0.047 53.5±5.8**TGF-β1
2.4 EOFAZ对内皮细胞Nrf2蛋白表达的影响
采用Western Blot法检测调节抗氧化应激反应的重要转录因子Nrf2蛋白的表达情况.结果显示,与正常对照组比较,模型组内皮细胞Nrf2蛋白表达显著下调(P<0.05),EOFAZ高剂量组与模型组比较,Nrf2蛋白表达水平显著上调(P<0.01),低剂量组无明显差异.如图2所示.
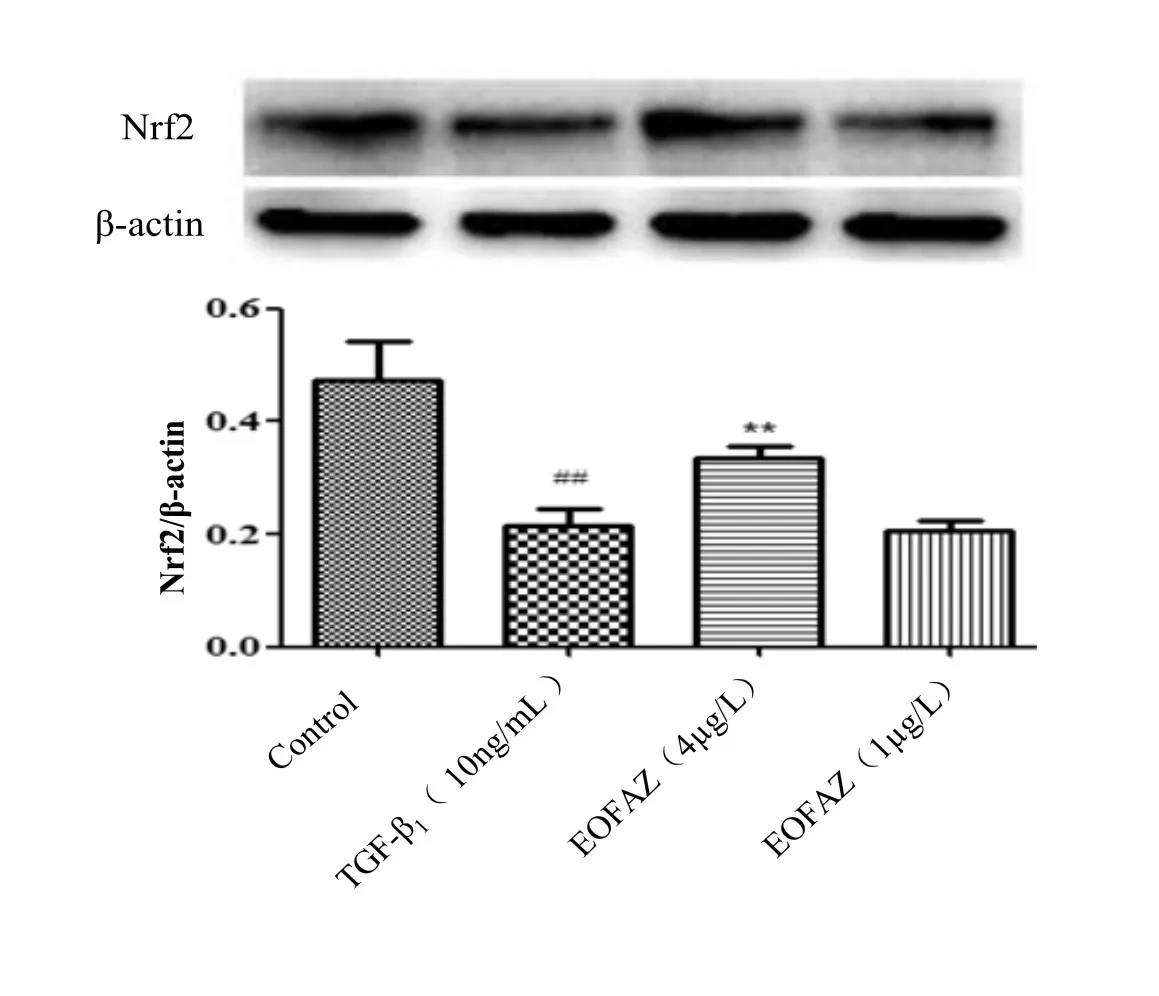
图2 用Western Blot检测EOFAZ对TGF-β1诱导HUVECs中Nrf2蛋白表达情况的影响Fig.2 The effect of EOFAZ on the expression of Nrf2 in TGF-β1-induced HUVECs by Western blot
3 讨论与结论
氧化应激被认为是引起炎症、衰老和一系列慢性疾病的主要因素之一,当机体受到各种内外环境因素刺激时,体内产生大量高活性分子活性氧和活性氮,从而造成组织损伤.研究表明,活性氧在血管壁的富集可引起血管收缩,破坏血管结构和功能,其中血小板的大量聚集可引起内皮细胞黏附和血栓形成,从而触发动脉粥样硬化斑块的形成[8].已有大量文献报道,血管内皮细胞氧化应激损伤为动脉粥样硬化的关键病理生理过程,其可造成动脉内膜脂质粥样斑块的形成[9].TGF-β来自于转化生长因子超家族,可与细胞表面的 II型受体(TβRII)结合后活化 I型受体(TβRI),因其功能多样性可激活下游系列信号通路调节细胞的增殖、分化及胞外基质合成的生物效应,并参与动脉粥样硬化的病理生理过程,其亚型之一TGF-β1是组织纤维化发生异常最重要的引发因子.核转录因子E2相关因子2(Nuclear factor-erythroid 2 related factor 2,Nrf2)是协调抗氧化应激反应重要的转录因子,其最主要的功能是促进一系列抗氧化相关基因的表达,从而激活细胞的抗氧化反应,减轻细胞氧化应激的损伤[10].当ROS、亲电子物质或其他有害物质引起氧化应激时,Nrf2的泛素化与Keap1解偶联,游离的Nrf2与抗氧化反应元件(ARE)结合,激活Ⅱ抗氧化酶基因和解毒酶相关基因的表达,从而提高抗氧化应激的能力[11-12].因此,以抗氧化应激为切入点,探讨TGF-β1诱导内皮细胞损伤的机制,在防治动脉粥样硬化和其他心血管疾病的过程中意义突出.
艳山姜挥发油具有抗炎、抗氧化、抗动脉粥样硬化等药理作用,因此本研究观察EOFAZ对TGF-β1诱导的HUVECs氧化应激损伤的保护作用,并进一步分析其作用机制.研究结果表明10 ng/mL TGF-β1作用于人脐静脉内皮细胞6 h可成功复制内皮细胞氧化应激损伤模型,细胞形态由正常的鹅卵石状变为长梭形,细胞间隙变大,存活率显著降低,ROS水平明显升高,内皮细胞迁移能力增强.而经艳山姜挥发油高低剂量干预处理细胞后,可明显提高HUVECs的存活率,降低ROS的表达水平及内皮细胞迁移能力.蛋白免疫印迹结果表明,TGF-β1能够诱导Nrf2蛋白的表达下降,而EOFAZ高剂量组可上调Nrf2蛋白的表达水平.本研究报道了艳山姜挥发油对TGF-β1诱导的HUVECs氧化应激损伤具有保护作用,其作用机制与EOFAZ调控Nrf2信号有关,其相关信号的精密调节机制还有待进一步深入研究.
