牦牛和不育犏牛睾丸中LGR4和ZNF281基因mRNA水平的分析
2019-01-16金素钰雷杰雯郑玉才
于 淼,金素钰,黄 林,雷杰雯,郑玉才
(西南民族大学生命科学与技术学院,四川 成都 610041)
富含亮氨酸重复序列的G蛋白偶联受体4(LGR4)具有广泛的生物学功能,包括成骨、能量代谢等[1-2],近年来被认为参与Wnt通路的信号转导[3-4].LGR4和促性腺激素受体同源,与动物生殖道发育和生殖机能相关[5-8].Qian等(2013)还报道,LGR4对精子发生是必需的[9].鉴于Wnt通路在动物发育中的重要性,LGR4在精子发生、睾丸发育中可能有重要功能.
锌指蛋白281(ZNF281)是一种锌指转录因子,也是胚胎干细胞的核心转录因子.它与Nanog等转录因子作用[10],参与细胞的多功能性、干细胞和上皮间质转化(EMT)等调控以及DNA损伤导致的细胞应激[11-12].
牦牛(Bos grunniens)是青藏高原及毗邻高寒地区特有的牛种,它与普通牛的杂交后代(犏牛)生产性能显著提高,并能较好地适应高原低氧环境,但表现为回交三代内雄性不育,无法产生正常精子[13].因此,精子发生障碍被公认为与犏牛的雄性不育有直接关系.有关犏牛雄性不育的分子机制已有很多研究,犏牛睾丸中很多基因表达下调,包括在减数分裂过程中起重要作用的SYCP3、Dmc1、Dmart7等基因mRNA水平均极显著低于牦牛[13-15],但导致精子发生障碍的因果关系至今尚不明确.我们前期研究发现,犏牛睾丸中miRNA-449水平显著低于牦牛,而其预测靶基因中包括LGR4和ZNF281等基因(李彩霞等,待发表资料).因此,本研究采用定量PCR方法比较牦牛和犏牛睾丸LGR4和ZNF281的mRNA水平,以探索其在犏牛雄性不育中可能发挥的作用.
1 材料与方法
1.1 组织采集与处理
实验成年牦牛(n=10)和犏牛(n=7)的睾丸均采自成都市青白江某屠宰场.于10月份在牦牛和犏牛屠宰后立即采集睾丸,迅速切割成小块后置于含RNA保护液(Qiagen)的EP管中,冰上带回实验室,-80℃保存备用.
1.2 睾丸总RNA提取和反转录
称取睾丸约100 mg于研钵中,用液氮充分研磨,用RNAiso Reagent试剂(TaKaRa公司)根据说明书提取总RNA.利用核酸蛋白检测仪和琼脂糖凝胶电泳检测RNA的浓度和完整性.取1 μg总RNA按照RNA Kit(AMV)Ver.3.0(TaKaRa公司)说明书反转录成cDNA,保存于-20℃.
1.3 基因的定量PCR检测
根据NCBI中普通牛18S rRNA、GAPDH、LGR4和ZNF281基因的mRNA序列,利用Primer Premier 5.0软件分别设计两个目的基因和双内参18S rRNA、GAPDH基因的定量PCR引物(表1),并由上海生工生物工程技术服务有限公司合成.

表1 本研究PCR引物信息Table 1 Sequences of PCR primers in the present study
定量PCR在Bio-Rad iQ5荧光定量PCR仪上完成,反应体系(25 μL):SYBRⒸGreen PCR Kit(QIAGEN 公司生产)12.5 μL,上、下游引物各 1 μL,cDNA 1 μL,超纯水9.5 μL.反应条件:95 ℃ 5 min;95 ℃ 15 s,退火(18S rRNA和GAPDH均为60℃,LGR4为64℃,ZNF281为65℃)20 s,72℃ 15 s,共40个循环.
以反转录获得的牦牛睾丸cDNA为模板,用4对定量PCR引物分别进行常规PCR扩增,产物经10倍稀释(10-4~10-8)的5个梯度作为模板,进行反应体系和条件优化,制作标准曲线,并获得融解曲线、线性范围等参数.进一步利用建立的定量PCR方法,对牦牛和犏牛睾丸样品中目的基因和2个内参基因进行定量.样品均做两管平行,并设无模板对照.
1.4 数据统计分析
实验数据用平均值 ±标准误表示.采用 SPSS 18.0软件,根据两个内参基因18S rRNA和GAPDH表达水平的几何平均数,对LGR4和ZNF281 mRNA表达水平分别进行矫正,并以2-ΔΔCt法对数据进行处理[16].
2 结果
2.1 总RNA提取和定量PCR方法建立
实验提取的睾丸总 RNA的 A260/A280为1.8~2.0,琼脂糖凝胶电泳显示清晰的条带,且28S rRNA条带亮度是18S rRNA的约2倍,质量符合定量PCR分析的要求.常规PCR扩增显示,LGR4和ZNF281基因的PCR产物均为特异的单一条带,与预期分子量大小一致.
建立的定量PCR方法中,4个基因在较宽范围内均有很好的线性关系,其中LGR4和ZNF281基因的标准曲线的相关系数分别为0.998和0.994,扩增效率分别为96.1%和104%,融解曲线均只有1个峰(图1),表明扩增特异性强,符合定量PCR分析要求.
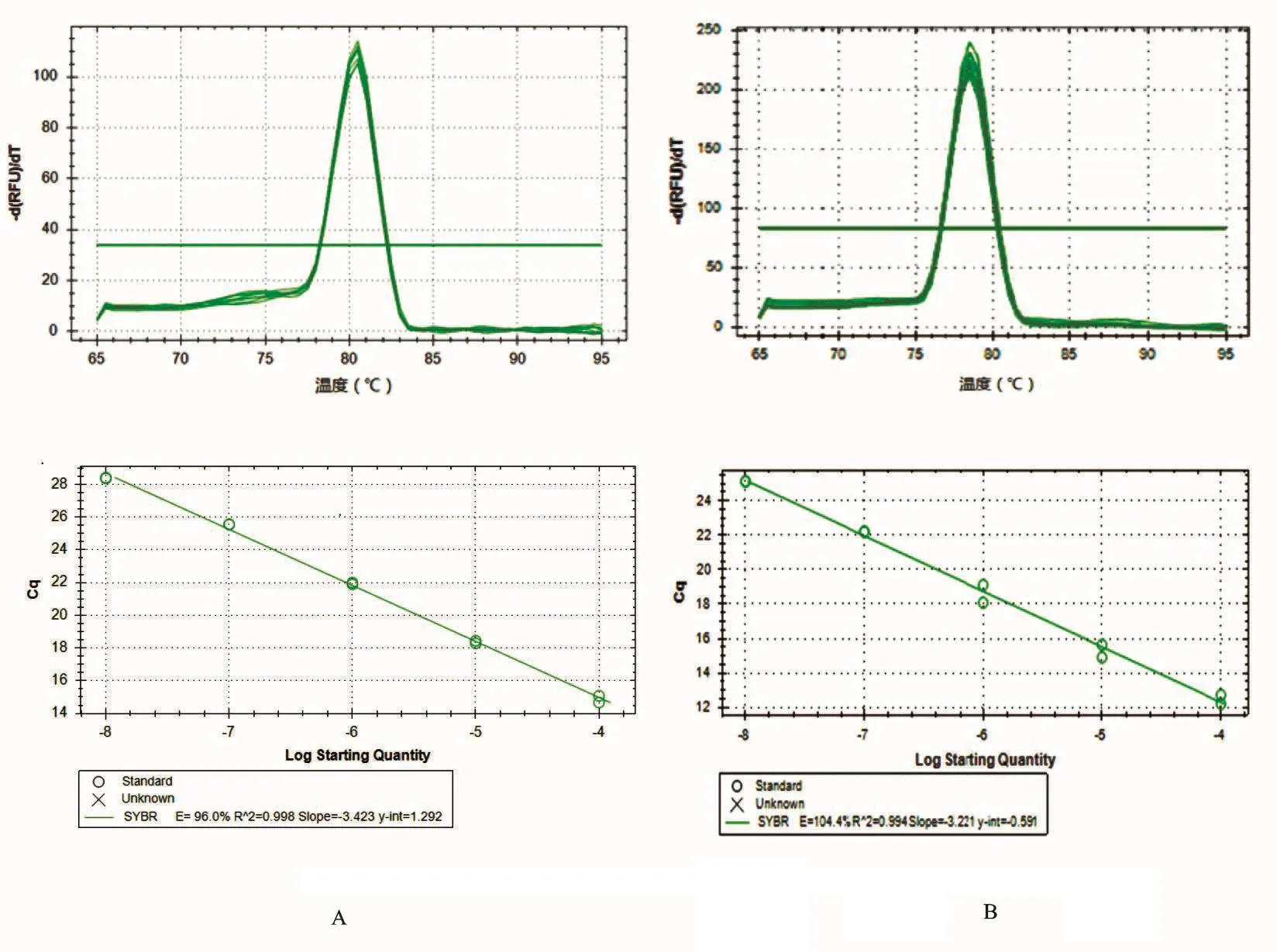
图1 LGR4基因(A)和ZNF281基因(B)的融解曲线和标准曲线Fig.1 Melting curves and standard curves for LGR4 gene(A)and ZNF281 gene(B)
2.2 牦牛和犏牛睾丸LGR4和ZNF281 mRNA水平的比较
定量PCR分析表明:LGR4和ZNF281基因在牦牛和犏牛睾丸中均有较高表达.牦牛和犏牛睾丸中LGR4 mRNA水平差异不显著,而牦牛睾丸中ZNF281 mRNA水平极显著高于犏牛(P<0.01),相差约4.7倍(图2).
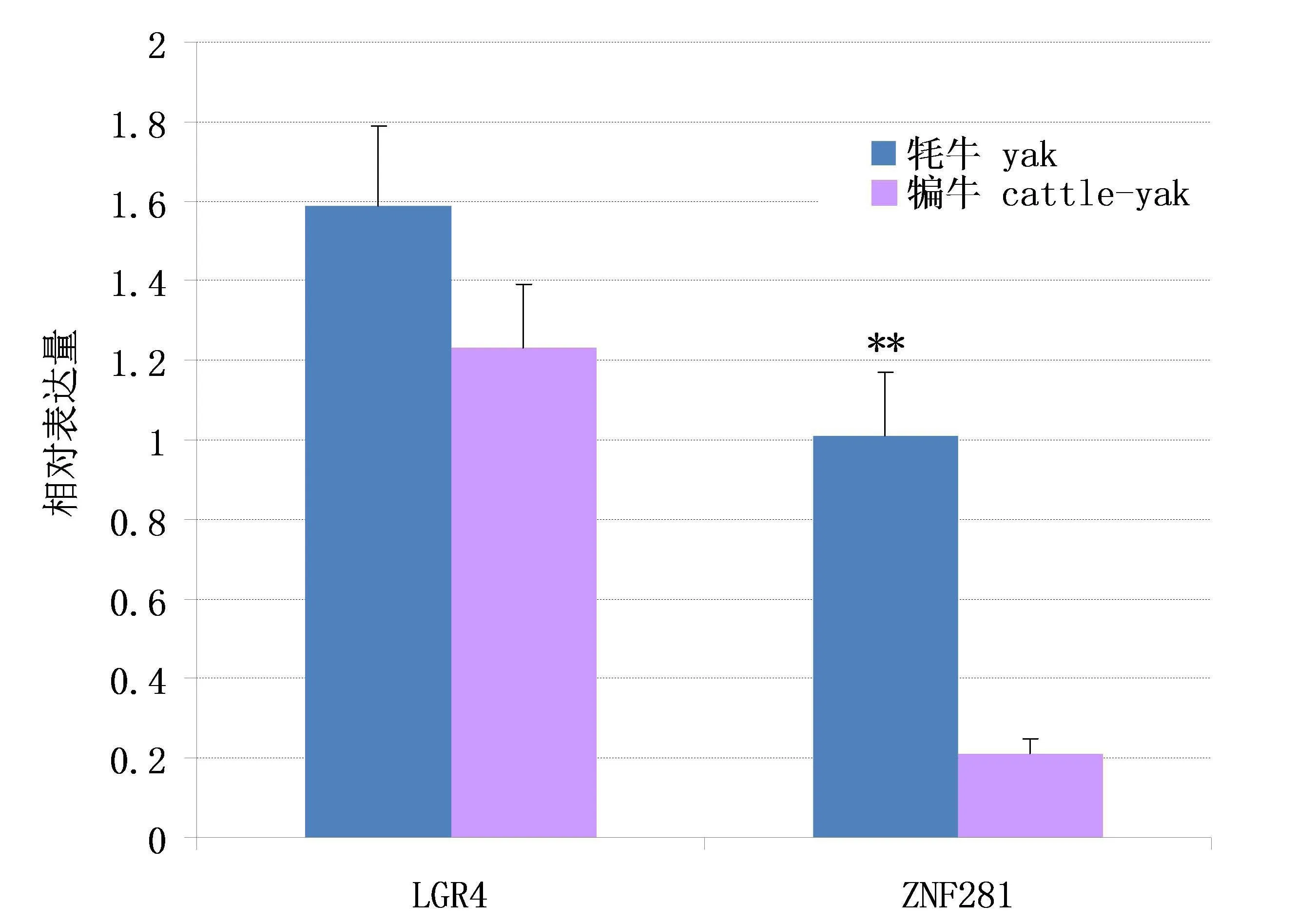
图2 牦牛和犏牛睾丸中LGR4基因和ZNF281基因的mRNA水平Fig.2 mRNA levels of LGR4 gene and ZNF281 gene in the testes of yaks and cattle-yaks
3 讨论
犏牛睾丸无法产生正常的精子.已有研究表明,雄性不育犏牛睾丸中很多与繁殖相关的基因表达下调[13-15,17].利用转录组和蛋白质组学技术,也检测到牦牛和犏牛睾丸中众多差异表达基因[18-19].有报道LGR4对精子发生是必需的[9].本研究中牦牛和犏牛睾丸LGR4 mRNA水平没有统计学上的显著差异(图2A),推测该基因可能不是导致犏牛雄性不育的主要原因.精子发生涉及复杂的基因调控网络,我们曾发现犏牛睾丸中MAPK信号转导通路中的信号分子表达显著下调[20].由于LGR4与Wnt信号通路有关,推测犏牛睾丸中该通路与精子发生障碍的直接关系不大.
锌指蛋白基因是哺乳动物基因组中最大的基因家族之一,其中一些在睾丸中表达水平高,并与精子发生相关,如 ZFP393、ZNF313、ZNF230 等[21-23].有关ZNF281的研究很少,它是重要的转录因子,在干细胞的分化中发挥重要作用[24].犏牛睾丸中ZNF281基因表达显著降低,有可能通过影响睾丸中的细胞分化而影响精子的发生,导致雄性不育.上皮间质转化是组织细胞发育中的重要机制,ZNF281可被该过程诱导,但被miR-34a抑制[11].犏牛睾丸细胞组成与牦牛不同[25],可能是导致其ZNF281基因表达下调的主要原因.我们过去的研究也表明,另外一种锌指蛋白Prdm9在犏牛睾丸中的表达也显著下降[25],提示雄性不育犏牛睾丸中的信号通路存在障碍.至于牦牛睾丸miRNA-449水平与ZNF281基因表达的关系需要证实.根据本研究结果,推测ZNF281基因在犏牛精子发生中可能有作用.
