整合素α4半胱氨酸突变质粒的构建及谷胱甘肽化水平检测*
2019-01-15尤媛媛陈善泽李东珏郭婧黄宁李婧瑜
尤媛媛 陈善泽 李东珏 郭婧 黄宁 李婧瑜
(四川大学华西基础医学与法医学院病理生理学教研室,四川 成都 610041)
谷胱甘肽化是一种重要的氧化还原性翻译后修饰,可导致蛋白可逆的功能性改变[1-3]。在一些细胞中,活性氧的产生推动着蛋白的半胱氨酸残基上的自由巯基(-SH)与谷胱甘肽(Glutathione,GSH)相互作用形成蛋白-谷胱甘肽混合二硫加和物(Pr-SSG)[4]。S-谷胱甘肽化化影响多种蛋白的功能,包括胞内蛋白actin、titin转录因子NF-κB,及胞外组分如整合素α4、细胞因子IL-1β等[5-7],以此来调节细胞信号和功能。
整合素家族是在许多生命活动中起着重要作用的粘附分子,包括细胞分裂、凋亡、分化、炎症反应以及组织修复等生理或病理过程[8,9]。其中α4β1/VCAM-1粘附信号在中性粒细胞产生、骨髓释放、粘附到血管内皮等多个环节起重要作用[10]。我们的前期研究表明α4亚基的谷胱甘肽化可能会调控α4β1/VCAM-1的粘附信号通路。因此深入研究α4亚基的谷胱甘肽化的修饰位点具有重要作用。本文旨在用基因工程技术构建整合素α4的半胱氨酸突变质粒,通过体外检测谷胱肽化的方法来鉴定其谷胱甘肽化修饰位点,为研究谷胱甘肽化调控α4β1/VCAM-1的粘附信号及其在中性粒细胞骨髓释放过程中的作用垫定基础。
1 材料与方法
1.1 实验材料
293T细胞系由四川大学孙晓东副研究员馈赠,Flag-α4真核表达质粒购自Gene Copoeia。High-Fidelity Master Mix购自Maclab, DMT酶购自Transgen Biotech, DMT chemically Competent Cell购自Transgen Biotech, anti-Flag Agarose Beads购自Abmart, BioGEE购自Thermo Fisher, H2O2购自Sigma, Strepdavidin-HRP购自Cell Signaling Technology, Flag antibody购自Santa Cruz等。
1.2 方法
1.2.1 整合素α4半胱氨酸残基点突变质粒构建
以野生型Flag-α4质粒为模板,进行PCR扩增;对PCR产物用DMT酶37℃孵育1 h消化;然后转化到DMT感受态细胞中,涂板37℃过夜培养;挑取长出的单克隆37℃摇菌,存菌并送公司测序鉴定;测序构建成功的,摇菌小提质粒,并用钙转染试剂转染到293T细胞,用Flag抗体Western blot检测质粒表达情况,选取表达良好的质粒,大提质粒-20℃保种。
1.2.2 免疫共沉淀法获得整合素α4蛋白
利用钙转的方法,向前一天铺种的10 mm盘的293T细胞中转染Flag-α4质粒,24 h后加入1 ml细胞裂解液冰浴30 min裂解细胞,收集细胞裂解液到1.5 ml管中,加入anti-Flag琼脂糖珠,在4℃旋转混合4 h,用PBS缓冲液洗脱琼脂糖珠三次,去除非特异性结合,即得到富集的Flag-α4蛋白。
1.2.3 整合素α4谷胱甘肽化检测
在1.5 ml管中加入富集的Flag-α4蛋白、生物素偶联的GSH(BioGEE)(提供谷胱甘肽化所需GSH)、H2O2(活性氧的一种,促进修饰发生)室温处理15 min,并设置不加BioGEE、H2O2处理组,还原剂DTT处理15 min组不可逆去除谷胱甘肽化修饰为对照;然后将样品做非还原型(上样缓冲液不加还原剂)SDS-PAGE的Western blot,用Strepdavidin-HRP检测谷胱甘肽化修饰α4蛋白含量。
2 结果
2.1 整合素α4半胱氨酸残基点突变质粒构建
2.1.1整合素α4半胱氨酸残基点突变质粒引物设计
成熟的整合素α4蛋白中共有6个未形成二硫键的半胱氨酸,依次分布在81、85、278、717、767和828位[11]。我们设计把这六个位点的半胱氨酸分别突变成天冬氨酸,表1即为六个单氨基酸突变的PCR引物。

表1 整合素α4半胱氨酸突变质粒的PCR引物
2.1.2整合素α4半胱氨酸残基点突变质粒PCR扩增和酶切
Flag-α4质粒长度约为8.5 kb,PCR产物均有长度与之相符的片段,如图1A所示;经DMT酶切消化处理模板后,可见消化产物仍有长度与之一致的片段,如图1B所示。
2.1.3整合素α4半胱氨酸残基点突变质粒测序验证
经测序鉴定,六个位点的半胱氨酸残基均分别突变成了天冬氨酸残基,如图2所示,81、85、278位半胱氨酸的密码子TGT突变成了天冬氨酸的密码子GAT,717位半胱氨酸的密码子ACA突变成了天冬氨酸的密码子ATC,767位半胱氨酸的密码子GCA突变成了天冬氨酸的密码子GTC,828位半胱氨酸的密码子ACA突变成了天冬氨酸的密码子GTC。

图1 Flag-α4半胱氨酸突变质粒构建注:A为PCR产物的电泳条带,B为DMT酶消化后的电脉条带。
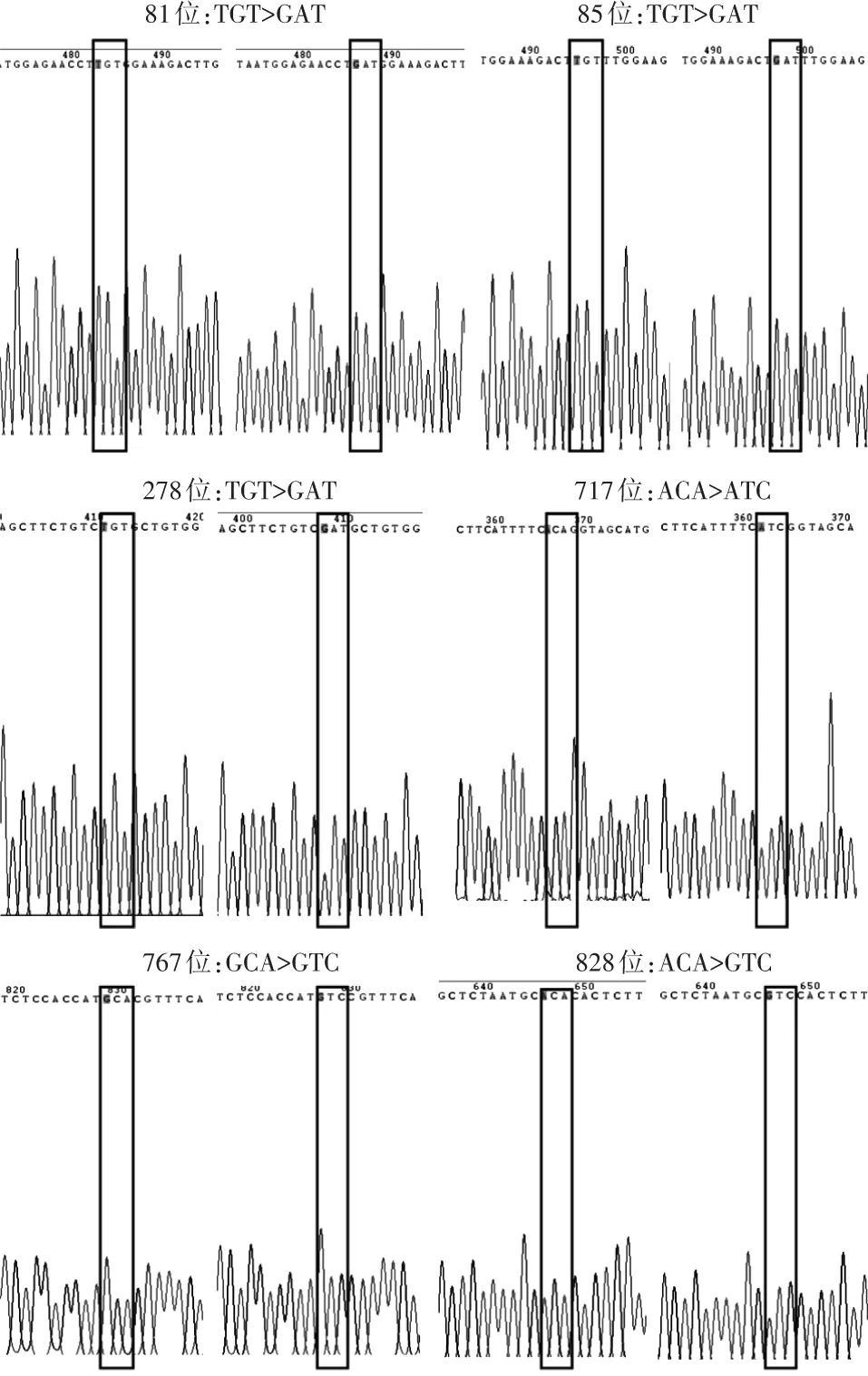
图2 Flag-α4半胱氨酸突变质粒测序结果注:每个位点左侧为野生型测序结果,右侧为突变型测序结果。
2.2 整合素α4半胱氨酸残基点突变质粒在293T细胞中的表达
将构建好的突变质粒和野生型Flag-α4质粒转染到293T细胞中,用anti-Flag抗体进行Western blot检测,如图3所示,转染了野生型或突变型Flag-α4质粒的细胞裂解液均呈现清晰的Flag-α4的蛋白条带,分子量约为150 kD,与理论结果一致。

图3 Flag-α4半胱氨酸突变质粒在293T细胞中的表达
2.3 半胱氨酸残基点突变整合素α4的体外谷胱甘肽化
如图4A所示,野生型的整合素α4具有谷胱甘肽化修饰,还原剂DTT会清除这种修饰。为了深入研究其谷胱甘肽化修饰位点,我们用半胱氨酸突变为天冬氨酸的突变型α4进行了体外谷胱甘肽化的检测。如图B-G所示,在81、85、278、717、767或828位半胱氨酸残基突变成天冬氨酸残基后,仍能检测到谷胱甘肽化修饰,并且类似的,还原剂处理后修饰消除。

图4 半胱氨酸突变Flag-α4的体外谷胱甘肽化注:A为野生型Flag-α4,B-G分别为81、85、278、717、767、828位半胱氨酸突变为天冬氨酸的Flag-α4,其处理同A所示。
3 讨论
氧化还原反应涉及许多生理性或病理性细胞活动,包括激酶信号通路、膜通道功能、转录调控、蛋白折叠等[12,13]。谷胱甘肽化作为一种可逆的氧化还原性修饰,可引起蛋白活化或失活。它不但可以保护蛋白免于氧化压力下被不可逆氧化,还被逐渐认识到是一种重要的信号通路调控手段。目前大约有几十种蛋白已被证实在生理条件下受谷胱甘肽化调控。比如,我们之前的研究就表明谷胱甘肽化在中性粒细胞的actin动态调节过程中占据重要的生理地位,从而调控中性粒细胞的功能[14]。
已有多个研究小组报道在酸性粒细胞、黑色素瘤细胞中,谷胱甘肽化通过修饰整合素α4亚基调节α4β1/VCAM-1粘附信号[11,15];我们的前期研究表明在中性粒细胞中,谷胱甘肽化对该粘附信号起重要的促进作用。进一步分析整合素α4的结构发现整合素α4包含一些独有的未形成二硫键的半胱氨酸残基,即本研究中分析的六个位点。有研究表明在K562细胞中,整合素α4的Cys278和Cys717突变抑制了α4β1与VCAM-1的结合[16,17]。因此,鉴定整合素α4的修饰位点,对探究谷胱甘肽化对α4β1/VCAM-1粘附信号及相关的细胞生命过程具有重要意义。
为明确α4中具有谷胱甘肽化修饰的半胱氨酸残基,本研究构建了一系列单点突变的α4真核表达质粒,免疫沉淀富积突变的整合素α4蛋白,再利用体外谷胱甘肽化方法检测其谷胱甘肽化水平。结果显示:单一半胱氨酸位点突变后,仍能检测到谷胱甘肽化信号;这提示着α4的谷胱甘肽化修饰可能不是针对单一半胱氨酸残基,而是存在多位点同时修饰。因此我们将在后续的研究中,构建多位点突变质粒,并结合质谱的方法来最终确定整合素α4的谷胱甘肽化修饰位点,继续深入研究谷胱甘肽化对整合素α4功能的调节作用。
