浓香型单层大曲与双层大曲的质量对比分析
2019-01-14张曼谢军卫春会王洪李子健罗惠波
张曼,谢军,卫春会,王洪,李子健,罗惠波,*
1(四川理工学院 生物工程学院,四川 自贡,643000) 2(四川理工学院,酿酒生物技术及应用四川省重点实验室,四川 自贡,643000)
大曲是以小麦为主或辅以豌豆和大麦等发酵制成的形状较大并含有多种菌类、酶类及香味物质的微生态制品[1],是酿酒生产中的糖化发酵剂和生香剂,同时也是酿酒生产的部分原料。由于微生物的代谢作用使得大曲含有丰富的风味物质及其前体物,这些风味化合物构成了大曲自身的“曲香”[2-3]。大曲按照制曲工艺可区分为传统大曲、纯种大曲、强化大曲和架子曲[4],目前,对单层曲的工艺研究较为普遍,对多层曲的研究较少,而多层曲的研究方向主要是对工艺的探讨、对制曲新设备的研发等,对单双层曲的对比研究更少。大曲的品质与特点不仅影响其产酒率,且与基酒的品质与风格息息相关[5],大曲成分比较复杂,我国大部分白酒企业的大曲质量标准都是根据理化指标和感官指标制定的[1,6],虽然能在一定程度上反映出大曲的质量,但缺乏一些科学依据,并且不同的人对同一块大曲的感官评价可能存在差异,主观性较强。随着对大曲质量标准的深入研究,设定大曲质量标准时将理化指标、生化指标和感官指标纳入标准体系[7]。为了统一大曲的质量标准、用数据模型代替主观性较强的感官评定,对单层大曲和双层大曲的理化、生化、微生物指标进行考察很有必要。
该文主要通过测定浓香型单层曲和双层曲在发酵过程中理化指标、生化指标、微生物量,分析其变化趋势、差异及原因,将感官鉴定、理化指标、生化指标、微生物指标等纳入因素范畴,通过打分制建立一个科学的评价体系,将传统的感官鉴定与科学评价体系相结合来评价大曲质量的好坏。
1 材料与方法
1.1 材料与试剂
大曲样品:四川邛崃古川酒厂,分别取单层曲和双层架子曲发酵0 d、1 d、3 d、6 d、9 d、12 d、15 d、20 d、60 d(贮存1个月)、90 d(贮存2个月)的大曲,并对大曲进行相应的编号,单层曲:S0、S1、S3、S6、S9、S12、S15、S20、S1M(贮存1个月)、S2M(贮存2个月);双层曲:D0、D1、D3、D6、D9、D12、D15、D20、D1M(贮存1个月)、D2M(贮存2个月)。大曲粉碎后过30目筛,混合均匀后放置4℃冰储存用于理化指标的测定,放置在-20℃冰箱里用于微生物指标的测定。
主要试剂:α-淀粉酶(50 000 U)、糖化酶(50 000 U):山东西亚化学工业有限公司;溶菌酶、蜗牛酶、SDS(美国Sigma公司);DNA提取液;苯酚、氯仿、异戊醇、异丙醇、无水乙醇,分析纯(成都市科龙化工试剂厂);Quant-iT PicoGreen dsDNA Assay Kit;QIAquick Gel Extraction Kit,Quant-iTPicoGreen定量试剂盒等。
1.2 仪器与设备
GZ-1200-X型恒温层析柜:韶关广智科技设备有限公司;UV-1200型紫外可见分光光度计:上海美谱达仪器有限公司;MIK-6AT型温湿度变送器:杭州美控自动化技术有限公司;APEG-DCO2-3-H型固定式二氧化碳检测仪,APEG-DO2-3-H型固定式氧气检测仪:深圳市安帕尔科技有限公司;实时荧光定量PCR仪:TIB8600,泰普生物科学(中国)有限公司等。
1.3 方法
1.3.1 大曲理化指标的测定
水分、酸度、氨态氮含量的测定方法参照文献[8];水分活度使用水活度仪进行测定[9];淀粉的测定方法根据文献[10]测定。
1.3.2 大曲生化指标的测定
大曲液化力、酯化力、糖化力和发酵力的测定方法根据文献[11-12]测定。
1.3.3 微生物量的测定
测定采用荧光定量实时PCR法[13],对粗提取的基因组DNA进行纯化后,进行荧光定量PCR。以大曲总基因组DNA为模板,分别以引物对338F(5’-ACTCCTACGGGAGGCAGCA-3’),806R(5’-GGACTACHVGGGTWTCTAAT-3’)对细菌16S rRNA基因序列中的V3-V4可变区进行扩增,引物对ITS5F(5’-GGAAGTAAAAGTCGTAACAAGG-3’),ITS1R(5’-GCTGCGTTCTTCATCGATGC-3’)对真菌ITS1区进行扩增。反应条件:95 ℃ 5 min;95 ℃ 15 s,57 ℃ 30 s,45个循环。
1.3.4 大曲感官鉴定综合评定方法
结合一些研究者[6]对大曲感官鉴定的标准,对大曲感官参数的设置及其权重分配进行综合评定,见表1。

表1 大曲感官评分表Table 1 Sensory evaluation of Daqu
对贮存1个月和2个月的单层大曲和双层大曲进行感官打分,所得感官评分记为S。其中,感官评分由5名以上酒厂专业制曲人员进行,最终取平均值记为最终评分。
1.3.5 大曲理化和生化指标综合评定方法
大曲理化和生化指标对大曲质量影响较大,结合先前研究者对大曲质量指标参数的设置及其权重分配进行综合评定[14],见表2。

表2 理化和生化指标参数设置及权重分配Table 2 Parameters set for physicochemical and biochemical indexes and their weights distribution
由于大曲各理化和生化指标的单位不同即量纲不统一,数值上差异会很大,为了消除量纲的影响,该试验将对大曲各指标进行归一化处理,其计算公式为:

(1)
大曲酸度、液化力、糖化力、发酵力、酯化力、蛋白酶活力等指标为正效应,其计算公式为:

(2)
公式(1)和(2)中,yi是大曲各指标归一化值;xi是大曲各指标测定值;xmax和xmin分别是大曲各指标测定的最大值与最小值。
大曲理化(Y1)、生化(Y2)和综合指标(Y)的计算公式为:

(3)
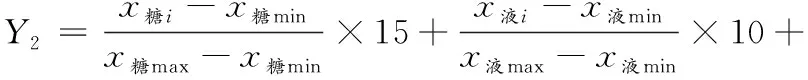
(4)
Y=Y1+Y2
(5)
1.3.6 大曲微生物指标综合评定方法
大曲微生物主要包括细菌和真菌,微生物的生物量可以体现出大曲的发酵性能,也可以反映出大曲的发酵状态,对大曲质量影响也较大。对真菌和细菌的权重设置为7∶3[4],大曲微生物综合评定得分为M,对样品进行综合评分,计算公式为:
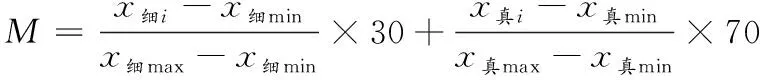
(6)
公式(6)中,M是大曲微生物指标综合得分;x细i、x真i是大曲细菌和真菌的生物量值;x细max、x真max是大曲细菌和真菌生物量的最大值;x细min、x真min是大曲细菌和真菌生物量的最小值。
1.3.7 大曲综合评价指标处理法
为了消除大曲各指标数量级和量纲对其加权评分值的影响,感官评分S、生化和理化指标Y和微生物指标M用公式(2)将其标准化,标准化之后分别用Z1、Z2、Z3表示。用线性加权法确定大曲综合评价函数为Z,计算公式为:
Z=λ1Z1+λ2Z2+λ3Z3
(7)
公式(7)中,λ1、λ2、λ3分别为Z1、Z2、Z3的加权系数,满足λ1>0、λ2>0、λ3>0,且三者之和等于1。通过查阅文献[7],了解到大曲各指标对其质量及酿酒生产贡献的大小,取λ1=0.2、λ2=0.5、λ3=0.3,所以大曲指标综合评价函数Z的表达式如下:
Z=0.2Z1+0.5Z2+0.3Z3
(8)
1.4 数据处理
2 结果与分析
2.1 大曲理化指标的动态分析
大曲理化指标是评价大曲质量的重要组成部分,能反映微生物的结构分布和代谢途径。水分含量在制曲过程中与微生物的生长和酶的生成密切相关。由图1可知,单层大曲和双层大曲水分变化总体呈降低趋势,发酵9 d后双层曲的水分含量较单层曲低,这是因为双层曲曲温较高,水分的扩散蒸发速度更快,但最终单双层曲含水量趋于一致;大曲水活度在发酵前12 d降低缓慢,而在后期降低速率较快,这是由于单层大曲和双层大曲微生物先后再次大量繁殖,消耗了自由水[15];贮存2个月后单层大曲和双层大曲的水活度都趋于0.62左右,此时微生物几乎停止代谢而处于休眠状态。

图1 水分和水活度的变化Fig.1 Changes of moisture content and water activity
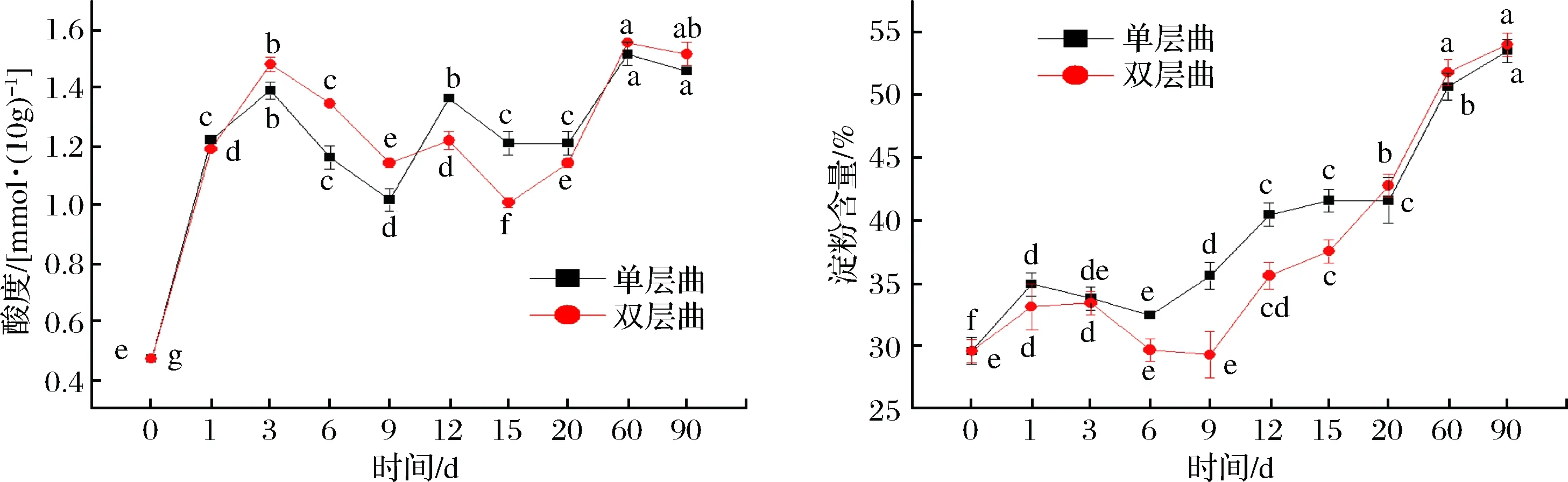
图2 酸度和淀粉含量的变化Fig.2 Changes of acidity and starch content
由图2可知,大曲酸度随着发酵时间呈波浪式上升,大曲中酸度的增加主要是由于大曲中生酸菌的生酸作用,尤其是醋酸菌和乳酸菌等,最终酸度分别为1.46 mmol/10g和1.52 mmol/10g;单层大曲在发酵9~12 d时酸度短暂上升,可能是因为高温刺激了某种产酸耐热芽孢杆菌的生长导致酸度增加[16];单层大曲和双层大曲在发酵前20 d淀粉含量差异较大,由于采用的样品未处于绝干状态,水分降低速度相对较快,淀粉变化总体呈上升趋势;在贮存期时两者含量相近并趋于稳定,最终淀粉含量在54%左右;发酵1~3 d单层大曲淀粉含量有一个明显的降低趋势,而双层大曲则恰好相反,说明单层大曲中霉菌和酵母菌生长更为旺盛,单层大曲的穿衣效果也较双层大曲要好。
2.2 大曲生化指标的动态分析
大曲的生化指标是衡量大曲质量的重要指标,由图3可知,发酵过程中单层大曲和双层大曲的液化力总体来说都先增加后降低,最后在贮存期趋于平稳,单层大曲液化力高于双层大曲;发酵1~6 d单层大曲的液化力增长较快,且较双层大曲液化力高;发酵12 d至发酵后期明显回升,发酵20 d时达到最大值,单双层曲的液化力分别为1.8 g/(g·h)和1.2 g/(g·h);由于缺乏营养物质和水分,微生物无法进行正常的代谢生长[17],发酵20 d至贮存期大曲液化力显著降低且2种大曲液化力相差不大;糖化力在发酵前3 d明显下降,且双层大曲糖化力要大于单层大曲,在发酵12~20 d单层大曲糖化力要大于双层大曲,且双层大曲糖化力显著性下降,此阶段双层大曲曲温较单层大曲高,高温条件抑制或杀死了这类微生物,使得糖化酶代谢减少;大曲经历贮存期后糖化力降到最小值[18],且单层大曲较双层大曲高,分别为256 mg/(g·h)和233 mg/(g·h)。

图3 液化力和糖化力的变化Fig.3 Changes of liquefaction and saccharification levels
由图4可知,发酵前3 d单层大曲和双层大曲发酵力都呈上升趋势,此时酵母菌生长较为旺盛,并且单层大曲发酵力要高于双层大曲;发酵3 d后大曲发酵力呈现出降低趋势,这是由于发酵初期温度对酵母菌起到一个高温筛选作用,少部分能耐热的酵母菌存活了下来,随着后期发酵温度的降低,一些酵母菌又开始大量繁殖;经过2个月贮存后,大曲发酵力达到1个较低水平,单层大曲发酵力高于双层大曲,分别为0.6 g/(g·72h)和0.3 g/(g·72h);大曲氨态氮的量总体呈现降低的趋势,在贮存期趋于稳定,单层大曲和双层大曲在发酵过程中变化波动都较大,说明大曲微生物代谢挥发性风味化合物具有时期性而不是连续性代谢产生;沈才洪等[14]认为,氨态氮和淀粉消耗率是大曲生香力的特征指标,发酵第9天的大曲处于排潮生香期,在发酵过程中氨态氮被微生物利用,从而使其含量降低,此外,随着发酵过程中温度的升高也可加速美拉德反应的进行,使得氨态氮的量减少[10,19];贮存2个月后大曲氨态氮的量处于较低水平为356 mg/100g,此时大曲具有浓郁的曲香味。
由图5可知,随着发酵时间的增加,单层大曲酯化力缓慢上升后趋于稳定,且波动相对较小,而双层大曲酯化力在发酵前6 d波动较大;发酵前6 d单层大曲酯化力较双层大曲高,而在发酵9 d后则相反,可能原因是高温条件能在一定程度上刺激产酯化酶微生物的生长;贮存2个月后单层大曲酯化力大于双层大曲,分别为391 mg/(50g·7d)和371 mg/(50g·7d);随着发酵时间的增加,大曲蛋白酶活力呈现出缓慢增加的趋势,单层大曲和双层大曲在此过程中交替出现升高降低的波动变化现象;单层大曲和双层大曲在发酵后期分别达到最大值,分别为106 U/g和108 U/g,而在贮存期时又急剧降低,使酶活处于较低水平,且单层大曲酶活较双层大曲高,此时蛋白酶活力分别为18 U/g和13 U/g。
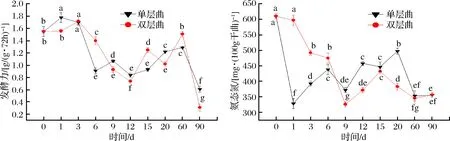
图4 发酵力和氨态氮的变化Fig.4 Changes of fermentation force and ammonia nitrogen content
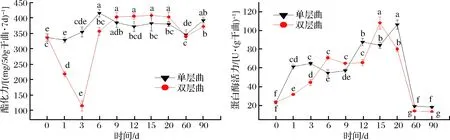
图5 酯化力和蛋白酶活的变化Fig.5 Changes of esterification level and protease activity
2.3 浓香型单层大曲和双层大曲微生物量测定
通过荧光定量实时PCR法分别得到单层大曲和双层大曲真菌ITS和细菌16S rRNA基因的拷贝数,从而得到发酵过程中真菌生物量和细菌生物量及变化规律,即表3、表4所示。

表3 单层大曲微生物量Table 3 Fungal biomass of single-layer Daqu

表4 双层大曲微生物量Table 4 Fungal biomass of double-layer Daqu
由表3可知,单层大曲发酵过程中前1~3 d真菌生物量增加较快,发酵第6天生物量相对减少,而6 d后真菌生物量缓慢增加,经过贮存期后生物量相对稳定,发酵第20天时生物量达到最大;单层大曲中细菌16S rRNA基因拷贝数总体呈波浪式变化,在第6天时生物量达到最大,与发酵第6天相比第9天有一个明显的减少趋势,同样的相比于第12天,发酵第15天生物量也有一个明显的减少趋势,说明2次翻曲对细菌生物量的减少有一定促进作用。
由表4可知,双层大曲在发酵1~3 天真菌生物量明显增加;第6天时生物量减少;而发酵第6天后真菌生物量有所回升,经过贮存期后生物量相对稳定,发酵第15天生物量达到最大;双层大曲中细菌生物量随着时间的增加也呈现波动式起伏,但没有单层大曲剧烈且每个发酵阶段的生物量总体较单层大曲小,发酵第9天相对于第6天也有一个明显的减小趋势,说明第一次翻曲对细菌生物量的减少有一定促进作用。
2.4 大曲综合评分
基于单双层大曲的理化指标、生化指标、微生物量等数据,选择样品进行感官鉴定评分、生理生化指标评分、微生物指标评分,用科学的评价体系代替主观性较强的感官评定,最后对以上指标进行综合判断,从而评价单双层大曲质量的好坏。
由于贮藏期的大曲样品理化、生化、微生物量趋于稳定,因此选择S1M、S2M、D1M和D2M样品通过表1的评分方式进行感官鉴定评分,最终得到平均分分别为93、92、81、79。按照表2的理化和生化指标参数设置及权重分配情况将大曲的理化、生化、微生物指标值进行分配,并带入相应的计算公式,得到感官鉴定得分、生化和理化得分、微生物得分和大曲综合得分(表5~表8)。
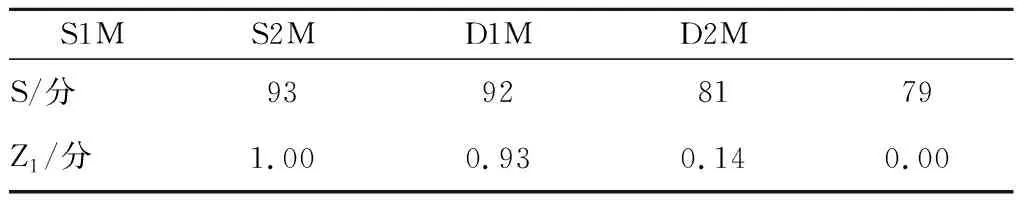
表5 感官鉴定得分Table 5 Sensory evaluation scores
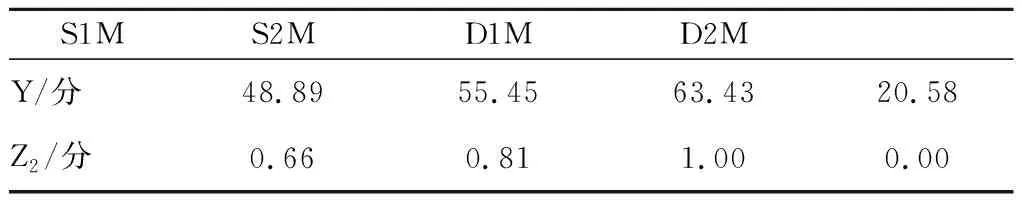
表6 生化和理化指标得分Table 6 Physicochemical and biochemical indexes scores

表7 微生物指标得分Table 7 Microbial indexes scores

表8 大曲综合得分情况Table 8 Comprehensive scores of Daqu
由表8可知,贮存期大曲样品中S2M综合得分最高为0.89分,D2M得分最低为0.21分,得分大小情况为S2M>S1M>D1M>D2M,由此可知,单层大曲的质量要较双层大曲好。在对大曲感官评分(S)过程中发现双层大曲穿衣效果、菌丝饱满度和曲香味较单层大曲差。在对大曲理化和生化指标评分(Y)过程中发现蛋白酶活力在双层大曲评分中较低,而液化力、糖化力、发酵力的评分随着贮存时间的增加在双层大曲中不断的降低。而对微生物指标评分(M)过程中发现双层大曲真菌生物量的得分较低,对其评分影响较大。综合来看,单层大曲的质量好于双层大曲。
2.5 大曲各指标间的相关性分析
大曲各指标间均存在相互影响关系,大曲各指标间的相关性分析结果见表9、表10。

表9 单层大曲指标间相关性分析Table 9 Ccorrelation analysis of single-layer Daqu indexes
注:*表示在0.05水平上显著相关,**表示在0.01水平上显著相关。
由表9可知,单层曲真菌生物量与水活度的相关性系数为-0.575,说明水活度与真菌生物量呈负相关[17];真菌生物量与蛋白酶活力、液化力、发酵力的相关性系数分别为0.446、0.607、-0.489,说明真菌生物量与蛋白酶活力、液化力呈正相关,与发酵力呈负相关。细菌生物量与水活度的相关性系数为0.639,说明水活度与细菌生物量呈显著(p<0.05)正相关;细菌生物量与糖化力的相关性系数为0.476,说明细菌生物量与糖化力呈正相关。蛋白酶活力与液化力、糖化力的相关性系数分别为0.803、0.656,说明蛋白酶活力与液化力呈极显著(p<0.01)正相关,与糖化力呈显著(p<0.05)正相关。糖化力与水活度呈显著(p<0.05)正相关,发酵力与水活度呈正相关。

表10 双层大曲指标间相关性分析Table 10 Correlation analysis of double-layer Daqu indexes
注:*表示在0.05水平上显著相关,**表示在0.01水平上显著相关。
由表10可知,双层曲真菌生物量与蛋白酶活力、液化力的相关性系数分别为0.657和0.588,说明真菌生物量与蛋白酶活力呈显著(p<0.05)正相关,与液化力呈正相关;细菌生物量与水活度的相关性系数为0.658,说明水活度与细菌生物量呈显著(p<0.05)正相关;细菌生物量与发酵力的相关性系数为0.571,说明细菌生物量与发酵力呈正相关;蛋白酶与液化力呈显著(p<0.05)正相关;糖化力与水活度呈极显著(p<0.01)正相关;发酵力与水活度呈正相关。
3 结论
从理化指标来看,单层大曲和双层大曲理化性能变化差异不大,贮存期单层大曲和双层大曲水分含量及水活度近似,总体呈降低趋势;在酸度方面,双层大曲略高于单层大曲的酸度(1.52 mmol/10g>1.46 mmol/10g);在发酵前20 d单层大曲淀粉含量高于双层大曲淀粉含量,而在贮存期时二者含量相近并趋于稳定,最终淀粉含量在54%左右,单层曲的穿衣效果较双层曲要好[20]。
从生化指标来看,在发酵期液化力最大值,分别为1.8 g/(g·h)和1.2 g/(g·h),贮存期大曲液化力显著降低,单层大曲的液化力略高于双层大曲;大曲经历贮存期后糖化力降到最小值,且单层大曲较双层大曲高[256 mg/(g·h)>233 mg/(g·h)];经过贮存期后单层大曲发酵力大于双层大曲[0.6 g/(g·72h)>0.3 g/(g·72h)];贮存2个月后单层大曲酯化力大于双层大曲[391 mg/(50g·7d)和371 mg/(50g·7d)];单层大曲酶活较双层大曲高,贮存期分别为18 U/g和13 U/g。
单层大曲的质量要较双层大曲好,双层大曲在感官鉴定中的穿衣效果、菌丝饱满度和曲香味等项目的评分较低,在理化和生化指标评价中的蛋白酶活力项评分较低,而液化力、糖化力、发酵力的评分随着贮存时间的增加在不断的降低,而在微生物指标评价中的真菌生物量得分较低,最终导致双层大曲评分较低;在双层大曲发酵过程中,水活度与细菌生物量呈显著(p<0.05)正相关,与糖化力呈极显著(p<0.01)正相关;真菌生物量与蛋白酶活力呈显著(p<0.05)正相关;蛋白酶活力与液化力呈显著(p<0.05)正相关。
