猕猴桃几丁质酶基因克隆及生物信息学分析
2019-01-14王园秀张圣洁蒋军喜
贺 哲,王园秀,张圣洁,蒋军喜*
(1.江西农业大学农学院,江西南昌330045;2.江西农业大学生物科学与工程学院,江西南昌330045)
猕猴桃泛指猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)植物,其果实营养丰富、风味独特,是我国近年大力发展的新兴水果之一。江西省奉新县是我国猕猴桃主产地之一,其优越的自然资源和生态环境非常适合猕猴桃种植,但同时猕猴桃果实熟腐病(简称果腐病)等病害问题也十分突出[1-2]。果腐病是一种由子囊菌门葡萄座腔菌(Botryosphaeriadothidea)引起的真菌病害,鉴于真菌的细胞壁主要成分为几丁质,发挥几丁质酶降解几丁质的作用无疑是防治植物真菌病害的一条有效途径[1,3-6]。近年来,笔者筛选到对果腐病具有显著抗性的‘金艳’等猕猴桃品种[2],并通过转录组测序发现几丁质酶基因在接菌的‘金艳’果实中呈现上调表达,此结果表明几丁质酶基因很可能在‘金艳’抗果腐病中发挥了作用。为此,按前期获得的转录本序列设计引物,从‘金艳’中克隆几丁质酶基因并进行生物信息学分析,以期为深入研究其抗病功能和转基因利用提供依据。
1 材料与方法
1.1 材料
江西省奉新县山口猕猴桃园中处于近成熟期的‘金艳’猕猴桃果实;葡萄座腔菌菌株BDF-6保存于江西农业大学植物病理研究室,接种前在PDA平板上活化培养。
1.2 接种方法
将培养菌落外围菌丝体打成直径5 mm的菌饼,采用刺伤法将菌饼接种到‘金艳’近成熟果实上,共接种20个果实。接种后72 h从病斑病健交界处对发病果肉进行取样,样品快速取下后立即用液氮速冻并速带回实验室于-70 ℃保存备用。
1.3 猕猴桃总RNA的提取
使用RNA提取试剂盒(上海普洛麦格),按其操作说明提取样品总RNA。
1.4 几丁质酶基因的RT-PCR扩增
以提取的RNA为模板,使用反转录试剂盒(美国Promega)按其说明对猕猴桃几丁质酶基因进行RT-PCR扩增,扩增的引物按照前期获得的猕猴桃转录组数据自行设计,上游引物AcC-F:5′-ATGAGGGTTTGGCTACTAGC-3′,下游引物AcC-R:5′-CTATGCAAAAGGCCTCTGGT-3′,由上海生工生物工程有限公司合成,扩增片段长度预期795 bp。PCR扩增反应体系为50 μL,上下游引物各2 μL,cDNA模板4 μL,2×TaqPCR Master Mix 25 μL,无核酸酶水17 μL。PCR反应条件为94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共35个循环;72 ℃补平10 min。PCR扩增产物用10 g/L琼脂糖凝胶电泳检测。
1.5 克隆、测序及序列分析
回收目的片段,使用pEASY-T3 Cloning Kit试剂盒(北京全式金)按其说明进行克隆,将含有目的片段的阳性克隆送至上海生工生物工程有限公司进行测序。使用Lasergene 7.0 软件进行序列拼接,使用NCBI 中BLAST程序对拼接好的序列进行在线比对。
1.6 序列编码产物生物信息学分析
进入表1所列网址对猕猴桃几丁质酶基因编码产物进行生物信息学分析。
2 结果与分析
2.1 猕猴桃总RNA提取
对接种果腐病菌72 h后的金艳猕猴桃果实进行RNA提取,电泳结果(图1)显示28S rRNA和18S rRNA条带清晰,表明提取的总RNA较完整;条带明亮,表明总RNA浓度较高,符合实验要求。

表1 本研究中生物信息学分析网址汇总
2.2 几丁质酶基因的RT-PCR扩增
以提取的总RNA为模板,反转录合成cDNA,再以cDNA为模板,进行猕猴桃几丁质酶基因完整编码区的PCR扩增,结果扩增到一条长度约为795 bp的片段(图2),片段长度与预期相符。

M:DL 2 000 marker;1:目的条带M:DL 2 000 Marker;1:Target product图1 ‘金艳’猕猴桃果实总RNA凝胶电泳结果Fig.1 Agrose gel electrophoresis of total RNA in ‘Jin Yan’ kiwifruit

M:DL 2 000 Marker;CK:阴性对照;1:目的片段M:DL 2 000 Marker;CK:Negative control;1:Target product图2 猕猴桃几丁质酶基因RT-PCR扩增产物电泳结果Fig.2 Electrophoresis of RT-PCR product of chitinase gene of kiwifruit
2.3 几丁质酶基因克隆、测序及序列分析
对PCR产物进行回收、克隆和序列测定,获得其核苷酸序列长度为795 bp(在GenBank中登录号MH580296),编码264个氨基酸,将克隆的此基因命名为AcCHI1。经Blast比对发现AcCHI1氨基酸序列与GenBank中的山茶(Camelliasinensis)几丁质酶基因(GenBank登录号KR078345.1)氨基酸序列同源性最高,为81%。
2.4 猕猴桃几丁质酶蛋白生物信息学分析
2.4.1 蛋白结构特征分析 根据NCBI蛋白保守结构域预测,AcCHI1隶属于Chitinase_glyco_hydro_19 domain-containing protein(图3),即属于19家族几丁质酶,而按氨基酸序列特征被描述为Chitinase class I,属于I 类几丁质酶。

图3 AcCHI1蛋白保守结构域预测Fig.3 Conserved domains forecast for protein of AcCHI1
2.4.2 蛋白理化性质分析 AcCHI1的分子式为C1288H1935N351O371S11,总原子数3 956,分子质量28.6 ku,等电点 8.58。在氨基酸组成上,最多的氨基酸为Gly (G),共32个,占12.1%,最少的氨基酸为His (H)和Met (M),各3个,占1.1%。酸性氨基酸(Asp+Glu) 19个,碱性氨基酸(Arg + Lys ) 23个;脂肪族氨基酸指数为69.58,不稳定指数为29.48,推测为稳定蛋白。
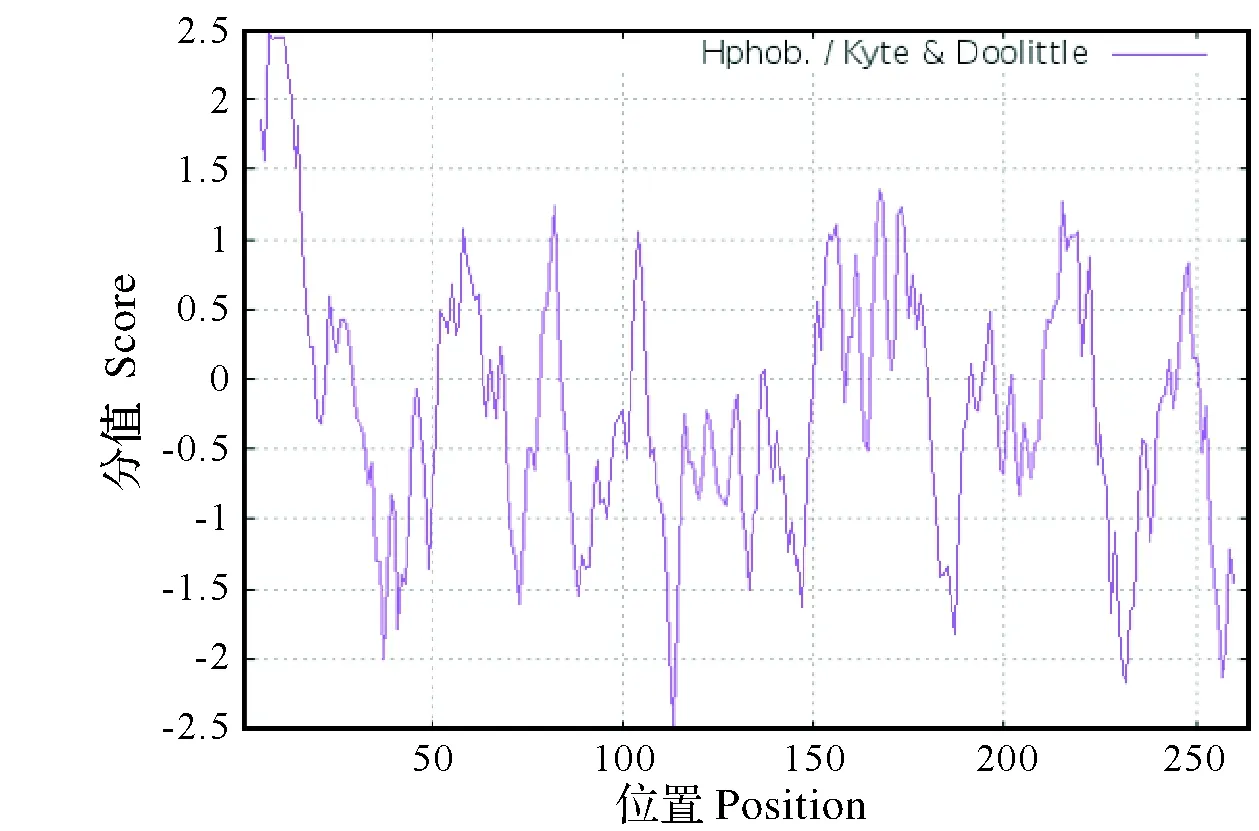
图4 AcCHI1疏水区/亲水区预测Fig.4 Prediction of the hydrophobic/hydrophilic regions of AcCHI1
2.4.3 蛋白亲疏水性预测 蛋白质的亲水/疏水性特征是蛋白质折叠的基础。利用在线分析软件ProtScale对AcCHI1进行亲水/疏水性分析(图4),根据蛋白质亲水和疏水的得分判定(即得分<-0.5的区域为亲水区,得分>0.5的区域为疏水区,得分在+0.5~-0.5的为两性区),AcCHI1含有13个疏水区,21个亲水区,因此可以认为该蛋白在总体上为亲水性蛋白。
2.4.4 跨膜结构预测 利用TMHMM软件分析预测AcCHI1的跨膜结构(图5),图中红线代表跨膜,紫线代表膜外,蓝线代表膜内,根据最上端紫色粗线条显示,全部氨基酸位于膜外,因此,AcCHI1不具有跨膜结构,不属于膜蛋白。

图5 AcCHI1跨膜结构分析Fig.5 Transmembrane structure analysis of AcCHI1
2.4.5 信号肽分析 利用软件SignalP-4.1对AcCHI1有无信号肽进行预测(图6),其中C-Score为剪切位点值;S-Score为信号肽区域值;Y-Score为剪切位点校准值。由图6可知该蛋白的S值区间为1~19个氨基酸之间,C值最大值在第20个氨基酸,Y值最大值在第20个氨基酸。因此推断AcCHI1含有信号肽,信号肽区域为1~19个氨基酸,信号肽剪切位点位于第20个氨基酸。
2.4.6 二级结构分析 图7为利用GOR4预测的AcCHI1的二级结构,其中组成α螺旋(Alpha helix)的氨基酸共48个,占18.18%,包含在无规则卷曲(random coil)中的氨基酸共149个,占56.44%,组成延伸链(extended strand)的氨基酸共67个,占25.38%。

图6 AcCHI1信号肽的预测和分析Fig 6. Prediction and analysis of signal peptide of AcCHI1

蓝色线:α螺旋;红色线:延伸链;紫色线:无规则卷曲Blue line:Alpha helix;Red line:Extended strand;Purple line:Random coil图7 AcCHI1的二级结构预测Fig.7 Secondary structure prediction of AcCHI1

图8 AcCHI1的三级结构预测Fig.8 Tertiary structure prediction of AcCHI1
2.4.7 三级结构分析 三级结构是指经过充分折叠,能发挥生物活性、可以执行特定生物催化功能的完整三维立体结构。在对AcCHI1进行三维结构同源建模时,以I类几丁质酶(4tx7.1.A)作为同源目标模板,利用Swiss-Model软件进行分析,发现AcCHI1与同源模板结构的相似度为69.67%,图8为利用同源建模生成的AcCHI1的三维立体结构。
3 讨论
本研究首次从猕猴桃中克隆到几丁质酶基因AcCHI1(GenBank登录号MH580296),并利用生物信息学方法对AcCHI1蛋白的分子特征进行了分析和预测。结果表明AcCHI1属于19家族成员,同时属于I类几丁质酶。目前,有关几丁质酶的分类方式主要有2种,一是根据几丁质酶催化区氨基酸序列同源性,将几丁质酶分为2个家族,即18家族和19家族。其中18家族几丁质酶来源于细菌、真菌、病毒及一些植物;19家族主要由植物几丁质酶构成,同时在一些放线菌中也有发现[6-9]。二是根据氨基酸序列特征,将几丁质酶分成6类,即ClassⅠ~Ⅵ,其中的Ⅰ类几丁质酶因含有结合几丁质的结构域,增强了酶对底物的亲和力,而具有强烈的抗真菌活性[10-12]。可以看出,本文将AcCHI1基因归在19族与19族几丁质酶主要来自植物的结论是一致的,同时也表明AcCHI1基因很可能具有宝贵的应用价值。
植物中并无几丁质,但几丁质酶普遍存在于植物中,显然几丁质酶很可能参与植物防卫反应特别是参与植物对真菌病害的抗性反应[13],由此也引发了大量有关植物几丁质酶基因克隆、产物特性及应用研究。目前,已从水稻、棉花、烟草、甘蔗、梨、菜豆、马铃薯、茶树、菊花等100余种植物中克隆到几丁质酶基因[14-19],并且在水稻、花生、黄瓜等多种植物中开展了转几丁质酶基因研究,结果显示转基因植株不同程度增强了对一些真菌病害的抗病能力[14,20-21]。奉新县大部分猕猴桃品种不抗果腐病,特别是‘红阳’、‘金果’等优良品种果腐病发生严重[2],猕猴桃几丁质酶基因的获得将为从遗传上改良这些品种以增强其对果腐病抗性带来了希望。
