棉花内生芽孢杆菌LH-L3定殖能力研究
2019-01-14陈丽华何鹏飞欧晓慧袁德超吴毅歆何月秋
陈丽华,何鹏飞,欧晓慧,袁德超,吴毅歆,,何月秋,*
(1.云南农业大学植物保护学院,云南昆明650201;2.云南农业大学农学与生物技术学院,云南昆明650201;3.微生物菌种筛选与应用国家地方联合工程研究中心,云南昆明650217)
植物内生细菌广泛存在于植物的组织或细胞内,它们与寄主植物建立和谐共存的关系,具有促生、固氮、抗病虫害、杀线虫等多种作用[1-4],目前已被广泛应用于农业生产。生防菌株能在根际土壤或植株体内成功定殖是所有抑菌机制的基础,内生细菌的定殖是其与寄主植物互作发挥其自身作用的关键步骤。随着生物技术和显微镜技术的发展,植物内生菌或病原菌在植物体内侵染、定殖的检测越来越容易[5]。目前检测菌株定殖情况的方法有很多,其中绿色荧光蛋白标记目标菌株越来越普遍[6]。
甲基营养型芽孢杆菌(Bacillusmethylotrophicus)LH-L3(下称LH-L3)是本实验室从健康棉株叶片中分离获得的内生细菌,平板对峙试验表明其对多种病原菌有抑制作用,并对棉花黄萎病有很好的防病作用,且具有促生长效果[7]。研究生防菌 LH-L3在棉花上的定殖情况,有助于进一步了解该菌株的防病促生机制。为了测定LH-L3的定殖能力,本文通过自然转化法获得了 GFP 标记菌株,并对其定殖情况进行跟踪检测。
1 材料与方法
1.1 试验材料
菌株:LH-L3(CGMCC No.12565)、稻瘟病菌(Magnaportheoryzae)、玉米大斑病菌(Exserohiumturcicum)为本实验室分离保存,棉花黄萎病菌(Verticilliumdahliae)由中国农业科学院棉花研究所李志芳博士惠赠。
质粒和抗生素:pHT01-P43GFPmut3a由本实验室自行构建,携带GFP基因和氯霉素(Cm)抗性基因,氯霉素使用终浓度为10 μg/mL。
作物:玉米(云禾单2号)为实验室自选种;甘蓝(中甘21)、小麦(昆麦5号)和蚕豆(凤豆6号)购于市场;棉种(冀棉11)由李志芳博士惠赠。
培养基:细菌培养采用LB培养基,真菌培养采用PDA培养基,菌株LH-L3的自然转化采用GCHE和GC培养基[7]。
1.2 LH-L3的自然转化
参照何鹏飞[8]提供的方法。挑取新鲜划线的LH-L3单菌落于液体LB中,37 ℃ 160 r/min振摇过夜培养;次日吸取LH-L3培养物于液体GCHE培养基中,使其光密度值OD600在0.3左右;37 ℃ 160 r/min振摇培养3~3.5 h,待其OD600达到1.4左右,加入等体积的GC培养液,稀释混匀,37 ℃ 160 r/min继续培养1.5~2 h;将此时的细胞培养物均匀分成两份,5 000 g室温离心6 min;吸取上清液200 μL悬浮菌体沉淀后,加入2 mL转化缓冲液及1 μg的外源DNA;混匀后,37 ℃温箱放置1 h,期间每隔10~15 min轻轻颠倒混匀;加入含亚致死浓度的相应抗生素的LB液体,37 ℃ 160 r/min振摇培养2~3 h后;10 000 r/min室温离心4 min,取上清液400 μL重悬菌体沉淀,均匀涂布于含相应浓度氯霉素的LB平板上;次日观察有无抗性菌落的出现,在光电折射仪上观察菌落是否发出绿色荧光。挑取发绿色荧光的单菌落于含有氯霉素的液体LB中扩大培养,并将该标记菌株定名为LH-L3-P43GFPmut3a(以下简称为LH-L3-GFP)。
1.3 LH-L3-GFP与野生型LH-L3菌株的室内拮抗活性比较
采用平板对峙实验[9]比较LH-L3-GFP和野生型LH-L3菌株对不同植物病原真菌的室内拮抗活性,其中植物病原真菌以棉花黄萎病病菌、玉米大斑病菌、稻瘟病菌为试验材料。观察标记菌是否具有相同或者更强的拮抗能力,对比两者的拮抗带宽度,以此来判断其LH-L3-GFP是否适用于定殖研究。
1.4 LH-L3-GFP在棉花体内的定殖
挑取过夜培养于氯霉素LB平板上的LH-L3-GFP的单菌落,于含有氯霉素的LB液体培养基中37 ℃振荡培养3 d,形成抗逆性较强的内生芽孢。棉花种子经75%酒精表面消毒无菌水漂洗3次后,播种于经2次灭菌的土壤中,约50 d后开始出现花朵时,用LH-L3-GFP菌液(106cfu/mL)进行灌根处理,同时设定清水对照,每处理重复3次。
回收检测菌LH-L3-GFP在根表土、根、茎、叶、花朵内的定殖情况,分别于处理后1,3,5,7,10,25,50 d取样。方法:将整棵棉花轻轻拔出,抖落根系上的土壤颗粒,然后用毛笔轻轻将附着在根系的土壤颗粒刷下,即为根表土壤样品,称质量后依次加无菌水进行10倍稀释,取稀释了100、1 000倍的土壤溶液100 μL均匀涂布于含有氯霉素抗性的平板上,每个处理重复3次,37 ℃培养48 h。用无菌剪刀将根、茎、叶、花朵分开,其中从最下层叶片至基部的部分为茎,各部分别称质量后,棉株经75%酒精浸泡2 min,无菌水漂洗3次后剪成小块于无菌研钵中充分研磨至匀浆,然后进行10倍稀释,按上述方法每个浓度吸取100 μL涂布培养,菌落长出后,置于光电折射仪上统计绿色荧光的菌落数量,计算含菌量。

因生长至开花时的棉株根茎较硬,不易切片,所以按上述方法播种棉种后于棉株2叶期进行浇菌处理。选择处理第1天和第5天的棉株,用无菌水清洗表面泥土,采用徒手切片法制片,在激光扫描共聚焦显微镜(Leica,DE)下观察GFP标记菌株在棉株体内的定殖情况。
1.5 LH-L3-GFP在不同作物体内的定殖
该部分采用叶面涂抹菌液和灌根两种接种方式进行。将蚕豆、小麦、玉米和甘蓝种子表面消毒后,于培养皿中进行催芽,种子出芽3 d时,将其转移至离心管中,并使其根浸泡于4 mL水中,所用物品均经过灭菌处理。
叶面涂抹接种:在确保叶片不被擦伤和离心管中的水不被污染的条件下,用灭菌棉棒蘸取菌液(浓度约为106cfu/mL),轻轻涂抹幼苗的叶片。
灌根接种:加入400 μL菌液(浓度约为107cfu/mL)于离心管的水中。
将处理幼苗置于28 ℃光照培养箱中培养,每处理重复3次。于处理后24 h和72 h取样,稀释涂板检测,方法与1.4一致。
2 结果
2.1 菌株LH-L3的自然转化
按照上述方法,成功将质粒pHT01-P43GFPmut3a导入LH-L3自然感受态细胞中,转化成功的菌株能够在终浓度为10 μg/mL的氯霉素平板上生长,且在光电折射仪上菌落发出绿色荧光(图1)。
2.2 LH-L3-GFP与野生型LH-L3菌株的室内拮抗活性比较
图 1 光电折射仪下LH-L3的GFP标记菌株 Fig.1 GFP-tagged LH-L3 under optical refract meter
野生型菌株LH-L3对多种植物病原菌都有较强的室内拮抗活性,从图2可以看出,与野生型相比较,LH-L3-GFP对病原真菌稻瘟病菌、玉米大斑病菌、黄萎病菌的拮抗力无明显差异,可用于定殖和生物防治的研究。
2.3 LH-L3-GFP在棉花体内和根际的回收监测

W.T为LH-L3野生型菌株,GFP为LH-L3-GFPW.T mean wild type,GFP mean LH-L3-GFP strain图2 LH-L3及其GFP标记菌株的抑菌效果Fig.2 Inhibitory effect of LH-L3 and its GFP-tagged strain on fungal pathogens
通过灌根的方法,接种1 d后,标记菌LH-L3-GFP在棉株各器官上的定殖如图3-D、E、F,在激光共聚焦显微镜下清楚地观察到主根伸长区、茎的薄壁组织,甚至叶部组织中都有标记菌的存在;接种5 d后,荧光信号更加强烈,在茎表皮和皮层中大量聚集。在分离培养实验中,结果与上述切片观察的结果符合,由图4可以看出在处理的第1天,标记菌就能从下至上地侵入,在根表土、根、茎、叶、花朵等器官中回收到的菌落数分别为3.00×105,2.25×105,3.50×104,1.20×102,1.00×102cfu/g;第3、5天时,根表土中标记菌数量有所下降,但至第7天时又出现缓慢上升趋势,定殖数量一直维持在104~105cfu/g;根中标记菌数量除第3天时有所下降,之后一直维持在105cfu/g左右;茎中标记菌数量随处理时间的延长有所变化,但定殖数量一直维持在104cfu/g左右;叶片和花朵中标记菌数量变化不大,后期基本保持不变,均在101~102cfu/g。处理的第50天,仍然可以从棉株体内和根表土中回收到标记菌,说明该GFP标记菌具有很强的稳定性,同时说明菌株LH-L3能够在棉花体内稳定定殖。

A、B、C分别为根、茎、叶对照;D、E、F分别为接种1 d后标记菌在主根伸长区、茎的薄壁组织中、叶部组织中的定殖;G、H、I分别为接种5 d后标记菌在主根伸长区、茎表皮和皮层的定殖、叶海绵组织的定殖A,B and C were root,steam and leaf control,respectively.D,E and F mean colonization in the main root elongation area,parenchyma of the stem and leaf tissue after 1 day of inoculation,respectively.G,H and I mean colonization in the main root elongation area,stem epidermis and cortex and leaf sponge tissue after 5 days of inoculation,respectively图3 LH-L3-GFP在棉花根、茎、叶中的定殖Fig.3 The colonization of GFP-tagged strain,LH-L3-GFP in cotton root,stem and leaf tissues
2.4 LH-L3-GFP在不同作物体内外的回收监测

图4 LH-L3-GFP在棉花体内和根际的定殖Fig.4 The colonization of LH-L3-GFP in cotton parts and root rhizosphere
采用叶面涂抹和灌根的接种方式,分别检测生防菌从叶片定殖至根部、根部定殖至叶片的情况。结果(图5)显示,叶面涂抹标记菌24 h,菌株可到达这4种作物幼苗的茎部;处理72 h菌株可到达小麦、甘蓝幼苗的根部,在蚕豆幼苗体内的定殖能力最强,甚至在浸泡根部的水中都能回收到菌体,在玉米体内的定殖能力稍弱,仅在叶片和茎部检测到菌体的存在。采用灌根接种的方式,依然发现该菌株在蚕豆体内定殖能力较强,处理24 h即可在茎部回收到菌体。除此之外,甘蓝茎部也可回收到菌体,而菌株在小麦、玉米体内仍然只存在于根部;处理72 h菌株均到达这4种作物茎部,叶片上回收不到菌体。因此,该菌株能在蚕豆、小麦、玉米、甘蓝体内定殖,其中在蚕豆体内的定殖能力比在其他3种作物体内的定殖更强。
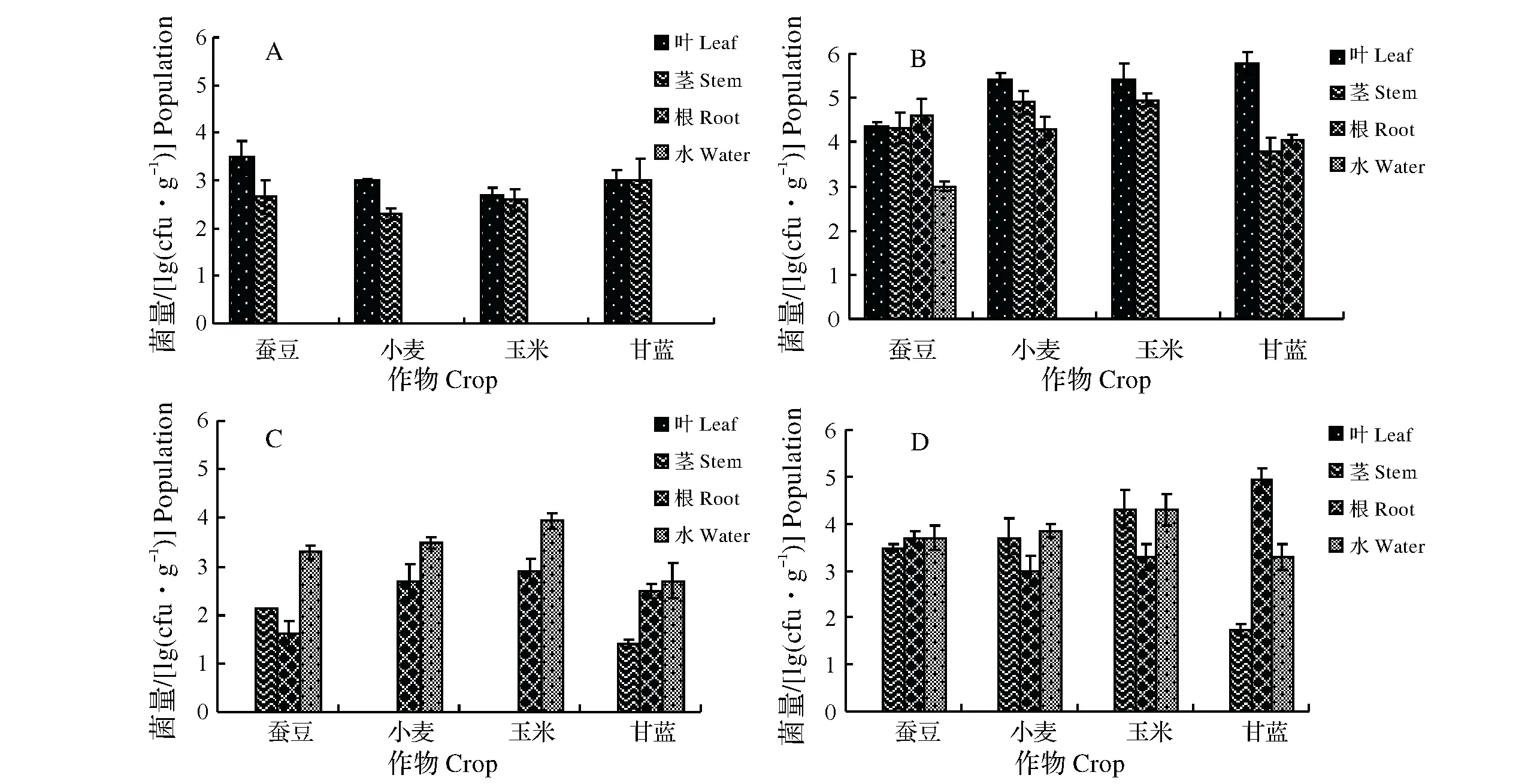
A、B分别为叶面涂抹接种24,72 h标记菌在不同作物体内和体外的回收菌体数量;C、D分别为灌根接种24,72 h标记菌在不同作物体内和体外的回收菌体数量A and B mean the number of bacteria collected in different crops applied to the leaves for 24 hours and 72 hours,respectively.C and D mean the number of bacteria collected in different crops after drenching inoculation for 24 h and 72 h,respectively 图5 LH-L3-GFP在不同作物体内和体外的定殖Fig.5 The colonization of LH-L3-GFP in different crops
3 讨论
从人类意识到化学农药对环境造成的严重危害开始,生物防治就越来越受到重视。目前,有益微生物介入在生物防治领域占有重要地位。这种措施能在改善作物生长和产量的同时确保人们消费和生态环境的安全[10]。生防菌在根际土壤或植株体内中不能成功地定殖,其他所有的抑菌机制都没有真正的生防价值[11]。因此,研究菌株LH-L3在棉株及不同作物上的定殖情况极其重要。
目前,在对生防菌株定殖能力的检测中,使用较多的为抗生素标记法[12]和GFP标记法。与抗生素标记法相比,GFP 标记法具有易于检测、灵敏度高、稳定性较好、构建载体方便等优点,从而受到了科研工作者的广泛应用[13]。由本实验室构建的GFP质粒pHT01-P43GFPmut3a,其芽孢杆菌复制子来源于低拷贝枯草芽孢杆菌质粒pBS72。用该质粒对菌株进行GFP标记,所得菌株稳定性较高。近2个月的取样调查中依然能在玉米组织中回收到标记菌,并且标记菌株生长速率较快[8]。本实验室已使用该质粒对多个生防菌株进行标记[14],成为同时具有荧光特性和氯霉素抗性的标记菌。
本次实验基于前人的基础上,成功对菌株LH-L3进行了GFP标记,并采用浇灌菌液的方法,研究标记菌株LH-L3-GFP在棉株体内的定殖,结果显示菌株在24 h就实现了自下而上的转移,定殖能力由大到小依次为根、茎、花朵和叶,数量呈现“减—增—减”的变化趋势,且根部数量变化波动不大,在跟踪了近两个月的时间内,菌株在棉株的各个器官内均还能检测出,表明LH-L3菌株在棉株体内定殖情况较好。
此外,笔者还研究了菌株在蚕豆、玉米、小麦、油菜上的定殖能力。结果显示菌株在这4种作物上均能定殖,定殖能力由大到小依次为蚕豆、甘蓝、小麦和玉米。涂叶72 h能在整株蚕豆、甚至培养的水中检测出菌的存在,灌根24 h能在蚕豆和甘蓝的茎中检测出菌的存在。出现这种差异可能与棉花、蚕豆、甘蓝都属于双子叶作物有关,因此猜测该菌株在双子叶作物体内的定殖能力优于单子叶作物。而通过灌根接种,在这4种植株叶片上均回收不到菌体,这也有可能是因为到达叶片里的菌量较少,而笔者仍然用同一尺度进行检测,经过研磨稀释后导致浓度过低未检测出来,具体原因仍有待进一步探究。LH-L3的良好定殖能力,为其用于多种作物病害生物防治和促生长提供了条件。
