前庭代偿动物模型方法综述
2019-01-14黄青尹时华
黄青 尹时华
广西医科大学第二附属医院耳鼻咽喉头颈外科(南宁530007)
前庭系统是人体重要的平衡系统,有助于姿势反射和眼动反射的产生,且与空间知觉、空间方向、本体感觉等高级认知过程有关[1]。由于衰老,头部创伤,耳毒性药物或前庭病变导致的前庭传入改变会对平衡控制和凝视稳定性产生影响,这两种功能受损会对患者的生活质量产生重大影响。前庭损伤患者除了眩晕、头晕及与之相关的神经营养症状恶心、呕吐,还有与健康人相比更多的焦虑和抑郁,饱受身体、心理的双重打击,患者常出现停职、社会孤立等严重社会行为障碍[2]。
虽然,眩晕、眼震、平衡障碍等急性前庭综合征在动物和人体中均可通过前庭代偿在数星期或数月得到改善[1]。但前庭系统损伤后的恢复时间(数日到数月不等)和最终恢复水平(症状缓解或消失)都有极大的个体差异,而且内耳前庭的病变大多为不可逆性损害,前庭症状却能随着时间逐渐缓解或消失,这里涉及许多复杂的机制。有研究认为,两侧前庭神经核之间的联合纤维在代偿中有新的突触产生,也有认为参与维持机体平衡的其它中枢神经系统(视觉、小脑、大脑、本体感觉)进行相应调整以弥补两侧前庭神经的不均等传入,但目前其机制还不是十分清楚。因受临床伦理限制,建立合适的动物模型成为研究其机制的重要手段。目前主要的建模方式有:手术切除、化学性迷路破坏、手术+化学方法破坏迷路及空气注射(见表1)。经国内外研究者几十年的努力,已取得了一些成果,但还远远不够,明确前庭的自发功能恢复机制、研究损伤后神经和行为的可塑性,进而把握神经可塑性改变的最佳时间窗并指导临床前庭康复治疗仍然任重而道远,建立相似性高、重复性好的动物模型十分必要。本文现将目前存在的前庭代偿动物模型建立方法进行综述,为前庭代偿机制、中枢神经系统可塑性研究提供基础条件。
1 手术切除动物模型
1.1 单侧迷路切除术(unilaterallabyrinthectomy,UL)
青蛙的迷路器官由三个半规管(外、前、后)、三个黄斑部、两个乳突组成。1995年N.DIERINGER[3]通过上颚经腹侧入路打开青蛙听泡,去除一侧所有迷路器官、神经节前分支,建立迷路部分切除模型,术后表现出严重的姿势紊乱,但没有自发性眼球震颤,之后2个月体位逐渐恢复正常。青蛙因较哺乳动物简单的神经组织和少的行为自由度且脑组织可在体外培养,而更有利于研究前庭代偿,但物种的特殊性使其只能解释部分行为恢复情况,具有局限性。2014年HH Lee等[4]通过对大鼠行UL,建立了前庭代偿模型,具体方法:大鼠麻醉后做耳后缘切口,切除鼓膜和听小骨,在前庭侧壁上造孔,扩大穿孔到完全打开前庭外侧壁,吸出外淋巴液,直到不再漏出,最后用胶原填充内腔,缝合肌肉、皮肤。研究还证实了鼓室内注射浓度大于4%的利多卡因可诱发注射耳前庭反射减退。此模型运用时间较长,可靠性高、相对简单,且实验对象广泛,是比较经典的手术,但缺点在于手术破坏大,致死率高。
1.2 单侧前庭传入神经阻滞术(unilateral vestibular deafferentation,UVD)
2003年Catherine M.Gliddon等[5]运用UVD建立豚鼠前庭代偿模型,并研究证实了UVD后的眼动和体位综合征可激活下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴,推测HPA轴激活程度的差异可能导致前庭症状严重程度和静态补偿时间过程的变化。Libby Lindsay等[6]于2005年通过大鼠耳后入路UVD,建立了前庭代偿模型,具体方法:大鼠麻醉后行耳后切口,打开内听道,在两处烧灼镫骨动脉,钻开耳蜗的球囊、椭圆囊和半规管壶腹,吸出内容物,封闭开口。这种UVD术式可以产生完整的前庭迷路损伤,先前的研究也表明,其产生的行为症状(剧烈的眼震和严重的体位不对称)与其它方法相同[7-10]。同年,RONG ZHANG等[11]运用上述方法,建立大鼠前庭代偿模型,证实了前庭补偿过程中,前庭内侧核中表达胞质糖皮质激素受体的神经元数量、血皮质酮水平均未发生显著变化。此模型优点在于造模成功率高,可产生完整的迷路损伤,缺点在于损伤大,动物术后易感染。
1.3 单侧前庭神经切断术(unilateral vestibular neurotomy,UVN)
1976年M.LACOUR等[12]用狒狒作为实验对象,经颅中窝手术暴露内听道,切断前庭神经,建立前庭代偿模型,证明了积极的感觉运动探索引发的本体感受性肌肉和关节传入对前庭恢复具有重要作用。由UVN引起的姿势、眼运动、感知和神经系统综合征可产生应激,从而激活HPA轴[5,13]。2009年B.TIGHILET等[13]行UVN建立猫前庭代偿模型,具体方法:猫麻醉后行左乳突切开,破坏骨迷路,暴露内听道,在神经节后水平切断前庭神经。术后表现出经典姿势、运动和眼动缺陷,可作为判定前庭神经损害的标准。且这种造模方法产生的单侧前庭神经传入阻滞的完整性在之前的组织学研究中已得到证实[12]。2017年David Péricat等[14]行一侧鼓室入路建立新的大鼠UVN后前庭代偿模型,方法:大鼠麻醉后解剖分离到鼓室,钻孔暴露镫骨动脉和含耳蜗的隆突,分离隆突并暴露耳蜗,随后切除耳蜗骨性部分显露耳蜗神经,修剪扩大耳蜗神经管,然后抽吸第八颅神经(前庭蜗神经),在靠近脑干处切断整根神经,闭合切口。所有动物醒来均出现前庭综合征,包括翻滚行为和自发性眼震。研究证实这是一种新的能导致完全性、不可逆性单侧前庭损伤的大鼠模型。这个模型特别适合研究外周传入神经去除后前庭功能恢复动力学、中枢代偿过程中的神经化学和分子机制,也可用于检查抗眩晕药的疗效。优点在于能诱导前庭完全损伤,其局限性在于需要比UL更多的手术技巧和时间,且可能导致脑损伤[15]。
2 化学性迷路破坏动物模型
2.1 氯仿注射法
2.1.1 氯仿+凡士林油注射法
1982年LAURA PETROSINI等[16]将氯仿和凡士林油溶液注入豚鼠右侧中耳破坏迷路,建立前庭代偿动物模型,并证明了乙醇对早期前庭损伤后的恢复有加速作用。1983年Petrosini L等[17]运用同样的方法,建立了化学性单侧迷路破坏后前庭代偿豚鼠模型,并证实传递外周和本体感受信息到前庭核的上行脊髓通路的普遍激活,有利于迷路切除后重新获得眼和体位的平衡。
2.1.2 氯仿+石蜡油注射法
1997年冯勃等[18]在直视下通过鼓膜向豚鼠一侧中耳注射氯仿和石蜡油混合液,建立化学性迷路破坏后前庭代偿动物模型,证实了在迷路破坏后的48小时,自发性眼震的频率、慢相角速度和头偏斜及失衡行为得分都出现特征性下降的过程。
2.1.3 单纯氯仿注射法
2009年Ishikawa K等[19]在显微镜下向豚鼠左中耳注射氯仿破坏迷路,建立前庭代偿动物模型,证明了视觉传入具有方向选择性,当一侧迷路破坏时损伤侧的视觉传入作为视觉补偿极为重要。
向中耳鼓室注射氯仿,是一种操作简单且经济的化学性迷路破坏术,可用于外周前庭损伤后的中枢代偿机制研究。有学者认为[20],氯仿对内耳具有毒性作用,不能导致迷路破坏,但冯勃等认为注射氯仿后48小时,壶腹嵴毛细胞、球囊及椭圆囊斑轮廓可见,纤毛不完整,冰水试验没有反应,再次注射氯仿没有出现迷路破坏的典型症状,说明前庭功能此时已丧失,注射氯仿后1周及1个月,壶腹嵴毛细胞、囊斑境界不清,嵴帽、纤毛消失,证实了氯仿的化学性迷路切除作用。当然,氯仿对内耳的损伤有待进一步研究其超微结构改变及机制[21]。此模型的优点在于操作简单、经济并且能产生可靠的结果,缺点是氯仿具有耳毒性,耳蜗可能受损,并随时间发生前庭损害。
2.2 对阿散酸及阿散酸钠注射法
2014年Roswitha Beck等[22]通过鼓室内注入对阿散酸建立了大鼠化学性单侧迷路破坏模型,具体方法:大鼠麻醉后行左旁正中切口,经鼓膜向鼓室注入布比卡因溶液,1分钟后吸出,再滴注,重复3次,随后注入对阿散酸溶液,彻底抽吸,缝合皮肤。术后所有动物均表现出急性前庭症状:眼球震颤和姿势不稳,这些症状可随时间逐渐缓解,进一步证明模型建造成功。2016年Andreas Zwergal等[23]用如上相同的方法建立了大鼠前庭代偿模型,证实了大鼠在造模后行为恢复过程(前庭代偿)中脑葡萄糖代谢的动态变化。同年,Moslem Shaabani等[24]向大鼠一侧鼓室注射阿散酸钠,建立单侧迷路破坏动物模型,并证实了前庭电刺激在加速静态和动态前庭代偿方面的有效性,提出其可作为单侧前庭损伤患者的康复治疗。
以往的研究也表明,鼓室内注射阿散酸钠对诱发大鼠单侧或双侧化学性迷路切除有很好的效果[25-27],由此引起的静态(姿势)和动态症状(运动)分别在术后36天、42天恢复,故此建模方法可为前庭代偿方面的实验研究提供长期、可靠的模型,但缺点是阿散酸诱导的毒性可能损害突触联系,且损害是不可逆的,也可能会扭曲同侧前庭核的电生理输入[24]。
2.3 河豚毒素注射法
河豚毒素常被用来短暂性阻断动作电位并封闭前庭神经[28,29]。2011 年 Sophie Dutheil等[30]在手术显微镜下暴露猫左鼓室的圆窗及卵圆窗,注入河豚毒素引起前庭传入神经阻滞,建立前庭代偿动物模型。研究通过比较UVN、UL、单侧注射河豚毒素三种建模方法,证实前庭神经核只在急性和完全前庭损伤(UVN)后表现神经性潜能,前庭传入神经阻滞较轻微(UL,河豚毒素注射)时,表现非结构性可塑性过程。此模型受河豚毒素剂量的影响较大,可逆阻断前庭神经传入,模型不稳定。
3 手术+化学方法破坏迷路动物模型
3.1 UVD+乙醇化学破坏
2004年Arata Horii等[31]通过UVD+乙醇化学破坏迷路,建立大鼠前庭代偿模型,方法:大鼠麻醉后行耳后入路,依次去除鼓膜、锤骨、砧骨,从钻孔的前庭和卵圆窗腹侧吸出迷路液,乙醇冲洗迷路,并证实了UVD后6小时(术后检测时间依据既往大鼠行为补偿数据∶UVD后6 h为急性期,自发性眼球震颤剧烈、头部倾斜严重,属于未代偿阶段[32,33])双侧前庭核复合体基因的不对称表达。此模型造模成功率高,迷路破坏完整,但手术创伤性大,动物易感染致死。
3.2 UL+氯仿化学破坏
2006年张亚民等[34]通过手术加氯仿破坏迷路,建立了大鼠前庭代偿模型,方法:大鼠麻醉后做耳后切口,依次打开听泡、前庭,破坏并吸除耳石器和壶腹嵴,最后填充浸有氯仿的明胶海绵,缝合切口。术后大鼠出现自发性眼震、头偏斜、失衡行为等急性前庭功能丧失症状。之后眼震频率逐渐下降,头偏斜和失衡行为评分的变化与其均一致,进一步说明模型建造成功,动物出现了前庭代偿。此建模方法可靠、经济,且技术成熟,缺点在于对动物有损伤,且氯仿具有耳毒性。
3.3 UL+乙醇化学破坏
1997年Tadashi Kitahara等[35]采用UL+乙醇化学破坏,建立了大鼠前庭代偿模型,方法:大鼠麻醉后做右耳后切口,取出鼓膜、锤骨和砧骨,移除镫骨足板、打开卵圆窗,在水平半规管上钻一个开口,通过这两个开口,手术切除膜迷路,注射乙醇,最后缝合切口。组织学研究表明迷路完全受损,并未损伤邻近脑组织[35],且运用此模型Tadashi Kitahara研究证实了上调小脑小叶单极刷细胞中一氧化氮的量可促进前庭代偿。2013年Wen Zhou等[36]采用同样的方法,建立大鼠前庭代偿模型,并证实术后第1天,同侧前庭内侧核mGluR7下调、小叶mGluR2上调,认为mGluR2和mGluR7可能有助于前庭损伤后前庭内侧核自发静息电位的早期再平衡。2016年Andreas Zwergal等[23]采用左旁正中切口通过UL+乙醇破坏迷路,建立大鼠前庭代偿模型,通过此模型证实了迷路破坏后传入神经阻滞诱导的可塑性,主要表现在脑干前庭核的早期再平衡,也涉及丘脑-皮质和边缘区。此方法造模的优点在于方法成熟,已有研究证实迷路完全破坏,造模成功率高,缺点在于受术者解剖知识及熟练程度的影响较大,且代偿时间短,不便于研究临床上需要数月才能恢复的前庭损伤后代偿机制。
3.4 UL+庆大霉素化学破坏
2017年Patrick P.Hübner等[37]采用UL+庆大霉素化学破坏,建立小鼠前庭代偿模型,具体方法:小鼠麻醉后做左耳前切口,去除鼓膜、锤骨和砧骨,扩大鼓室骨环,灼烧去除镫骨动脉,将内、外淋巴液吸出前庭,去除外半规管和前半规管的感觉上皮细胞,最后用浸有庆大霉素的明胶海绵填塞前庭,缝合皮肤。通过此模型研究证实了表达在前庭的α9烟碱型乙酰胆碱受体功能丧失,可影响动物术后的前庭-眼反射补偿。此模型同UL+氯仿,庆大霉素也具有耳毒性。
4 其它
4.1 空气注射法
2010年R.HESKIN-SWEEZIE等[38]采用空气注射法造成小鼠前庭损伤,具体方法:小鼠麻醉后做右耳后切口,在水平半规管钻孔,钝针插入孔口,反复注射空气,直到不再排出内淋巴液,最后骨蜡密封,缝合切口。并证明γ-氨基丁酸B型受体有助于单侧外周损毁后静态前庭反射的补偿,对动态补偿没有持久的影响。通过空气注射法诱导小鼠前庭代偿造模成功率达95%[38],造模时间短,但会导致感觉上皮受损,且关于此法诱导的前庭代偿文献报道较少。
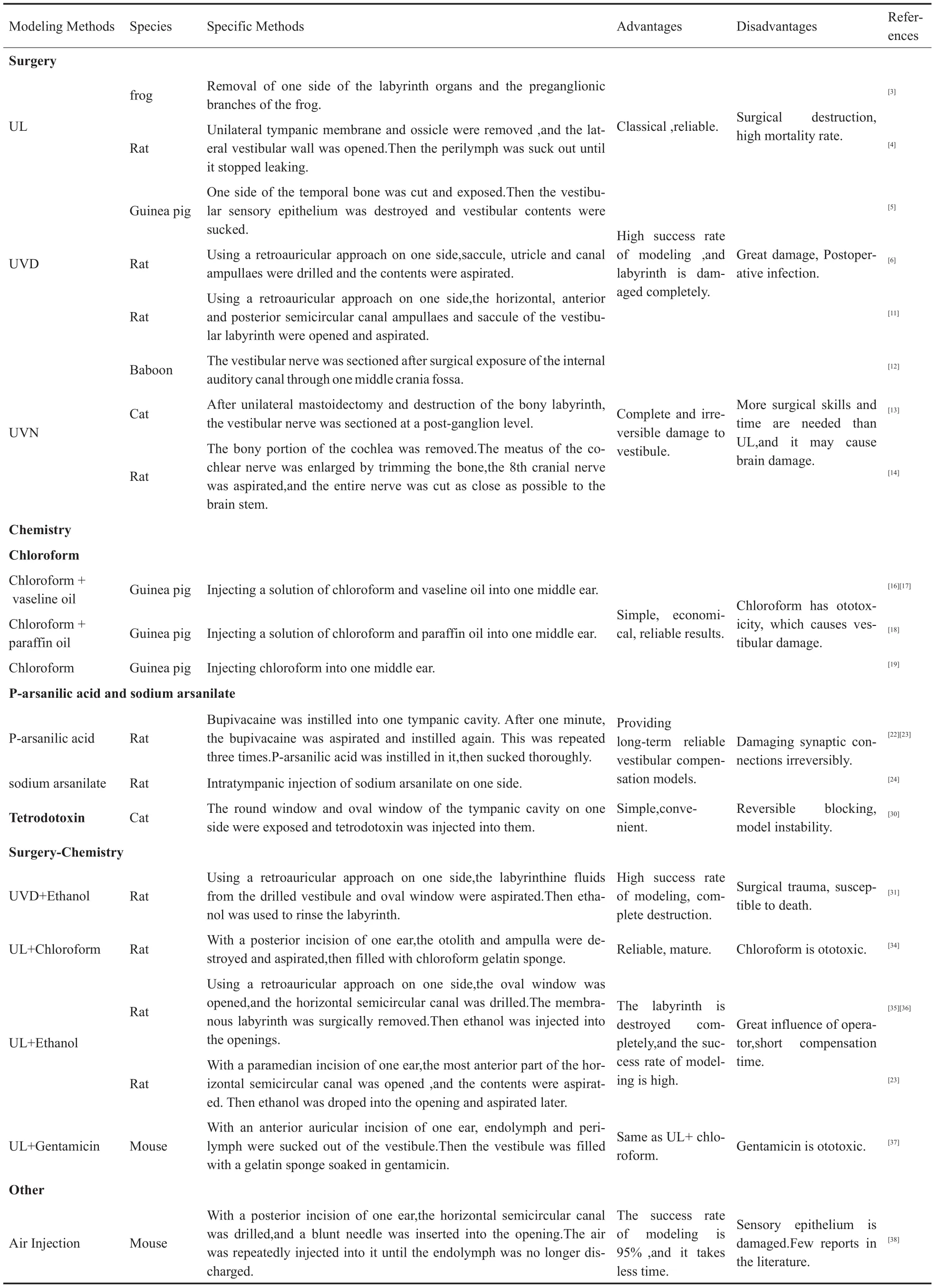
表1 前庭代偿动物模型Table 1 Vestibular compensation animal model
5 结语
前庭代偿是外周前庭受损后研究中枢神经系统可塑性、脑受损后探究机能修复的理想模型,且弄清前庭代偿机制对提高前庭疾病的治疗效果意义重大。因此,建立可靠的前庭代偿动物模型十分必要。文中系统阐述基于不同的动物(大鼠、豚鼠、猫、小鼠、狒狒、青蛙)、不同的方法(手术切除、化学性迷路破坏、手术+化学方法破坏迷路、空气注射)建立的前庭代偿动物模型(见表1)。手术切除法运用时间长,建模方法成熟,可靠性高,但具有侵入性,可能会导致脑损伤,且受术者手术技术的影响。化学方法破坏迷路是一种快速、方便且能产生可靠结果的方法,氯仿作为一种有机溶剂,有比较强的细胞毒作用,很早就被用来注射入中耳诱发急性迷路切除综合征,但随着时间的推移可能会产生前庭损伤。空气注射法是一种更加经济的新型造模方法,同样也能诱发前庭损伤后的症状,但文献报道较少。手术+化学方法破坏迷路在上述造模手段的基础上进一步改进,造模成功率较高,能更有效的、更完整的破坏迷路,其研究结果也表明这种方法是可靠的。
而目前运用较多的造模方法有UVN、对阿散酸及阿散酸钠注射法和UL/UVD+乙醇化学破坏法。UVN因其完全的、不可逆的单侧前庭损伤而成为可靠的前庭代偿动物造模方法,单纯的UL和UVD因存在手术迷路破坏不完整的可能性现已较少使用;对阿散酸及阿散酸钠注射法因其操作简单、结果可靠也运用于前庭代偿动物造模,而氯仿因具有细胞毒作用且随时间致前庭损害,现已较少使用;UL/UVD+乙醇化学破坏法因其能更完整、更有效的损坏迷路而在前庭代偿动物实验研究的造模中广泛运用。本课题组前期研究,运用手术切除+乙醇化学破坏成功建立了豚鼠前庭代偿模型,并验证了豚鼠前庭内侧核存在毒蕈碱受体M2、M3亚型,推测其可能对早期前庭代偿正常进行有促进作用[39]。但手术+化学方法破坏迷路仍存在一些缺陷和风险,如:术前麻醉致死、术中损伤镫骨动脉动物出血死亡、手术内耳受损致动物耳聋、术后感染等。通过上述前庭代偿动物模型,已有一些研究成果产生并应用于临床(如倍他司汀),但还远远不够,且目前这些动物模型仍有一些不足,还未有公认的标准模型产生。因此深入研究前庭代偿机制和中枢神经系统可塑性,建立相似性高、重复性好的前庭代偿动物模型,采用更加规范、实用、客观的急性前庭综合征评价方法和指标,是今后进一步努力和完善的方向。
