6278例育龄妇女常见非综合征性耳聋基因突变检测结果分析
2019-01-14赵艳辉张萌韩瑞樊婷婷庞泓
赵艳辉 张萌 韩瑞 樊婷婷 庞泓
辽宁省沈阳市妇婴医院遗传科
耳聋位居各类残疾之首,我国听力残疾者高达2780万[1],新生儿耳聋发生率为1‰-3‰,即以每年新生3万聋儿的速度增长[2]。耳聋按病因可分为遗传性和非遗传性,60%以上的新生聋儿是由遗传因素导致,涉及常染色体隐性遗传、常染色体显性遗传、线粒体及X连锁遗传[3-4]。研究表明:耳聋基因突变热点在不同种族、不同地区的人群中有明显的差异。而中国人群的聋病分子流行病学调查显示:我国常见的耳聋相关基因包括GJB2、SLC26A4、mt12s rRNA及GJB3[5]。本研究采用耳聋基因芯片技术对沈阳地区6278例听力正常的孕早期妇女进行中国人常见的4个耳聋基因9个突变位点的检测及分析,探讨遗传性耳聋基因的突变热点和各位点突变频率在本地区的分布情况,为本地区开展遗传咨询及耳聋的防治工作提供参考。
1 对象和方法
1.1 研究对象
选择2014年7月-2017年6月至沈阳市妇婴医院就诊的孕早期孕妇6278例(24-45岁),抽取静脉血2-3ml;对检测到携带耳聋基因(GJB2、SLC26A4)突变孕妇的配偶(23-47岁),抽取静脉血4-6ml。如检测到夫妻双方携带不同的基因突变,则再次采集孕妇静脉血4-6ml。所有采血环节前均经知情选择后签署知情同意书。
1.2 研究方法
1.2.1 DNA提取
静脉血采集后EDTA抗凝,DNA应用试剂盒进行提取(北京康为世纪生物科技有限公司),提取DNA 使浓度在 100-200ng/μl,纯度 OD260/280在1.7-2.0之间。
1.2.2 聚合酶链反应(PCR)
扩增针对9个突变位点的9组引物分成A和B两个反应体系分别进行多重PCR。将晶芯九项遗传性耳聋基因芯片检测试剂盒(北京博奥生物有限公司)中的PCR扩增引物混合物和试剂混合物分别充分混合(A、B管),分装,每个17μl反应体系中加入3 ul的样品DNA。预变性处理:37℃10min,95℃15min,96℃1min;扩增条件:94℃30s、55℃30 s、70℃45s共32个循环,60℃10 min。在扩增过程中,参数设置使温度以0.4℃/s的速度从94℃降温至55℃;以0.2℃/s的速度从55℃升温至70℃。
1.2.3 杂交
PCR产物95℃变性5 min,立即浸入冰水混合物中冰浴3 min。从A、B两个扩增体系管中各取2.5μl加入到10μl杂交缓冲液管中,充分混匀并瞬离。将混合液通过盖片加样孔加到芯片的点样区域,此过程不能产生气泡,封闭杂交盒,然后放入50℃预热杂交仪中保温l h。
1.2.4 洗片
取出芯片,放入芯片架中,在洗片机中洗涤,程序为:洗涤液I,42℃2 min,洗涤液II,42℃1 min 2次。1 000g离心2 min甩干。
1.2.5 芯片扫描及判读
用晶芯LuxScan 10K-B微阵列芯片扫描仪对芯片进行扫描,针对遗传性耳聋常见的9个突变位点,若在同位点中探针W出现阳性信号,判读为该位点野生型;M出现阳性信号,判读为该位点纯合突变型;两者均出现阳性信号,判读为该位点杂合突变型。对于线粒体DNA12SrRNA基因突变位点,M出现阳性信号判读为同质突变,两者均出现阳性信号判读为异质突变。
1.2.6 基因测序(PCR产物直接测序)
根据芯片结果,对适用人群针对GJB2和SLC26A4基因进行测序。PCR产物纯化采用Exo-SAP-IT酶处理。去除多余游离PCR引物和底物dNTPs;即在每个反应管中加入3ul ExoSAP-IT,低速离心混合后,置PCR仪37℃30min→80℃15 min→4℃,纯化处理后的产物作为测序反应模板。测序反应采用10 ul反应体系,包含8ul测序引物和2 ul经ExoSAP-IT处理过的PCR产物,反应条件为:96℃20 s、50℃30 s、60℃2 min共25个循环。测序反应的产物用醋酸钠/乙醇法沉淀。加入15ul甲酰胺溶液(Hi-Di Formam-ide),在PCR仪上95℃变性3 min。反应产物采用双脱氧链终止法在测序仪(Applied Bio systems 3130,美国)上进行测序,将测序结果与标准序列进行比对。
2 结果
2.1 孕妇基因芯片检测结果
6278例正常听力孕早期妇女中,检出常见耳聋基因突变者294例(实际孕妇人数为292例,其中2例患者为GJB2基因和SLC26A4基因的双杂合突变携带者)。突变携带率4.68%,其中GJB2基因154例(2.46%,154/6278)、GJB3基因18例(0.29%,18/6278)、SLC26A4基因 110例(1.75%,110/6278)和线粒体12S rRNA基因12例(0.18%,12/6278),各个基因位点突变的分布情况见表1。
2.2 配偶相应基因测序结果
290例孕妇的配偶需要进行相关基因的测序检测,实际进行检测的配偶人数为187例,检测到基因突变携带者20例(见表2)。根据丈夫测序结果,需要孕妇再次采血进行相关基因测序检测的孕妇人数为9例,实际检测人数9例,均未检测到芯片结果以外的位点突变。
2.3 产前诊断结果
经上述检测,发现基因型冲突的家庭共11组,经充分遗传咨询,夫妇知情选择后,进行产前诊断的家庭5组,检测到胎儿携带同一基因纯合突变/复合杂合突变者2例,胎儿携带杂合突变者2例;胎儿未携带突变者1例。具体情况见表3。患者的测序结果及基因芯片检测结果见图1、图2。
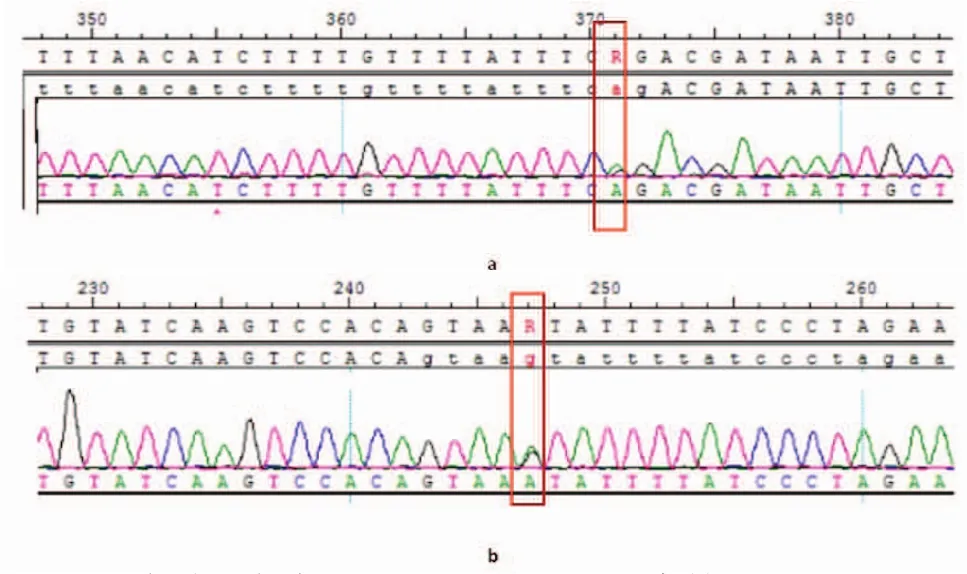
图1 产前诊断家庭7 SLC26A4基因测序结果图Fig.1 SLC26A4 gene sequencing.Results of family 7
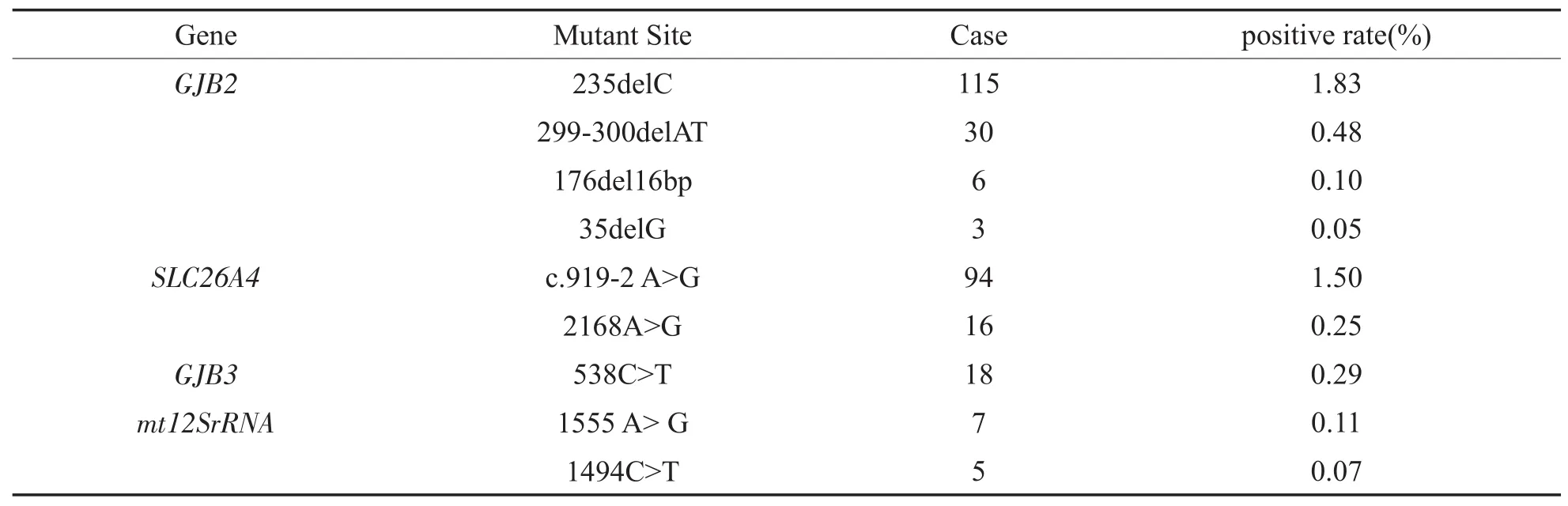
表1 294例正常听力孕早期妇女各个基因位点突变种类、例数及占比Table 1 Mutation types,number and proportion of each gene locus in 294 normal hearing women in early pregnancy
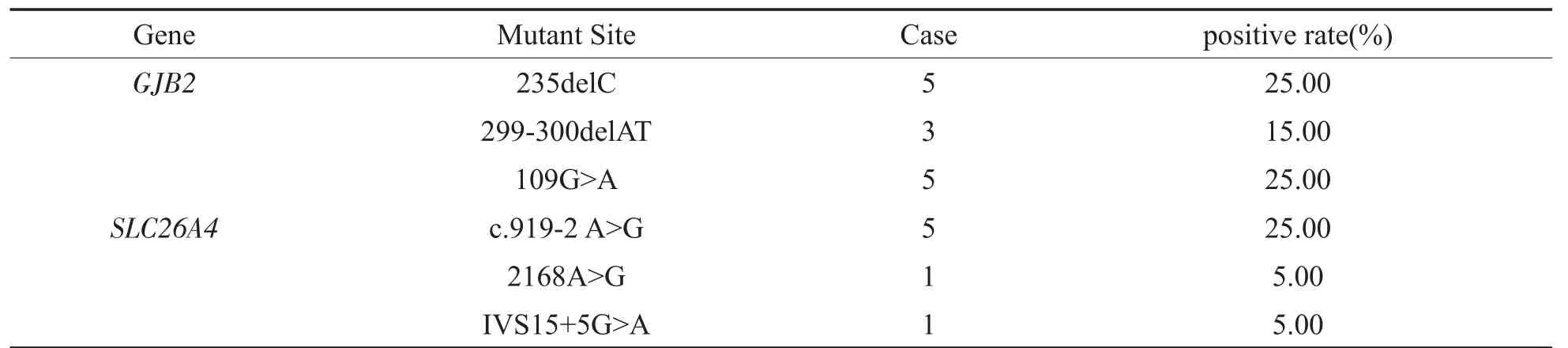
表2 20例携带基因突变的孕妇丈夫相关基因测序情况Table 2 Related gene sequencing.Results of husbands of pregnant women with gene mutation
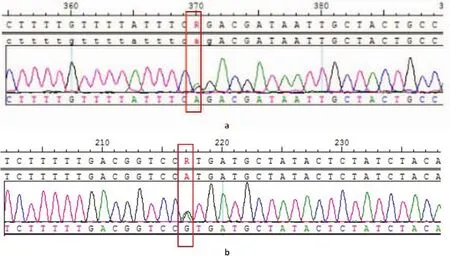
图2 产前诊断家庭8 SLC26A4基因测序结果图Fig.2 SLC26A4 gene sequencing.Results of family 8
2.4 随访结果
2.4.1 在随访到的孕妇携带基因突变、而丈夫相应基因检测结果未见异常或丈夫突变基因与孕妇本人不同的患者中,暂未发现新生儿有听力异常者。
2.4.2 在已进行产前诊断的患者中,胎儿产前诊断结果为单一位点杂合突变或未携带基因突变的3例新生儿中,生后听力暂未见异常。
2.4.3 在6例孕妇与丈夫基因型冲突、但孕妇拒绝产前诊断的患者中,2例拒绝随访;在4例随访患者中,后续发生自然流产1例;听力筛查未通过、后诊断为大前庭水管1例,已进行人工耳蜗植入;另外2例新生儿暂未见异常。
3 讨论
耳聋依据是否伴有耳外组织的异常或病变可将其分为综合征性耳聋(syndromic hearing loss,SHL)和非综合征性耳聋(non-syndromic hearing loss,NSHL),NSHL占70%以上[5]。目前已明确的耳聋基因位点有307个[6],定位了近200个NSHL相关位点,涉及66个常染色体隐性基因、36个常染色体显性基因、5个X连锁基因[7]。在我国,常见的耳聋相关基因及突变热点包括GJB2(35delG、176del16bP、235delC 及 299-300delAT)、SLC26A4(c.919-2 A>G、2168A>G)、GJB3(538C>T)和线粒体DNA12SrRNA(A1555G),导致的耳聋病例占30%-40%左右[8]。
GJB2基因主要生物学功能为编码缝隙连接蛋白26,发生突变后产生了没有生物活性的蛋白质,从而影响缝隙连接蛋白所组成通道的正常功能,导致细胞间信息的传递受阻,细胞外钾离子回流受到影响,进而影响了耳蜗毛细胞的电生理活动,从而导致听力下降[9-11]。SLC26A4基因突变是仅次于GJB2突变引起的常染色体隐性遗传耳聋的病因,是内耳最常见畸形——大前庭水管的致病原因。该基因编码离子转运相关蛋白,在机体离子成分平衡的维持中发挥重要作用[12-13]。本研究发现本地区育龄妇女中,GJB2基因突变的携带率为2.45%,以235 del C(115例,1.83%)最多,符合235delC为国内最常见基因突变的结论[14-16];SLC26A4基因在听力正常孕妇人群的突变携带率为1.74%,以c.919-2 A>G突变最常见(94例,1.50%),均与文献报道相似[16-18]。同时,在对携带GJB2基因及SLC26A4基因突变的孕妇配偶的基因检测中,除了发现常见位点的突变外,我们还发现了GJB2基因109G>A突变及SLC26A4基因IVS15+5G>A的突变,前者与迟发型耳聋密切相关,提示携带者应进行听力的保护及监测,避免或延缓耳聋的发生;后者引起SLC26A4基因编码的mRNA发生剪接位点的改变,从而导致耳聋的发生。这一结果也提示我们:拓展耳聋基因检测的位点,有望进一步提高耳聋相关基因突变的检出率,从而更好地对孕妇及家庭进行指导[19]。
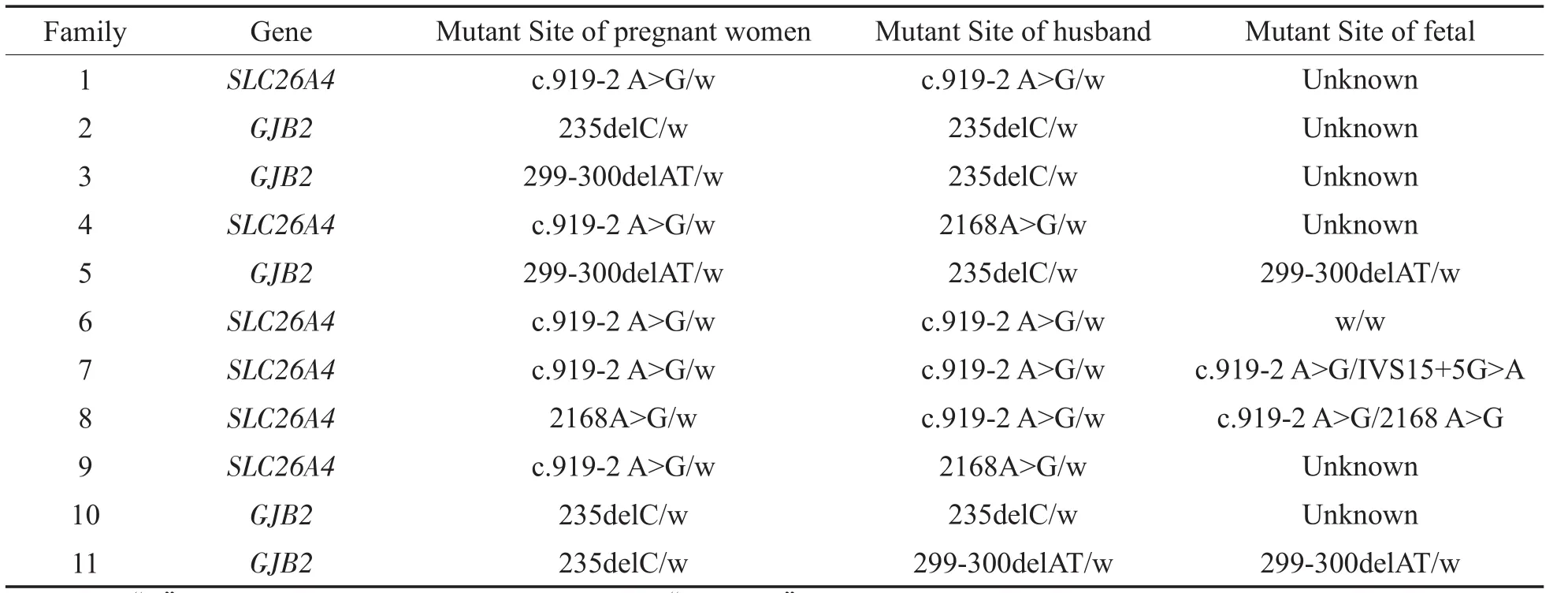
表3 需进行产前诊断家庭基因型分布情况及部分产前诊断结果Table 3 Genotype distribution of Prenatal diagnosis is needed for family and partial prenatal diagnosis.Results
GJB3基因是1998年我国科学家夏家辉院士克隆的第一个“本土基因”[20],该基因538C>T位点的突变被认为与显性遗传高频听力下降有关。线粒体作为真核细胞的能量中心,在细胞生理活动中发挥着重要的作用,在耳蜗的外毛细胞、支持细胞中都含有大量的线粒体,当发生1555A>G或1494C>T突变后,使得线粒体12SrRNA高度保守编码区域的结构发生了改变,使得它更像细菌核糖体基因,从而导致它与氨基糖甙类抗生素结合能力增强,阻碍了线粒体核糖体蛋白质的合成,使氧化磷酸化过程受阻,进而导致听毛细胞逐渐死亡,结果引起永久性聋[21]。本研究人群中线粒体基因突变的检出率为0.18%,均为异质性,以1555A>G突变最为常见(7例,0.11%),略低于柳红杰[18]研究结果0.24%(13/5 338)。对筛查出的12例线粒体12SrRNA突变者,均告知患者本人及所有母系家庭成员终生不能使用氨基糖苷类药物,避免发生“一针致聋”的悲剧。同时也提示临床医生在使用氨基糖苷类药物前检测线粒体12SrRNA是否存在突变非常必要。
由于77%的NSHL为常染色体隐性遗传方式,很多无耳聋家族史的人群为隐性耳聋基因携带人群,所以对听力正常生育年龄人群进行常见耳聋基因筛查非常必要。首先对育龄妇女进行常见非综合征性耳聋基因突变检测,通过耳聋高危人群配偶的筛查与诊断、遗传咨询,必要时进行植入前诊断,可以根本上降低先天性耳聋患儿的发生率。因为本研究中6个家庭选择放弃产前诊断,暂时无法获知胎儿耳聋风险,由于尚未分娩,暂时亦无法获知生后听力情况。筛查高风险人群的产前诊断率仅为45.45%(5/11),在进行常见耳聋基因产前诊断的家庭中,发现胎儿耳聋风险100%的家庭高达40%(2/5)。结合后续随访结果,在高风险人群中,胎儿发生耳聋的比例为33.33%(3/9)。所以,加大对耳聋高风险人群的宣教、咨询力度,使他们对遗传性耳聋有一个清楚地认知、对进行产前诊断的必要性有更深入的了解非常必要。
先天性耳聋的危害不仅在于致“聋”,更在于致“哑”。因先天性耳聋患儿在语言发育的关键时期缺乏听觉刺激,导致发音、构音障碍,进一步影响语言、智力、情感等心理发育和社会交往能力,给患儿家庭及社会带来沉重的负担[22]。所以,做好耳聋的三级防控工作至关重要。研究表明:如果能够在先天性耳聋儿童出生后6个月内发现并适当干预,患儿语言功能基本不受影响[23,24]。因此,做好耳聋的三级预防环节,在语言发育关键期之前实施干预和康复等非常必要,可以降低致残率。作为出生缺陷二级预防,通过对高危孕产妇进行产前耳聋基因筛查和诊断,可以早期预警遗传性耳聋,早诊断、早干预、早治疗,给家庭一个知情选择的机会,也为家庭接受耳聋患儿提供准备的时间,包括思想上的接受及治疗经费上的准备等等,为及早干预提供有利条件,并为防止语前聋、降低耳聋出生缺陷奠定基础;另一方面可以预警药物性耳聋,从而避免因接触耳毒性药物所致听力损失的发生[25,26]。
近年来,随着技术不断更新,检测基因及热点位点逐渐增加,将会对携带者检出率大大提高,从而提高耳聋的检出率,更好的明确耳聋致病基因。同时随着高通量测序技术的快速发展,大规模耳聋基因平行测序技术为临床耳聋基因诊断带来了革命性的发展机遇,可一次性针对绝大多数已知耳聋基因进行高通量全序列突变检测。基于大规模测序的遗传性聋精准诊断面临着一系列问题,如测序发现的大量基因变异与耳聋表型的相关性有待深入研究[27];结果需要其他方法验证;而且灵敏度、特异度有待提高,尚无法大规模用于临床检测[28]。目前,中国的科学家们正致力于建立大规模的中国耳聋人群基因变异数据库,建立适用于中国人群耳聋基因大规模平行测序诊断流程,通过大样本的测序发现和弥补大规模平行测序的不足,相信会为今后耳聋基因研究和临床基因诊断的发展和完善提供可靠的技术保证。
