基于密码子优化策略的厚壳贻贝几丁质酶原核重组表达及功能
2019-01-14刘宏汉侯召东王恒伟范美华王健鑫
刘宏汉,侯召东,王恒伟,范美华,王健鑫,廖 智
(1.浙江海洋大学海洋科学与技术学院,海洋生物蛋白质工程实验室,浙江舟山 316022;2.浙江海洋大学创新应用研究院,浙江舟山 316021)
作为地球上最重要的碳源物质,几丁质是世界上最丰富的生物大分子之一,对地球的碳循环以及生态系统的维持具有极为重要的意义。几丁质酶是催化水解几丁质中β-1,4糖苷键的酶,在生物中广泛存在[1]。根据几丁质酶的催化特点,可以分为内切酶和外切酶两大类,两者的催化位点存在差异[2]。不同物种来源的几丁质酶存在明显的功能多样性。例如,微生物几丁质酶主要与其细胞壁合成,营养有关[3-5];昆虫几丁质酶则与昆虫的发育以及蜕皮有关[6];植物几丁质酶与植物的生长发育以及免疫有关[7];人体中的几丁质酶则被认为与免疫防御以及部分疾病有关[8-12];因而在临床上具有重要的研究意义;此外,部分生物的抗菌肽也发现具有几丁质酶类似结构域,如Tachycitin[13]、Penaeidin[14]等均具有几丁质结合结构域,这也进一步证实了几丁质酶参与了免疫功能。在贝类中,几丁质酶还被发现与贝壳的形成有关联,属于贝壳基质蛋白的一种,参与了贝壳中几丁质的代谢[15]。这表明在贝类中,几丁质酶也参与了多种生物学功能,因此,对贝类几丁质酶的研究有助于了解这一分子的分子机化机制。
厚壳贻贝Mytilus coruscus是我国重要的养殖贝类,在前期工作中,从厚壳贻贝血清中分离到一种抗菌肽,该抗菌肽分子量为6.3 kDa,序列全长为54个氨基酸残基,其序列中含有典型的几丁质结合结构域,因而命名为mytichitin-CB[17];该抗菌肽的全长cDNA基因(命名为mytichitin-1)经克隆后发现该基因编码一段由446个氨基酸残基组成的前体蛋白,该前体蛋白与来自其他物种的几丁质酶具有较高的序列相似性[17];而之前鉴定的抗菌肽mytichitin-CB是该前体蛋白C端55个残基的裂解产物。这表明厚壳贻贝几丁质酶mytichitin-1存在体内裂解现象,即厚壳贻贝几丁质酶通过将其C端的几丁质结合结构域(mytichitin-CB)裂解,并释放入血液,作为抗菌肽参与厚壳贻贝的免疫防御。这也是首次发现几丁质酶存在体内裂解现象,该现象与鱼类组蛋白样抗菌肽的产生机制类似[18]。上述结果表明厚壳贻贝mytichitin可能是一种多功能的几丁质酶,但是由于mytichitin在厚壳贻贝体内含量极低,因此很难通过常规的蛋白质分离纯化手段获得天然mytichitin开展研究。重组表达是获取蛋白质分子的重要手段。目前几丁质酶的重组表达已先后在大肠杆菌[19],酵母[20],昆虫细胞[21],植物[22]等表达体系中获得成功。上述表达体系中,大肠杆菌重组表达依然是最为成熟的表达策略,但是面临的一个问题就是大肠杆菌存在密码子偏爱性而导致在表达真核生物的重组蛋白时存在效率低下甚至表达不成功的问题[23-24]。解决这一问题的主要办法是将目标基因的密码子替换为大肠杆菌偏爱密码子[25]。为此,采取了密码子优化策略,对厚壳贻贝mytichitin-1基因按照大肠杆菌偏爱密码子进行了重新设计和优化;进一步利用原核重组表达策略,获得厚壳贻贝mytichitin-1重组蛋白,在此基础上,对厚壳贻贝重组mytichitin-1开展了分离纯化、鉴定及功能分析。上述研究结果为后续几丁质酶的分子改造以及相关功能机制研究奠定了基础。
1 材料与方法
1.1 厚壳贻贝几丁质酶全酶目标基因的设计、优化与合成
厚壳贻贝几丁质酶mytichitin-1基因全长为1 341 bp,其genebank数据库编号为AHC08445,编码一个含有信号肽序列的446个氨基酸残基组成的前体蛋白。去除其信号肽序列后,其成熟肽序列基因总长为1 266 bp(含终止密码子)。根据厚壳贻贝几丁质酶成熟肽基因序列设计表达目标基因,采用大肠杆菌表达体系开展重组表达研究。因贻贝为真核生物,因此,采用大肠杆菌偏爱密码子替代目标基因中的部分密码子;同时,结合pET-28a表达质粒的序列特征和插入位点,在目标基因的两端设计并添加了酶切位点和六聚His标签。其中,在目标基因5’端设计Nco I(CCATGG)酶切位点序列和多聚组氨酸标签序列(CATCATCATCATCATCAC),为防止阅读框移位,在Nco I酶切位点和多聚组氨酸标签序列之间添加保护碱基CA;此外,在目标基因3’端终止密码子(TAA)之后添加Xho I(CTCGAG)酶切位点;设计后的目标基因序列利用DNA化学合成技术由南京金斯瑞公司合成。
合成后的目标基因经测序验证无误后,采用Nco I和Xho I进行双酶切。表达载体pET28a同样经Nco I和Xho I双酶切。采用T4-DNA连接酶将纯化后的目标基因与pET28a质粒酶切片段进行连接;连接产物转化至大肠杆菌DH5α感受态细胞中,涂布于含卡那霉素抗性的LB平板上,37°C过夜培养。挑取单克隆进行菌落PCR鉴定,阳性克隆送上海生工生物公司测序验证。
1.2 重组mytichitin-1蛋白的表达、复性及分离纯化
将成功构建的重组表达质粒转化到大肠杆菌BL21(DE3)表达菌株感受态细胞中,涂布于含卡纳霉素的LB平板培养基中,37°C培养过夜。挑取单克隆菌落,于相应抗性的LB液体培养基中培养过夜。菌液按照1:100比例扩大培养。设置37°C和15°C两种培养温度分别培养,转速为200 r/min。在菌液OD630值为0.6~0.8时加入IPTG(1 mmol/L)进行诱导。37°C培养的菌株IPTG诱导时间为4 h;15°C培养的菌株IPTG诱导时间为16 h。
IPTG诱导结束后,收集菌液于1 000×g离心10 min,用预冷的PBS缓冲液洗涤,收集菌体并以裂解液(10 mmol/L 咪唑,50 mmol/L PBS,0.1 mol/L NaCl,1 mmol/L EDTA,pH 8.0)重悬,冰浴超声破碎(工作 10 s,间隙10 s,工作90次),低温8 000×g离心15 min分别收集上清和沉淀(包涵体)。以缓冲液A(10 mmol/L咪唑,8 mol/L 尿素,0.1 mol/L NaCl,0.1 mol/L PBS,pH 8.0)溶解包涵体,之后 8 000 ×g离心 15 min,收集上清液,经0.45 μm微孔膜过滤后上样预先经缓冲液A平衡的镍柱。之后以缓冲液B(30 mmol/L咪唑,8 mol/L尿素,0.1 mol/L NaCl,0.1 mol/L PBS,pH 8.0)洗柱;再以缓冲液 C(300 mmol/L 咪唑,8 mol/L 尿素,0.1 mol/L NaCl,0.1 mol/L PBS,pH 8.0)洗脱目的蛋白。
经镍柱纯化后的目标蛋白采用透析复性策略。分别配置复性液I,II和III,其中复性液I配方为:4 mol/L尿素,0.1 mmol/L氧化型谷胱甘肽,0.9 mmol/L还原型谷胱甘肽,20 mmol/L Tris-HCl,pH 8.0;复性液II配方为:2 mol/L尿素,0.1 mmol/L氧化型谷胱甘肽,0.9 mmol/L还原型谷胱甘肽,20 mmol/L Tris-HCl,pH 8.0;复性液III配方为:0.1 mmol/L氧化型谷胱甘肽,0.9 mmol/L还原型谷胱甘肽,20 mmol/L Tris-HCl,pH 8.0;目的蛋白依次在上述3种复性液中进行4°C搅拌透析(截留分子量为1 kDa),透析时间均为24 h。
复性后的目标蛋白采用反相高效液相色谱进行进一步纯化。高效液相色谱仪为Waters600 E型(美国,Waters公司),检测器为Waters 2487双波长紫外检测器;色谱柱为C8反相色谱柱(Vydac,218TP);采用线性梯度洗脱,即B液(含0.1%三氟乙酸的乙腈)在30 min内,其比例由20%上升至50%,A液为含0.1%三氟乙酸的纯水;流速为1 mL/min;检测波长为280 nm。
1.3 重组mytichitin-1的鉴定
SDS-PAGE采用4%浓缩胶结合12%分离胶,样品事先以电泳上样缓冲液(上海生工公司)溶解;以牛血清白蛋白(上海生工公司)作为定量分析对照;样品上样量为15 μL。采用80 v浓缩胶和120 v分离胶的恒压模式电泳。电泳结束后以考马斯亮蓝R250进行胶染色并观察。
Western印迹分析按如下方法进行。首先将电泳分离后的蛋白胶转印至PVDF膜。因所表达的目标蛋白含有多聚组氨酸标签(His-tag),因此,膜经洗涤和封闭后,采用鼠抗His-tag抗体(南京金斯瑞公司,货号A00186)进行孵育过夜,之后再加入辣根过氧化物酶标记的羊抗鼠二抗(南京金斯瑞公司,货号A00160)孵育60 min,以ECL化学发光试剂进行显影。
对经HPLC纯化后的重组蛋白开展串联质谱分析,用以验证所表达的蛋白的序列是否正确;所用质谱仪为4700型串联飞行时间质谱仪(4700 Proteomics Analyzer TOF/TOFTM,美国Applied Biosystems公司)。蛋白样品经还原烷基化以及胰蛋白酶酶解后上样质谱仪;质谱分析工作电压为20 kV,采用正离子模式,自动模式采集数据。PMF质量扫描范围为700~3 600 Da,以强度最大的8个峰进行二级质谱分析;谱图用myoglobin酶解肽段进行外标校正。根据肽段的理论序列生成理论胰酶酶切肽段质量与肽指纹图进行比对,质量相符的肽段进一步进行串联质谱谱图分析,获得其对应的氨基酸序列并与理论氨基酸序列进行比较。
1.4 重组mytichitin-1的功能分析
几丁质酶的酶解活性采取DNS(3,5-二硝基水杨酸)法测定。几丁质购自sigma公司(货号c9752);重组mytichitin-1样品溶于0.1 M的PBS缓冲液(pH=7),加入底物几丁质后于37°C孵育反应90 min;离心后(12 000 g,10 min),上清液中加入事先配置的DNS溶液(含20%酒石酸钠钾,1%氢氧化钠,0.2%苯酚,0.05%亚硫酸钠和1%的DNS),煮沸反应10 min后测定540 nm吸收值。以标准浓度的N-乙酰氨基葡萄糖(GlcNAc)为底物制作标准曲线,根据标准曲线得到反应产生还原糖的含量并计算相应的酶活力。酶活力单位(U)定义为1 min内产生1 μMN-乙酰氨基葡萄糖所需的酶量。蛋白含量测定采用蛋白质定量试剂盒(上海生工)依据说明书进行。
抑菌活性实验采取生长曲线抑制法进行测定。细菌用LB液体培养基培养至对数生长期(OD630为0.01);重组蛋白样品以灭菌纯水溶解,以纯水作为阴性对照;将样品溶液加入菌液中,终浓度为50 μmol/L,样品和菌液充分混合后置于恒温箱37°C培养10 h。采用酶标仪测定OD630值以衡量多肽对于细菌生长的抑制作用。重组蛋白样品对细菌的相对抑制率根据实验组(1-实验组吸光值/对照组吸光值)×100%进行计算。
几丁质结合活性采取几丁质孵育结合SDS-PAGE法测定。将重组蛋白样品配置成1 mg/mL浓度(样品1);加入适量几丁质,充分震荡混匀后室温下孵育1 h,再经离心处理(4°C,12 000 g,15 min),收集上清液(样品2);沉淀部分加入8 M尿素,震荡混匀1 h后,离心收集上清(样品3)。利用SDS-PAGE分别对样品1、2、3进行电泳分析;分离胶浓度为12%。样品按1:1加入电泳上样缓冲液(上海生工公司);电泳上样量为20 μL;采用120 V恒压模式电泳。电泳结束后以考马斯亮蓝R250进行胶染色并观察。
2 结果
2.1 mytichitin-1基因的设计和密码子优化
天然mytichitin-1的成熟肽区域基因长度为1 266 bp,经重新设计和优化,目标基因长度为1 298 bp,两者的序列比对如图1所示。重新设计的目标基因与天然mytichitin-1序列的一致性为68%。
设计后的目标基因编码一条长度为429个氨基酸残基组成的重组蛋白(图2),与天然mytichitin-1相比,重组mytichitin-1在N端多出一段MAHHHHHH肽段,其余序列与天然mytichitin-1一致。
进一步对优化后的目标基因开展密码子适应指数(Codon Adaptation Index,CAI)分析,结果如图3所示。mytichitin-1基因在优化前,其CAI值经OptimumGeneTM软件在线(http://www.genscript.com.cn/technology-support/on-line-tools)计算,为0.62;经优化后,其CAI值达到了0.97。CAI值大于0.8则意味着该目标基因在大肠杆菌中的表达效率较高[25]。
2.2 重组mytichitin-1的表达、纯化与鉴定
mytichitin-1重组菌经IPTG诱导表达后,收集重组菌菌体,经超声破碎和离心后,上清与沉淀部分分别以SDS-PAGE进行检测,结果如图4所示。从图4A可以看出,目标蛋白主要表达于沉淀部分,呈包涵体表达特征。目标蛋白条带约为50 kDa,与重组mytichitin-1的理论分子量(49.1 kDa)接近。进一步经western blot检测,所表达的目标条带能与抗组氨酸抗体结合并产生特异性亮带,表明所表达的重组myti-chitin-1带有多聚组氨酸标签(图4B)。

图1 重组mytichitin-1基因优化前后核苷酸序列比对图Fig.1 Sequence alignment of mytichitin-1 gene before (seq1)and after (seq2)OptimumGeneTMoptimization
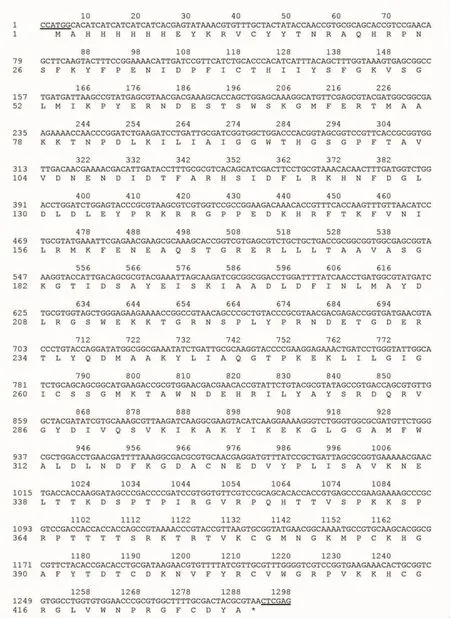
图2 Mytichitin-1基因优化后的核苷酸与推导的氨基酸序列比对图Fig.2 The deduced amino acid sequence of recombinant mytichitin-1 gene
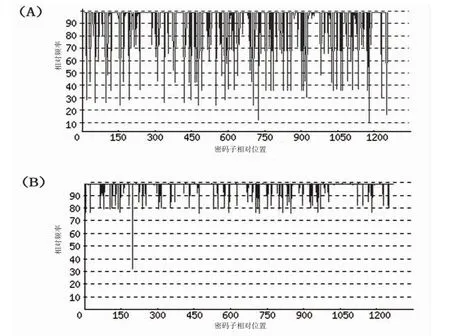
图3 Mytichitin-1基因经优化前后的密码子使用偏好性分布比较图Fig.3 The distribution of codon usage frequency along the gene sequence of mytichitin-1

图4 重组mytichitin-1蛋白在大肠杆菌BL21表达后SDS-PAGE分析(A)和Western blot分析(B)Fig.4 SDS-PAGE with Coomassie blue staining of recombinant myticusin (A)and western blot analysis of recombinant mytichitin-1 (B)
重组mytichitin-1经镍柱分离,以不同浓度的咪唑溶液洗脱,洗脱后的组分以SDS-PAGE进行验证,结果如图5A所示;从图5A可以看出,重组mytichitin-1在镍柱分离时,300 mM咪唑溶液可以充分洗脱目标蛋白;经镍柱纯化后的重组mytichitin-1经复性处理后,再经HPLC纯化,结果如图5B所示。从图5B可以看出,复性后的mytichitin-1经HPLC分离,以单峰形式被洗脱,表明其纯度较高。

图5 重组mytichitin-1分离纯化图谱Fig.5 Isolation and purification of recombinant mytichitin-1
为验证纯化后的mytichitin-1的氨基酸序列,进一步收集目标峰开展酶解后串联质谱分析,共分析3个肽段,分子量分别为 1 703.69(图 6A)、1 831.78(图 6B)和 1 853.80 Da(图 6C);3 个肽段的序列分析结果分别为“-HNFDGLDLDLEYPR-”、“-HNFDGLDLDLEYPRK-”和“-IAADLDFINLMAYDLR-”,分别对应重组mytichitin-1分子序列中第124~137、124~138和194~209肽段;上述结果表明重组蛋白的序列正确,表达成功。

图6 复性及纯化后的重组mytichitin-1质谱分析图Fig.6 LC-MS/MS spectrum of recombinant mytichitin-1
2.3 重组mytichitin-1的功能
采用DNS法分别测试了重组菌发酵液,镍柱纯化后的重组mytichitin和复性后的mytichitin-1的功能,结果如图7A所示。从图7A可以看出,含重组mytichitin-1的大肠杆菌发酵液(fermentation broth,FR)具有一定的几丁质酶酶解活性;复性前(before refolding,BR)的重组mytichitin-1其几丁质酶解活性较弱,而复性后(after refolding,AR)的重组mytichitin-1则活性较强。复性后的重组mytichitin-1的功能分析结果如图7B-D。从图5A可以看出,重组mytichitin-1对几丁质的催化在50 min左右达到最高值;而重组mytichitin-1催化几丁质降解活性在pH值为4左右(图7B),以及温度在40°C左右(图7D),其活性最强。

图7 重组mytichitin-1活性检测图Fig.7 Chitinase activity of recombinant mytichitin-1
采用生长曲线抑制法测定重组mytichitin-1对藤黄叠球菌Sarcina lutea(ATCC4698)、鳗弧菌Vibrio anguillarum(ATCC43306)、黑曲霉 Aspergillus niger(ATCC16404) 以及白色念球菌 Monilia albican(ATCC10231)的相对抑制率,结果如图8A所示。从图8A可以看出,重组mytichitin-1在50 μmol/L浓度下,对上述4种微生物的相对抑制率分别为33%、54%、65%和72%。
重组mytichitin-1的几丁质结合实验结果如图8B所示,采用几丁质孵育结合SDS-PAGE法检测mytichitin-1的几丁质结合活性,从图8B可以看出,mytichitin-1与几丁质具有明显的结合活性,在与几丁质孵育1 h并离心后,上清液经SDS-PAGE检测无目标条带(图8B泳道2)。该结合活性可被8 M尿素解除(图8B泳道3)。
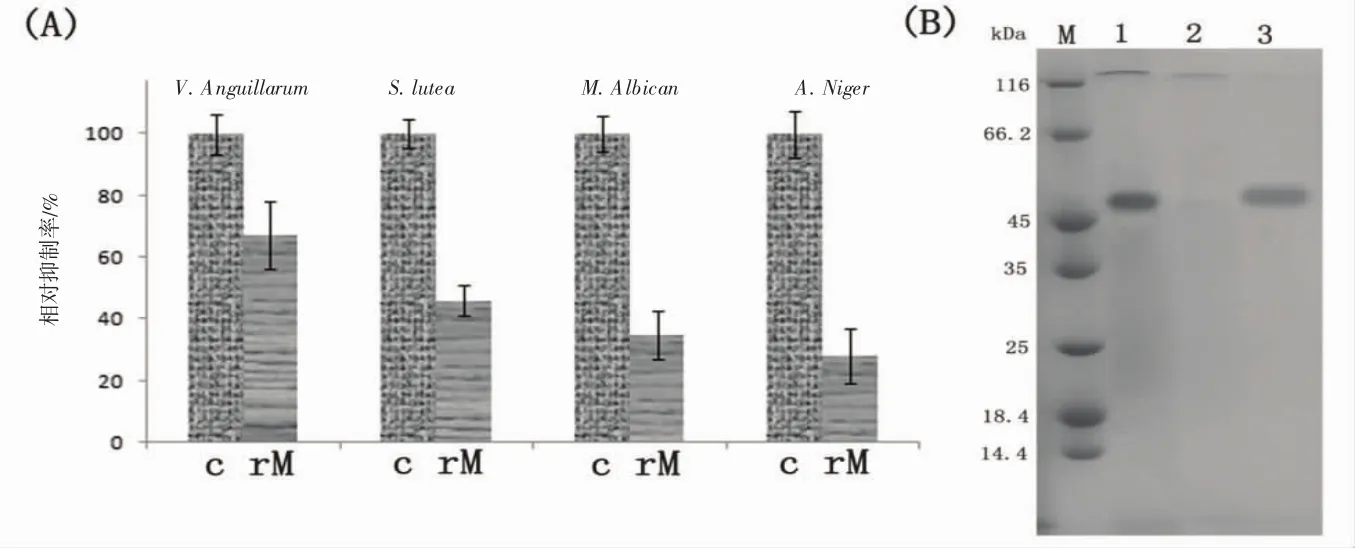
图8 重组mytichitin-1的抑菌试验和几丁质结合实验结果图Fig.8 The antimicrobial activity and chitin-binding activity of recombinant mytichitin-1
3 讨论
几丁质酶作为一种分布极为广泛且存在多种生物学功能的酶,历来是酶学研究的重要对象。厚壳贻贝几丁质酶mytichitin-1的序列中含有一个催化结构域(N端)、一个几丁质结合结构域(C端)以及连接两个结构域的接头序列。在前期研究中,发现mytichitin-1其C端55个残基的多肽可在体内裂解并作为抗菌肽(mytichitin-CB)分泌至血淋巴中发挥免疫防御作用[17]。该裂解现象在其他物种的几丁质酶研究中也有少量发现。例如,GAL,et al[26]曾经报道过粘质沙雷氏菌Serratia marcescens的52 kD几丁质酶可通过裂解产生另一种35 kD的几丁质酶,两种酶的催化活性类似,但其裂解的生物学意义不清楚;此外,NAUMANN,et al[27]发现,植物的IV型几丁质酶可被真菌蛋白酶裂解成两个片段,分别为酶催化活性域和几丁质结合结构域,这种裂解可能是植物在遭受真菌侵害时的一种免疫防御机制。由此可见,厚壳贻贝几丁质酶mytichitin-1的体内裂解现象不是个例,可能在不同物种中均存在此类现象并与该物种的免疫防御机制存在重要联系。因此,本研究以厚壳贻贝mytichitin-1为研究对象,采取了密码子优化策略结合原核重组表达获得重组蛋白样品并开展相关功能研究。
采用密码子优化结合原核重组表达策略,成功表达出mytichitin-1的重组蛋白,其表达量达到40 mg/L发酵液。通过western、质谱等手段验证重组mytichitin-1的序列表达正确。进一步的功能分析表明,重组mytichitin-1具有明显的几丁质降解活性,表明重组mytichitin-1在N端的组氨酸标签并未对其功能产生明显影响;此外,重组mytichitin-1在氧化复性后,其活性明显比复性前要强(P<0.01)。这表明氧化复性有利于重组mytichitin-1的正确折叠,特别是重组mytichitin-1的C端几丁质结合结构域含6个半胱氨酸并形成3对二硫键[17],因此,氧化复性能促进其二硫键的正确配对并确保其功能的正常发挥。同时,我们也注意到,含有重组mytichitin-1的大肠杆菌发酵液也具有一定的几丁质酶解活性,考虑到重组mytichitin-1在大肠杆菌15°C诱导培养时,其发酵液中也存在少量重组蛋白(图4B的9号泳道),表明含重组mytichitin-1的大肠杆菌在低温诱导培养下可能存在少量的分泌型表达方式,但是也不排除该酶解活性可能来自于大肠杆菌自身的几丁质酶的影响。重组mytichitin-1的酶解活性最佳pH为4左右,这可能与其活性位点(-DGLDLDLE-)富含酸性氨基酸(谷氨酸及天冬氨酸)有关联[17];重组mytichitin-1的最佳催化温度为40°C左右,且在60°C条件下仍保持约70%的活性,表明重组mytichitin-1具有较好的热稳定性,该特征也与其他物种的几丁质酶类似[28-29]。几丁质酶的序列中多数情况下存在几丁质结合结构域,该结构域与几丁质酶与底物的结合具有关联,且该结构域被认为是几丁质酶能降解不溶性几丁质的关键因素,因此,缺失这一结构域的几丁质酶只能降解可溶性几丁质,二不能催化不溶性几丁质的降解[30]。几丁质酶中的几丁质结合结构域根据其二硫键数量可分为I型(4对二硫键)和II型(3对二硫键)[31];重组mytichitin-1的几丁质结合结构域含3对二硫键,属II型结构域。在本研究中,重组mytichitin-1对几丁质具有明显的结合活性,且该活性在加入尿素促使蛋白变性后得到解除(图8A)。
抑菌活性实验表明,重组mytichitin-1对所测试4种微生物均有抑制作用,且表现出对真菌的抑制活性较强,对革兰氏阴性菌的抑制活性较弱。在所测试的4种菌中,重组mytichitin-1在50 mol/L浓度下对2种真菌的抑制率均在60%以上,而对鳗弧菌和藤黄叠球菌的抑制率相对较低。几丁质酶的抑菌活性已有相关报道,且多数集中在几丁质酶的抗真菌活性方面[32-33]。此外,针对贝类的几丁质酶研究也发现该酶与贝类的免疫防御存在相关性,在细菌诱导下,贝类的几丁质酶的表达量呈明显上升趋势[34-35]。但是与天然mytichitin-CB(mytichitin-1的C端肽)相比[17],重组mytichitin-1的抑菌活性相对较弱,这表明,厚壳贻贝mytichitin-1通过裂解获得抑菌活性更强的多肽片段可能是几丁质酶发挥免疫防御作用的一种重要方式。
贝类几丁质酶目前被认为与贝类的发育[35]、消化[36]、贝壳的形成[37]和免疫[38]等生理功能存在重要关系。因此,对贝类几丁质酶的研究不仅有助于了解几丁质酶的功能多样性,也有助于了解几丁质酶参与不同生理学功能的分子机制,从而为几丁质酶的分子进化研究以及基于几丁质酶的应用研究奠定基础。对厚壳贻贝几丁质酶mytichitin-1的原核重组表达及功能分析,为几丁质酶结构与功能关系研究以及在此基础上的蛋白质工程研究奠定了基础。
