二维配位聚合物衍生的氮掺杂碳/氧化锌纳米复合材料作为高性能的锂离子电池负极材料
2019-01-14侍昌东戎红仁沙彦勇刘洪江张汉平
温 豪 侍昌东 胡 瑶 戎红仁 沙彦勇 刘洪江*, 张汉平 刘 琦*,,3
(1常州大学石油化工学院,江苏省精细石油化工重点实验室,常州 213164)
(2上海大学理学院化学系,上海 200444)
(3南京大学配位化学国家重点实验室,南京 210093)
0 引 言
近几十年来,锂离子电池因其工作电压高,能量密度大,循环寿命长,无记忆效应等优点,已经在便携式电子设备,电动汽车和电网中得到了广泛应用,无疑,与其它储能体系相比,比如超级电容器,锂离子电池(LIBs)在可再生和可持续能源的发展和应用中占据了主导地位[1-3]。为了满足日益增加的应用需求,开发具有高能量密度和高功率密度的优异性能的锂离子电池一直是一个重要的挑战[4]。目前的商业化石墨负极理论容量低(372 mAh·g-1),接近锂储存极限,限制了锂离子电池的发展[5-10]。传统金属氧化物具有较高的理论容量,是理想的锂离子电池负极材料候选物[1-2]。近年来,四氧化三钴[11],氧化锌[12],四氧化三铁[13-14]和氧化镍[15]等氧化物受到广泛的研究。其中,氧化锌(ZnO)由于理论容量高(987 mAh·g-1)、储量丰富、价格低廉和无毒害等特点受到相当多的关注[16-20]。然而,在充放电过程中,氧化锌电极大的体积变化将导致电极极化,进一步影响电极的循环稳定性,造成容量迅速衰减。此外,氧化锌电极导电性能差,这将影响电极的倍率性能[21-26]。为了解决上述问题,将氧化锌和碳材料复合是一个行之有效的方法。碳材料由于电导率高,耐腐蚀性良好和一系列表面性能吸引了越来越多的研究兴趣[27]。各类碳材料,如石墨烯和碳纳米管(CNT)已经在锂离子电池领域得到应用[28-29]。金属氧化物与碳材料复合可提升电荷转移能力,进而提高锂离子电池的循环稳定性和倍率性能。近来报道表明,在能量储存和转换装置中(锂离子电池[30],超级电容器[31]),氮掺杂可改善碳基电极的导电性和界面稳定性,同时可以提高反应动力学。例如,氮掺杂碳已被用于 Fe3O4[30],Sn[32]和 Li4Ti5O12[33]导电基体以制备锂离子电池负极材料。因此,氮掺杂的ZnO/C纳米复合材料有望提高锂离子电池负极性能,使其满足商业化锂离子电池负极高容量、长寿命和倍率性能好的要求。为了制备金属氧化物/氮掺杂碳纳米复合材料,利用单个前驱体热分解以同时产生金属氧化物纳米粒子和氮掺杂碳是一条有效的途径。研究者在这方面已经取得了一些进展,但寻找合适的前驱体来制备性能优良的纳米复合材料仍然是一个挑战性的任务。
配位聚合物通过金属离子或金属簇与有机配体的配位作用构建而成,其中多孔的配位聚合物又常常被人们称为金属有机骨架(MOFs)。配位聚合物在适当的氛围下热处理,可以作为前体合成纳米复合材料,包括金属氧化物/碳,金属磷化物/碳,或金属硫化物/碳[34-37]。近来,二维配位聚合物吸引了广泛的研究兴趣[38-44],该类化合物不仅在表面可以提供更多的活性位点而且可以提供夹层空间。但是,据我们所知,通过二维配位聚合物制备纳米材料还很少被报道[45]。本文通过一步煅烧二维锌基配位聚合物([Zn(tfbdc)(4,4′-bpy)(H2O)2]),合成了氮掺杂碳/氧化锌复合纳米粒子(ZnO-N-C)。作为锂离子电池的负极材料,ZnO-N-C纳米复合材料具有高的可逆容量,优异的循环稳定性和较好的倍率性能。
1 实验部分
1.1 实验试剂
4,4′-联吡啶(4,4′-bpy)和四水合醋酸锌均购于上海化学试剂公司。所有试剂均为分析纯,使用前不需进一步纯化。四氟对苯二甲酸(H2tfbdc)参考文献方法制备[46]。碳酸乙烯酯和碳酸二甲酯产自山东利兴化工有限公司。
1.2 金属配合物[Zn(tfbdc)(4,4′-bpy)(H 2O)2]的合成
参照文献[42]报道的方法稍微改进来合成[Zn(tfbdc)(4,4′-bpy)(H2O)2])。 称 取 四 水 合 醋 酸 锌Zn(CH3CO2)2·4H2O(0.043 9 g,0.20 mmol),四氟对苯二甲酸 (H2tfbdc)(0.047 6 g,0.20 mmol),4,4′-联吡啶(4,4′-bpy)(0.038 4 g,0.20 mmol),依次置入 15 mL 反应釜中,然后向釜中加入6 mL的蒸馏水后超声分散 1 h(400 kHz,300 W)。随后将反应釜放入烘箱中,在100℃下保持24 h,然后让其自然冷却至室温。过滤,再用水和丙酮分别洗涤产物,洗涤结束后让其在常温下自然干燥,最终得到白色粉末状固体。
1.3 氮掺杂的碳包覆的氧化锌(ZnO-N-C)的合成
将 500 mg 配合物[Zn(tfbdc)(4,4′-bpy)(H2O)2]放入管式炉中,在N2气氛中,以10℃·min-1升温速率从室温升至550℃,立刻冷却至室温,最后获得75 mg的褐色粉末状氮掺杂碳包覆的氧化锌(ZnO-N-C)。
1.4 表 征
合成的配合物样品的傅里叶变换红外光谱(FTIR)测试采用的是Nicolet 460型红外光谱仪。利用X射线衍射仪(D/max、2500 PC,Rigaku)对样品结构进行分析,采用 Cu Kα 辐射(λ=0.154 06 nm),管电流为 300 mA,管电压是 60 kV,扫描范围为 2θ=10°~80°。采用ESCALABMKⅡ型X射线光电子能谱仪对样品进行X射线光电子能谱(XPS)的测定。样品的形貌和微观结构通过日立S-4800场发射扫描电子显微镜(FESEM)(加速电压 20 kV)和 JEM-2100 透射电子显微镜(TEM)(加速电压 200 kV)研究。使用ASAP2010C表面孔径吸附仪,以氮气为吸附质,在液氮温度为77 K的条件下进行比表面积测定,得到样品N2吸附-脱附等温线,由Brunauer-Emmett-
Teller(BET),Barrett-Joyner-Halenda(BJH)分析可以确
定样品的比表面积、孔径大小和孔体积。
1.5 电化学测定
使用浆料涂覆技术制备工作电极。将制备的作为负极材料的活性物质(ZnO-N-C)、导电剂(乙炔黑)以及粘结剂(聚偏氟乙烯)按质量之比7∶2∶1进行混合,在研钵中研磨至均匀,然后取适量的N-甲基吡咯烷酮滴入已研磨的粉末中混合成胶状并均匀的涂覆在铜箔上,在60℃下真空干燥12 h。将干燥好的铜箔裁剪成直径为20 mm的电极片,在压片机上压实,然后称量出电极片的质量。单个电极片上活性物质的质量约为0.84 mg。半电池的组装以纯锂片作为对电极,以1 mol·L-1的碳酸乙烯酯和碳酸二甲酯混合溶液 (体积之比为1∶1)作电解质溶液,以Celgard2400作隔膜,在充满氩气的Etelux敞开型手套箱LAB2000中进行组装。组装好的CR2016型纽扣式电池先搁置10 h,然后进行电化学测试。使用CHI600E(北京华科)电化学工作站测试循环伏安图,扫描速度为0.2 mV·s-1,扫描电压0.01~3.0 V。交流阻抗谱图是采用CHI600E(北京华科)电化学工作站检测,振幅为5 mV,频率范围为0.1~105Hz。在0.01~3.0 V电压范围内,使用深圳新威尔电池性能测试系统(CT-3008W-5V10mA-S4)测试半电池的充放电性能和倍率性能。电池的比容量根据ZnO-N-C的质量计算,比容量单位为 mAh·g-1。
2 结果与讨论
2.1 合成路线
图1阐述了ZnO-N-C的合成路线。通过水热法合成二维[Zn(tfbdc)(4,4′-bpy)(H2O)2]作为前驱体。 将四 氟 对 苯 二 甲 酸 (0.20 mmol),4,4′-联 吡 啶 (0.20 mmol)和四水合醋酸锌(0.20 mmol)加入 6 mL 去离子水,超声分散。然后,在100℃下,将混合液加热24 h 得到[Zn(tfbdc)(4,4′-bpy)(H2O)2]白色固体。[Zn(tfbdc)(4,4′-bpy)(H2O)2]的晶体结构如图 1(b,c)所示。将二维配位聚合物[Zn(tfbdc)(4,4′-bpy)(H2O)2]在氮气氛围下550℃煅烧,得到ZnO-N-C纳米复合材料(图1d)。

图1 ZnO-N-C的合成路线示意图Fig.1 Schematic illustration of the formation process for ZnO-N-C
2.2 物理表征
图2a 是样品[Zn(tfbdc)(4,4′-bpy)(H2O)2]煅烧后所得产物的XRD图。由图2a可以看出,在2θ=31°,34°,36°,47.5°,56.5°,63°和 68°处出现的衍射峰与六方闪锌矿结构的ZnO的标准图(PDF No.36-1451)的衍射峰一致,说明产物是ZnO。出现在2θ=15°~28°的低的宽衍射峰源自于非结晶性碳。在图中没有观察到其它的杂质峰,表明ZnO纯度很高。图2b为样品ZnO-N-C的红外光谱图。从图中可以看出,在3 442 cm-1处出现特征峰对应于羟基官能团的伸缩振动,这是由ZnO-N-C材料表面所吸附的水分子引起的,而571与675 cm-1处的特征峰对应于Zn-O键伸缩振动[47]。
图3为ZnO-N-C的X射线光电子能谱,从图中
可以看出C1s、O1s、N1s以及Zn2p轨道的能谱峰,由此可以确定化合物中含有C、N、O和Zn元素。ZnO-N-C中的C和N元素来自于二维配位聚合物[Zn(tfbdc)(4,4′-bpy)(H2O)2]中的有机物的分解。此外,图3中还出现了S2p轨道的能谱峰,说明该化合物中还含有S元素,S元素可能来自制备四氟对苯二甲酸时使用的浓硫酸。同时从图3(b~e)的高分辨XPS 图 谱 中 可 以 观 察 到 C1s、N1s、O1s、Zn2p3/2和Zn2p1/2轨道的结合能分别是 283.78、400.6、530.58、1 021.78和1 044.88 eV,与文献报道一致[48]。表1为ZnO-N-C的元素组成。

图2 (a)ZnO-N-C和Zn-LCP的XRD图;(b)ZnO-N-C的红外光谱图Fig.2 (a)XRD patterns of ZnO-N-Cand Zn-LCP;(b)FTIR spectrum of as-synthesized ZnO-N-C

图3 ZnO-N-C 的 XPS 总谱图(a),C1s (b),O1s (c),Zn2p (d)和 N1s (e)轨道的高分辨 XPS 谱图Fig.3 XPSsurvey spectrum (a),high-resolution XPSspectra of C1s (b),O1s (c)and Zn2p (d)and N1s (e)of ZnO-N-C

表1 ZnO-N-C的元素组成Table 1 Elemental atom content of ZnO-N-C

图4 ZnO-N-C的N2吸附-脱附等温线 (a)和孔径分布曲线 (b)Fig.4 (a)Nitrogen adsorption-desorption isotherms of as-synthesized ZnO-N-C;(b)Pore size distribution curve

图5 (a)[Zn(tfbdc)(4,4′-bpy)(H2O)2]和 (b)ZnO-N-C 的 SEM 图;(c,d)ZnO-N-C 的 TEM 图Fig.5 (a)SEM images of[Zn(tfbdc)(4,4′-bpy)(H2O)2]and (b)ZnO-N-C;(c,d)TEM images of ZnO-N-C
为了研究ZnO-N-C的孔结构,使用了氮气吸附脱附技术对ZnO-N-C复合材料进行测试。从图4a可以看出,ZnO-N-C材料的等温吸附曲线是Ⅳ型等温线,具有H3型迟滞回线,表明了ZnO-N-C为介孔材料。ZnO-N-C样品的比表面积为64 m2·g-1,孔体积为0.149 cm3·g-1。依据吸附曲线,通过BJH方法计算可以得出ZnO-N-C材料的平均孔径为12.17 nm。
[Zn(tfbdc)(4,4′-bpy)(H2O)2]样品的 SEM 图表明其是由许多纳米片组成,纳米片的长度和宽度分别在 105~360 nm 和 72~220 nm,厚度为(24±8)nm(图5a)。图 5(b,c)的 SEM 和 TEM 图表明 ZnO-N-C 粒子的尺寸范围在20~150 nm之间,粒子之间相互堆叠形成孔道。从图5c中可以观察到ZnO纳米粒子的表面包覆了一层非晶碳,表明产物是ZnO-N-C纳米复合材料,ZnO-N-C样品的TEM图(图5d)证实ZnO纳米粒子的表面包覆了一层非晶碳。在热处理过程中,[Zn(tfbdc)(4,4′-bpy)(H2O)2]纳米片中的锌离子转化成ZnO纳米粒子,同时含碳和氧的四氟对苯二甲酸以及含碳和氮的4,4′-联吡啶原位碳化,形成的氮掺杂碳与ZnO纳米粒子交叉复合。
2.3 电化学性能
图6a是ZnO-N-C作为锂离子电池负极材料时在0.1~3.0 V的电压范围内起始4次的循环伏安图。首次循环中,在0.28 V处的还原峰对应的是ZnO还原为Zn的过程、Li-Zn合金的形成以及固体电解质界面(SEI)膜的形成,在0.66 V左右的氧化峰对应了Li-Zn合金的去合金过程,随后在1.4 V左右的氧化峰对应的是Li2O的分解[17]。从第3圈开始曲线开始趋于稳定,曲线基本上是重合的,这表明其具有良好的电化学可逆性。电极的可逆反应可以用下式表达:
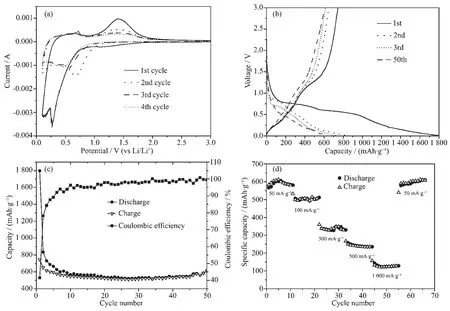
图6 ZnO-N-C电极的电化学性能:(a)在0.2 mV·s-1扫速下的循环伏安图;(b)在 50 mA·g-1电流密度下的充放电图;(c)循环性能图;(d)倍率性能图Fig.6 (a)CV curves at the scan rate of 0.2 mV·s-1,(b)Charge-discharge voltage profiles at a current density of 50 mA·g-1,(c)Cycling performance and (d)Rate performance at different current densities of ZnO-N-Celectrode

图6b是ZnO-N-C电极在50 mA·g-1的电流密度下的第1、2、3和50次的充放电图。从第1次放电曲线中,可以观察到在0.53和0.25 V附近有2个放电平台,在0.53 V附近的放电平台归属于ZnO还原为Zn以及Li2O的形成;而在0.25 V附近相对较弱的放电平台归属于Li-Zn合金的形成和电解质的分解。在随后的放电曲线中,可以观察到在0.25~0.8 V之间有一斜的放电平台。第一次放电结束时,ZnO-N-C电极的放电容量为1 796 mAh·g-1,远远高于ZnO的理论容量(987 mAh·g-1)。超过的容量来自不可逆的Li2O,SEI膜的形成和电解质在低电压范围的分解[19]。在第2次放电结束时,放电容量为833 mAh·g-1,与第1次放电容量相比,不可逆的容量损失达53.6%,造成损失的原因可能是SEI膜的形成和电解质的分解。图6c为ZnO-N-C电极在50 mA·g-1的电流密度下的循环性能图。从图中可以观察到,在第1次充放电循环后,由于SEI界面膜的形成以及在充放电过程中复杂的副反应造成了容量明显的衰减。但从第6次充放电循环开始,该电极材料展现出了良好的循环性能,50次循环后,其可逆容量为611 mAh·g-1。与已报道的ZnO/C复合材料相比(表2),本工作中制备的ZnO-N-C电极具有较好的电化学性能。图6c表明其首次充放电库伦效率仅为41.5%,而从第10次循环后,库伦效率几乎都接近100%,表明ZnO-N-C电极具有良好的可逆性。图6d的倍率性能图表明,当电流密度为50、100、300、500 和 1 000 mA·g-1时,ZnO-N-C 电极的可逆容量分别为 586、502、332、235 和 122 mAh·g-1,在大电流下展现出较为优异的充放电能力。当电流密度从 1 000 mA·g-1恢复到 50 mA·g-1时,电极的可逆容量恢复至605 mAh·g-1,表明ZnO-N-C电极具有优异的倍率性能。ZnO-N-C优良的电化学性能与以下因素有关:一是ZnO纳米粒子的小尺寸导致锂离子扩散路径缩短,且提供了更多的电化学活性位点;二是ZnO纳米粒子表面覆盖的一层氮掺杂碳不仅增强了该材料的导电性,还有利于缓冲充放电时电极的体积变化。
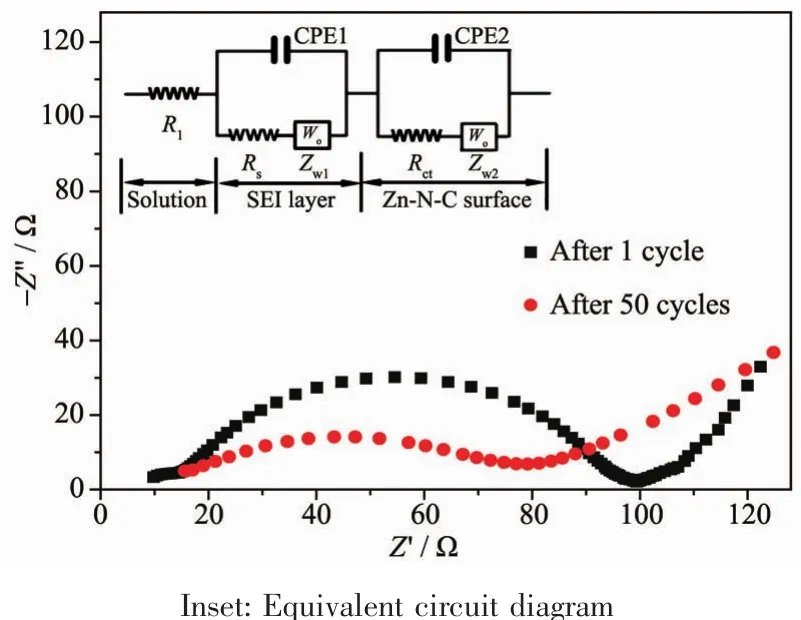
图7 ZnO-N-C电极在1和50次充放电后的交流阻抗曲线Fig.7 Nyquist curves of the ZnO-N-Celectrode after 1 cycle and 50 cycles

表2 已报道的ZnO及其复合材料的性能Table 2 Performance of ZnO and composites

表3 首次和第50次循环后的阻抗谱的拟合数据Table 3 Fitted data of EISfor the ZnO-N-C after 1st and 50th cycles
为了研究ZnO-N-C电极的电化学反应动力学,对ZnO-N-C电极进行了交流阻抗测试(图7)。利用Zview软件拟合第1次和第50次充放电后的交流阻抗谱,所获得的数据列于表3中。R1为电解质溶液电阻。50次充放电循环后的R1为13.1Ω,稍微高于首次循环后的R1值(8.57Ω),这说明ZnO-N-C纳米复合材料具有优良的稳定性。Rs和Rct分别代表固体电解质界面膜电阻和电荷转移电阻。CPE1和CPE2代表常相位角元件,CCPE1和CCPE2分别代表2个器件的电容,nCPE1和nCPE2分别代表2个器件与纯电容的相似度。ZW1,ZW2表示Warburg阻抗。循环50次后的 Rs(12.1 Ω)高于首次循环后的 Rs(5.68 Ω),这可能与固体电解质界面膜厚度增加有关。循环50次后的Rct为26.1Ω,小于循环首次后的Rct值(78.7 Ω),这个值的减少可能跟50次循环后ZnO-N-C电极具有更好的浸润性和连接性有关。
3 结 论
以二维锌基配位聚合物为前驱体在氮气气氛中通过高温煅烧得到了一种氮掺杂的碳/氧化锌纳米复合材料(ZnO-N-C)。作为锂离子电池的负极材料,ZnO-N-C纳米复合材料展现出高的可逆容量、优异的循环性能和较好的倍率性能。在50 mA·g-1的电流密度下,经过50次充放电循环后,ZnO-N-C纳米复合材料仍具有611 mAh·g-1的可逆容量。更重要的是,这证实了二维配位聚合物可替代三维配位聚合物作为前驱体合成氮掺杂碳/金属氧化物纳米复合材料。
