非洲紫罗兰离体叶片不定芽的诱导及植株再生
2019-01-14吕德任任军方符瑞侃梁定民王景飞戚华沙
吕德任,任军方,符瑞侃,梁定民,王景飞,黄 赛,戚华沙
(海南省特种经济植物种质资源创新利用重点实验室/海南省农业科学院热带园艺研究所,海南 海口 571100)
1 引言
非洲紫罗兰(Saintpaulia ionantha wendl)又名非洲堇,为苦苣苔科非洲紫罗兰属多年生常绿草本[1,2],其花色艳丽,株型小而美观,是较受欢迎的小型盆栽花卉。非洲紫罗兰原产地为非洲坦桑尼亚,现世界各地广泛栽培,被誉为“室内花卉皇后”,其极有市场开发前景[3]。我国对非洲紫罗兰的组织培养技术研究起于上世纪90年代,1999年王莲辉等人以非洲紫罗兰的茎段、嫩叶及叶柄作为外植体进行离体培养试验,试验结果仅有茎段诱导出愈伤组织进而分化出不定芽[4]。至今,多处见有非洲紫罗兰组织培养研究报道[5~8],为其开发利用提供了较多的技术支持。本试验对非洲紫罗兰叶片繁育种苗的相关环节进行了研究,建立起离体繁殖技术和植株再生体系,旨在实现可持续开发利用和工厂化育苗。
2 材料与方法
2.1 材料
非洲紫罗兰盆苗种植于海南省农业科学院热带园艺研究所生物技术室,取健康新叶片作为外植体。
2.2 外植体灭菌
早上9:30阳光照射晒干叶片上的露珠后,用刀片切取非洲紫罗兰叶片,自来水清洗,用棉花沾适量稀释洗洁精擦叶片表面,自来水清洗;移入超净工作台放入无菌瓶中,无菌水清洗2次,75%酒精摇荡10 s,无菌水清洗1次,0.05%HgCl2消毒4 min,无菌水清洗3次,3%NaClO浸泡5 min,无菌水清洗4次。
2.3 叶片不定芽诱导
消毒好的叶片切成约1.50 cm×1.50 cm方块,背面向下接入培养基,培养基分别设置为6-BA0.5 mg/L+NAA0.2 mg/L、6-BA1.0mg/L+NAA0.2 mg/L、6-BA1.5mg/L+NAA0.2 mg/L和空白对照(CK),共4组对比。每瓶接3个外植体,每个处理接种5瓶,3次重复,35 d统计不定芽平均诱导率和平均芽数。
2.4 不定芽增殖培养基筛选
挑选单芽约1.00 cm作为试验材料,培养基分别设置为6-BA 0.5 mg/L、1.0 mg/L、2.0 mg/L、4.0 mg/L与NAA0.2 mg/L、0.5 mg/L组合,共8组对比。每瓶接3个外植体,每个处理接种5瓶(试验实际每个处理接种8瓶,随机统计未污染材料5瓶),3次重复,35 d统计不定芽增殖系数和生长情况。
2.5 不定芽生根培养基筛选
采用继代增殖苗约1.5作为试验材料,设置NAA1.0 mg/L、2.0 mg/L、3.0 mg/L、4.0 mg/L,添加1g/L活性炭,共4组对比。每瓶接3个外植体,每个处理接种5瓶,3次重复。35 d统计不定芽的平均生根率及根的生长情况,筛选出非洲紫罗兰适宜生根培养基。
2.6 移栽
生根苗移至大棚练苗15 d后,瓶盖打开30 min,然后将苗从培养瓶中取出,用清水洗去根部残留的培养基,分别栽植于下列基质中:河沙∶椰糠(V1∶V5)、表土∶椰糠(V1∶V5)、红土∶椰糠(V1∶V5)、珍珠岩∶椰糠(V1∶V5),共4组对比。每种基质各栽种20株,3次重复。种后浇透定根水,盖上透明塑料薄膜,每7 d浇一次水,30 d后统计成活率。
2.7 数据处理分析
数据采用SPSS 19.0软件进行方差分析。
统计方法:平均诱导率(%)=(诱导总数/接种总数)×100%;平均芽数(个)=芽总数/接种总数;增殖系数=增殖后芽数/接种总数;平均生根率(%)=(生根总株数/接种芽数)×100%;平均根长(cm)=根长总数/接种总数;平均根数(条)=根总数/接种总数;平均成活率(%)=(成活总数/移栽总数)×100%。
3 结果与分析
3.1 不同激素种类组合对不定芽诱导的影响
不同激素种类组合对非洲紫罗兰不定芽诱导的影响差异极大(表1)。叶子接入不同培养基中,9 d见有叶片边缘产生少量愈伤组织,15 d叶片向下卷曲,随后叶片边缘和上表皮出现绿色小芽点,25~35 d小芽点长成大量不定芽(图1)。在不定芽平均诱导率方面,6-BA1.0 mg/L+NAA0.2 mg/L处理,平均诱导率为最高值,达100%,其次为6-BA1.5 mg/L+NAA 0.2 mg/L处理,平均诱导率为95.56%,两者间差异不显著。在平均芽数方面,6-BA1.0 mg/L+NAA0.2 mg/L处理,平均芽数最多,达4.80个,其次为6-BA1.5 mg/L+NAA 0.2 mg/L处理,平均芽数为4.22个,两者间差异达到显著水平。因此,非洲紫罗兰不定芽诱导的适宜培养基为MS+6-BA1.0 mg/L+NAA0.2 mg/L。

表1 不同激素种类组合对不定芽诱导的影响
A=0.05
注:相同字母表示差异不显著。

图1 不定芽
3.2 不同激素种类组合对不定芽增殖的影响
不同激素种类组合对非洲紫罗兰不定芽增殖的影响效果不同(表2),从数据整体来看,6-BA1.0 mg/L和6-BA2.0 mg/L与NAA的两种浓度组合,增殖系数大于15;6-BA0.5 mg/L和6-BA4.0 mg/L与NAA的两种浓度组合,增殖系数小于10。从数据组合来看,6-BA2.0 mg/L与NAA两种浓度组合的增殖系数差异不显著,6-BA0.5 mg/L与NAA两种浓度组合的增殖系数差异不显著,6-BA1.0 mg/L和6-BA4.0 mg/L与NAA两种浓度组合的增殖系数的差值分别为0.66、1.60,这可能说明非洲紫罗兰不定芽增殖主要的影响因子是6-BA,NAA为辅助因子或者对增殖没起影响作用。从增殖系数来看,6-BA2.0 mg/L+NAA 0.2 mg/L处理诱导的增殖系数最高,增殖系数达18.60,且不定芽健康,颜色艳绿(见图2、图3)。综合考虑分析,MS+6-BA2.0 mg/L+NAA 0.2 mg/L为非洲紫罗兰适宜增殖培养基。

图2 6-BA2.0 mg/L+NAA 0.2 mg/L处理的不定芽增殖
3.3 不同NAA浓度对不定芽生根的影响
不同NAA浓度对非洲紫罗兰的生根效果不同(表3、图3)。在含NAA1.0 mg/L的培养基中,培养35 d后,小苗的根粗、苗健壮,诱导生根率达91.11%;在含NAA2.0 mg/L和NAA3.0 mg/L的培养基中,诱导出的根短、苗健壮,生根率分别为84.44%和82.22%;在含NAA4.0 mg/L的培养基中,诱导出的根短且细,生根率为73.33%。从表中数据可以看出,在NAA1.0~4.0 mg/L的范围内,随着NAA浓度增加,生根率有所下降,这可能说明,非洲紫罗兰适合较低浓度的生根剂进行培养。方差分析结果显示,NAA1.0 mg/L与其它处理的生根率差异达到显著性水平。因此,培养基 MS+NAA1.0 mg/L为非洲紫罗兰适宜生根培养基。

表2 不同激素种类组合对不定芽增殖的影响
3.4 移栽
非洲紫罗兰组培苗移栽成活率较高,其中在表土∶椰糠(V1∶V5)的混合基质上移栽,成活率达86.67%(图4);在珍珠岩∶椰糠(V1∶V5)的混合基质上移栽,成活率达75.00%;在红土∶椰糠(V1∶V5)的混合基质上移栽,成活率达70.00%;在河沙∶椰糠(V1∶V5)的混合基质上移栽,成活率达86.67%,这可能是因为表土和椰糠混合,可以为非洲紫罗兰组培苗提供更多养分,而珍珠岩和椰糠混合,基质的通透性良好有利于根系发育。移栽时,注意浇透定根水,盖上透明塑料薄膜,并每7 d浇一次水,以保证移栽环境适度降温,相对湿度较高等条件。
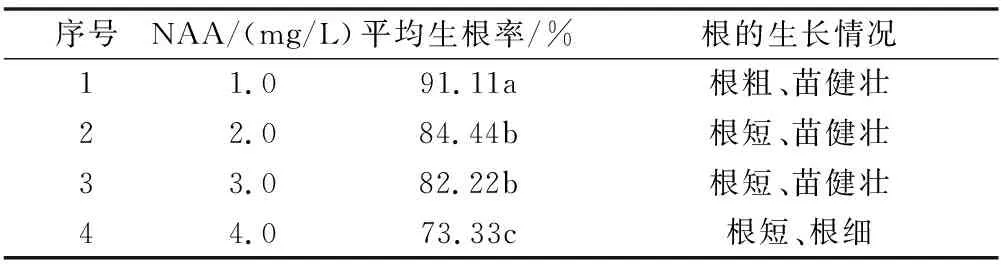
表3 不同NAA浓度对不定芽生根的影响

图3 不同NAA浓度对非洲紫罗兰的生根效果

图4 非洲紫罗兰在表土∶椰糠的混合基质上移栽结果
4 结论
利用组织培养技术对非洲紫罗兰进行快繁,可为市场提供大量优质种苗,而在离体培养增殖过程中,增殖系数对种苗的数量和整个技术能否工厂化生产应用有着决定性的影响[9]。
在本研究中,以MS+6-BA2.0 mg/L+NAA 0.2 mg/L为增殖培养基诱导芽的生长,增殖系数达18.60,增殖系数极高,为下一步的生根壮苗提供了充足的材料。非洲紫罗兰组培苗移栽喜于通透性良好且富含营养的基质,组培苗移栽于表土∶椰糠(V1∶V5)和珍珠岩∶椰糠(V1∶V5)的基质上,成活率达75.00%以上,并且植株生长状态良好,满足可持续开发利用和工厂化育苗。
