根瘤菌共生对紫花苜蓿耐碱能力的影响
2019-01-11宋婷婷杨圣秋许慧慧
才 华,王 硕,董 理,孙 娜,宋婷婷,杨圣秋,许慧慧
(东北农业大学生命科学学院,哈尔滨 150030)
紫花苜蓿(Medicago sativa)是多年生豆科草本植物,是世界种植面积最广的牧草之一。以紫花苜蓿为原料的动物饲料营养全面,适口性好,是重要的蛋白饲料。紫花苜蓿在饲料加工、保持土壤水分,提高土地肥力、生态植被修复等方面具有重要作用[1]。
我国土地盐碱化问题严重。当土壤表层离子含量维持在一定范围时,促进植物生长,当离子(Na+、K+、Mg2+、)大量积累则造成土地盐碱化[2]。若植物长期生存在高盐土壤中,其体内积累大量阴阳离子,遭受盐碱胁迫损害。盐碱胁迫改变植株渗透势造成生理性缺水,植物体内离子平衡失调,生理生化指标异常,正常生长受阻,可能导致植物死亡[3]。
根瘤菌是土壤中的革兰氏阴性菌,主要与豆科植物共生,将空气中的氮气转化为植物可直接利用的氮素。豆科植物-根瘤菌共生固氮在自然界生物固氮中尤为重要,生物固氮对促进植株生长,提高作物产量、抗性具有重要作用[4-5]。豆科植物-根瘤菌共生可改善干旱和盐胁迫状况下苜蓿生长状况,提高紫花苜蓿产量,主要表现在抗氧化能力增强,尤其是根部渗透调节能力增强,通过调节细胞内外K+、Na+、H+、Ca2+流动,保持细胞内离子环境平衡,维持渗透压[6]。接种根瘤菌的紫花苜蓿耐旱性和耐盐性增强,根瘤在抵御干旱和盐胁迫上有促进作用。刘倩等研究共生根瘤菌对混合盐碱胁迫下紫花苜蓿抗氧化和渗透调节能力的影响发现,接种根瘤菌可有效提高紫花苜蓿抗氧化和渗透调节能力[7]。
在这种共生关系中,植物为根瘤菌提供能量和碳骨架等同化物,根瘤菌通过固氮酶完成固氮,为植物供应氮源。同化物运输至根瘤通过韧皮部将蔗糖转换成二羧酸,主要为苹果酸盐和琥珀酸盐形式[8]。在共生过程中,代谢中间产物如可溶性多糖、有机酸和氨基酸类等物质对于调节细胞渗透压、pH、活性氧清除等具有积极作用。Aranjuelo等研究指出,固氮植物在其他逆境条件下,在不同过程中限制根瘤功能、如碳水化合物利用、含氮化合物累积、O2渗透率和活性氧物质(Reactiveoxygen species,ROS)累积等[9]。紫花苜蓿固氮作用和根瘤菌抗逆性研究较为深入,而根瘤共生对紫花苜蓿碱胁迫的响应机制尚不明确。宋婷婷等研究表明,根瘤共生提高紫花苜蓿根系有机酸积累,减缓碱性土壤对根的伤害[10]。另外,根瘤形成过程中抗氧化能力增强对提高紫花苜蓿耐碱有积极作用。
本研究利用耐碱根瘤菌CCBAU 81024接种紫花苜蓿,测定碱胁迫下接种根瘤菌的紫花苜蓿相对叶绿素含量、根及叶中丙二醛含量、渗透调节物质、抗氧化酶酶活等生理生化指标,探索共生根瘤菌对紫花苜蓿耐碱性的影响,为后期开发根瘤菌制剂提供依据。
1 材料与方法
1.1 材料
植物为紫花苜蓿(Medicao sativa L.)龙牧806,购自黑龙江省畜牧研究所。菌种为苜蓿中华根瘤菌(CCBAU 81024)(Rmizobium meliloti strain Dormal),购自中国农业大学CCBAU根瘤菌保存库。培养基质选取河沙(流水冲洗15 min后蒸馏水冲洗1次,121℃灭菌2 h,保证基质中无其他微生物菌群)。
试验仪器:人工气候培养室,小型高速离心机,多量程移液枪,大型低温高速离心机,叶绿素测定仪,1 mL石英/玻璃比色皿,电导率测定仪,恒温水浴锅,天平,叶绿素仪,电导率仪,烘干箱,水平摇床,紫外/可见分光光度计,研磨机等。
试验时间为2017年10月~2018年3月。
1.2 方法
1.2.1 根瘤菌接种、碱处理及取材
取400粒紫花苜蓿龙牧806种子,75%乙醇种皮表面消毒,10%次氯酸钠灭菌5 min后,灭菌水充分冲洗种皮表面后移入铺有湿润滤纸的平皿中萌发。种子在培养箱中萌发(光照16 h,25℃),待种子长出子叶后沙土移栽。接种根瘤菌处理的植株在幼苗移栽前用编号为CCBAU 81024根瘤菌液浸泡后移栽于沙土中。1/5倍Hoagland营养液浇灌4周,第5周时接菌植株浇灌无氮营养液,激活根瘤菌,每月定期接种1次根瘤菌液。未接菌植株持续浇灌1/5Hoagland营养液。
16周后,用浓度100 mmol·L-1NaHCO3(pH 8.5)溶液碱胁迫处理,分成2组,即碱处理组和对照组。每组分为NI组和RI组,各5株,每5株置于托盘中,重复3次。100 mmol·L-1NaHCO3胁迫处理。碱处理组,每个托盘加碱胁迫液1 L,每日补加水100 mL,pH 8.5。对照组则加水1 L,每日补加水100 mL。
分别在未处理、处理5、8 d时,通过无损伤方式测定叶绿素含量。于10:00~14:00测定电导率和相对含水量。随机选取苜蓿根和叶片,液氮保存,测定生理生化指标。
1.2.2 株高、根长、叶绿素及相对含水量测定
叶绿素测定:用叶绿素仪(型号TYS-B)分别测定植株上、中、下部共6个叶片SPAD值,取平均值,每组各测定30株。
株高、根长测定:直尺测量两组植株根长、株高。
相对含水量测定:采取“鲜重法”测定含水量。采集新鲜叶片测鲜重(Wf),将叶片烘干至恒重后获得干重(Wd)。
叶片相对含水量(LRWC,%)=(Wf-Wd)/(Wt-Wd)×100%。
式中,Wf-鲜重;Wd-干重;Wt-饱和鲜重。
1.2.3 相对电导率测定
采用抽真空方法测定叶片电导率[11]。将叶片用去离子水洗净后抽真空测其电导率为S1,煮沸10 min后再次测得电导率为S2,去离子水电导率为S0。
相对电导率(L)=(S1-S0)/(S2-S0)。
式中,S1-初始电导值;S2-终电导值;S0-空白电导值。
1.2.4 生理指标测定
采用可见分光光度法测定丙二醛(MDA)、脯氨酸(Pro)、可溶性糖含量,试剂盒购自苏州科铭生物有限公司,按照试剂盒说明书操作。
1.2.5 抗氧化酶活性测定
SOD、POD测定采用可见分光光度法。CAT测定采用紫外分光光度法。所用试剂盒由苏州科铭生物有限公司提供。
1.3 数据分析
采用GraphPad Prism 5统计分析试验数据标准差、方差并作T-检验处理,分析接种根瘤菌植株生理生化指标与未接菌植株差异,P<0.05。
2 结果与分析
2.1 碱胁迫下NI与RI紫花苜蓿叶绿素含量和相对含水量差异
由图1可知,未经碱胁迫处理时,RI叶绿素含量高于NI组,且差异显著(P<0.05),是NI组的1.219倍。当植株遭受碱胁迫时,随胁迫时间增加NI组叶绿素含量极显著下降,而RI组叶绿素含量下降不显著。碱胁迫处理8 d时,NI叶绿素含量显著低于RI(P<0.05)。对比分析可知,接种根瘤菌紫花苜蓿受碱胁迫伤害显著低于未接菌紫花苜蓿。
由图2可知,正常条件下,NI与RI相对含水量差异显著(P<0.05),当碱胁迫处理8 d时,NI组下降明显,RI组虽有所下降,但含水量显著高于NI,具有显著性差异(P<0.05)。
NI、RI两组未经碱处理时株高和根长见图3,各组无显著差异,但RI接菌组根长与NI未接菌组相比显著优于NI,是NI组1.09倍(P<0.05),表明接种根瘤菌可提高紫花苜蓿生长量。

图1 碱胁迫处理不同时间点紫花苜蓿叶绿素含量Fig.1 Chlorophyll content of alfalfa under different timepointsof alkalitreatment

图2 碱胁迫处理不同时间点紫花苜蓿叶片相对含水量Fig.2 Relativewater content of alfalfa leaves at different time points under alkalistress
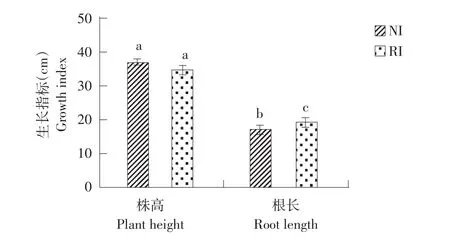
图3 未经碱胁迫处理时植株株高和根长Fig.3 Plant height and root length without alkalitreatment
2.2 碱胁迫下NI与RI植株细胞膜损伤程度的差异
由图4可知,正常条件下,两组植株叶片相对电导率基本相同,当碱胁迫8 d时,NI组相对电导率是RI的1.7倍,存在显著差异(P<0.05)。NI组紫花苜蓿相对电导率碱胁迫8 d后,较未处理显著提高。由此表明,在遭受碱胁迫时,RI组细胞膜损害较NI组小。

图4 碱胁迫处理不同时间点紫花苜蓿叶片相对电导率Fig.4 Relative conductivity of alfalfa leavesunder different timepoints of alkalitreatment
由图5可知,正常条件下,NI和RI两组紫花苜蓿叶片MDA含量存在显著差异(P<0.05),NI的MDA含量是RI的1.3倍。碱胁迫处理后,NI组MDA含量显著上升,而RI组MDA含量变化不显著。根部MDA含量变化整体趋势与叶相同,碱胁迫8 d时,NI与RI相比差异显著,是RI 3.77倍。根和叶中MDA含量表明,接种根瘤菌可有效降低MDA含量,缓解碱胁迫对细胞膜伤害。
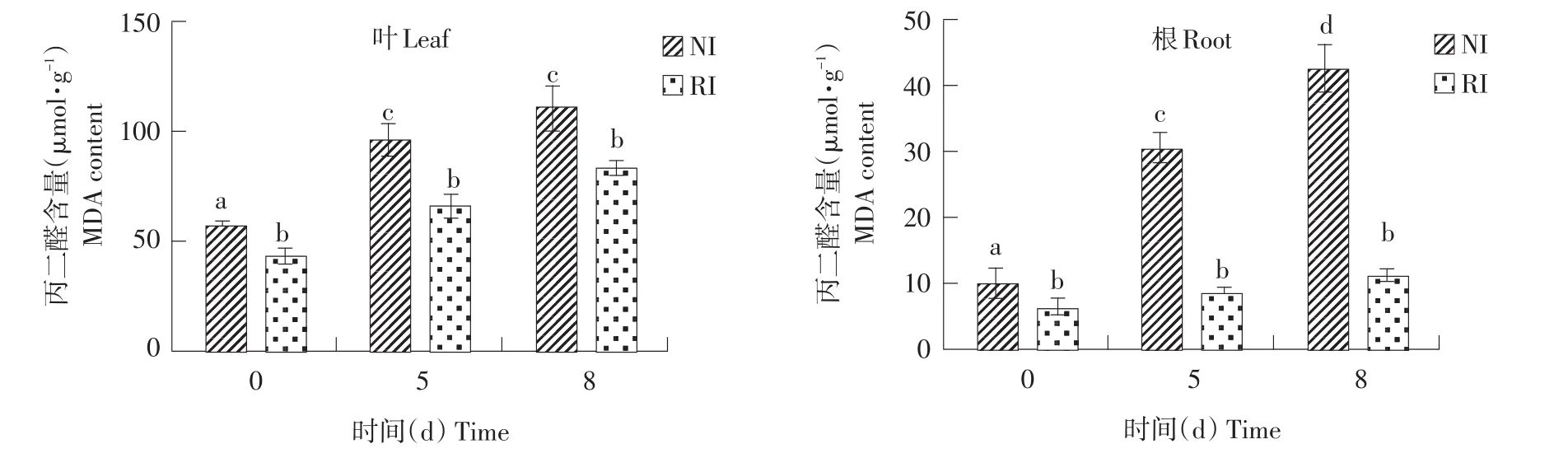
图5 碱胁迫处理不同时间点紫花苜蓿叶和根中MDA含量Fig.5 MDA contentsof alfalfa leavesand root under different timepointsof alkalitreatment
2.3 NI与RI组碱胁迫抗氧化酶活性的差异
由图6可知,正常生长条件下根中SOD酶活无差异,而叶中NI和RI差异显著(P<0.05),RI叶中SOD酶活是NI1.87倍。碱胁迫处理后,根中SOD酶活下降,而叶中SOD酶活变化较小。碱胁迫处理 8 d时,RI组根和叶中SOD酶活均显著高于NI组(P<0.05)。
由图7可知,POD与SOD均为抗氧化物酶,活性变化相似,正常条件下,根和叶中RI组POD酶活均显著高于NI组。碱胁迫处理8 d后,NI组POD酶活显著下降。碱胁迫处理8 d时,RI组POD酶活均显著高于NI组,在叶和根中分别是NI组的1.96和1.38倍。
由图8可知,CAT无规律变化,正常条件下,叶中RI组和NI组无显著差异,根中差异显著,RI组活性是NI的1.55倍。碱胁迫处理8 d后,在根和叶中,均表现出RI组CAT酶活显著高于NI组。结合SOD和POD结果可知,接种根瘤菌可提高SOD和POD酶活,增强碱胁迫后叶片CAT活性,提高紫花苜蓿抗氧化能力,增强耐碱性。

图6 碱胁迫处理不同时间点紫花苜蓿叶和根中SOD活性Fig.6 SODactivity of alfalfa leavesand root under different timepointsof alkalitreatment under alkalinestress

图7 碱胁迫处理不同时间点紫花苜蓿叶和根中POD活性Fig.7 POD activity of alfalfa leaves and root under different time points of alkalitreatment
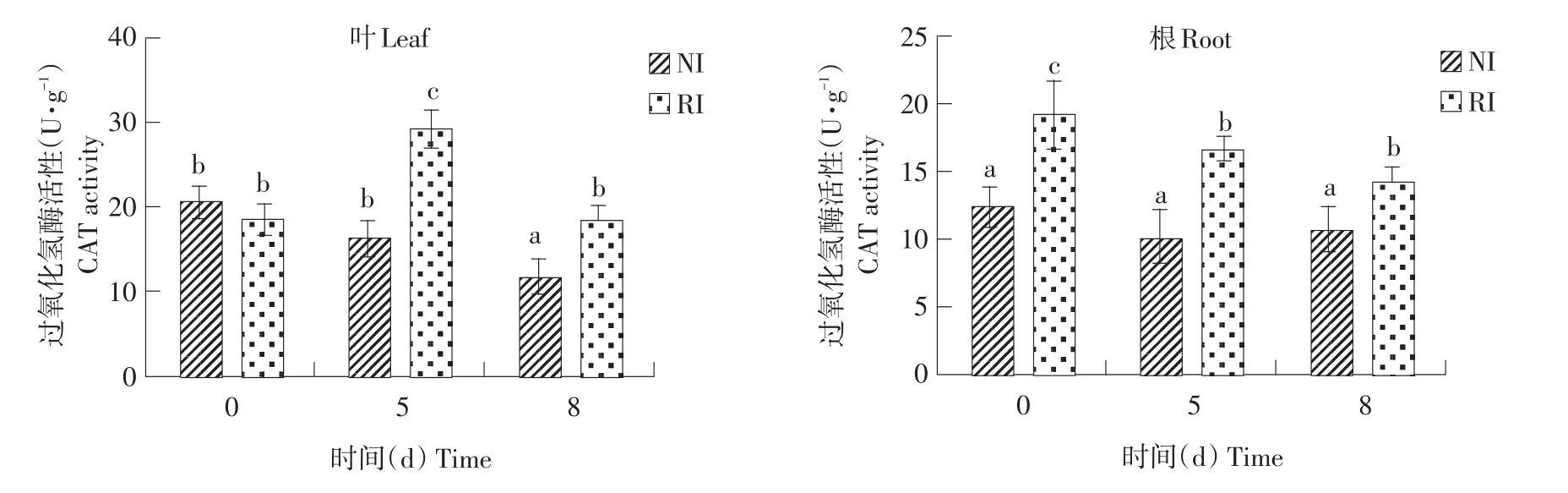
图8 碱胁迫处理不同时间点紫花苜蓿叶和根中CAT活性Fig.8 CAT activities of alfalfa leaves and root under different time points of alkalitreatment
2.4 碱胁迫下NI与RI渗透调节能力的差异
由图9可知,未经碱胁迫处理,根中NI和RI组中可溶性糖含量差异显著。碱胁迫处理8 d后,RI组叶中可溶性糖含量变化显著。碱胁迫处理8 d时,根和叶中,NI与RI组可溶性糖含量差异显著(P<0.05)。由图10可知,未经碱胁迫处理时,根和叶中均表现为RI组脯氨酸含量显著高于NI组(P<0.05)。随碱胁迫时间延长,脯氨酸含量均上升。碱胁迫处理8 d时,NI和RI组中,根和叶均积累大量脯氨酸,两组间无显著差异。
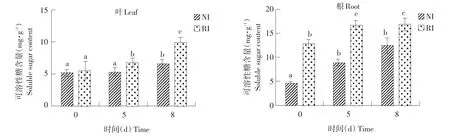
图9 碱胁迫处理不同时间点紫花苜蓿根和叶中可溶性糖含量Fig.9 Soluble sugar contents of alfalfa leaves and root under different time points of alkalitreatment
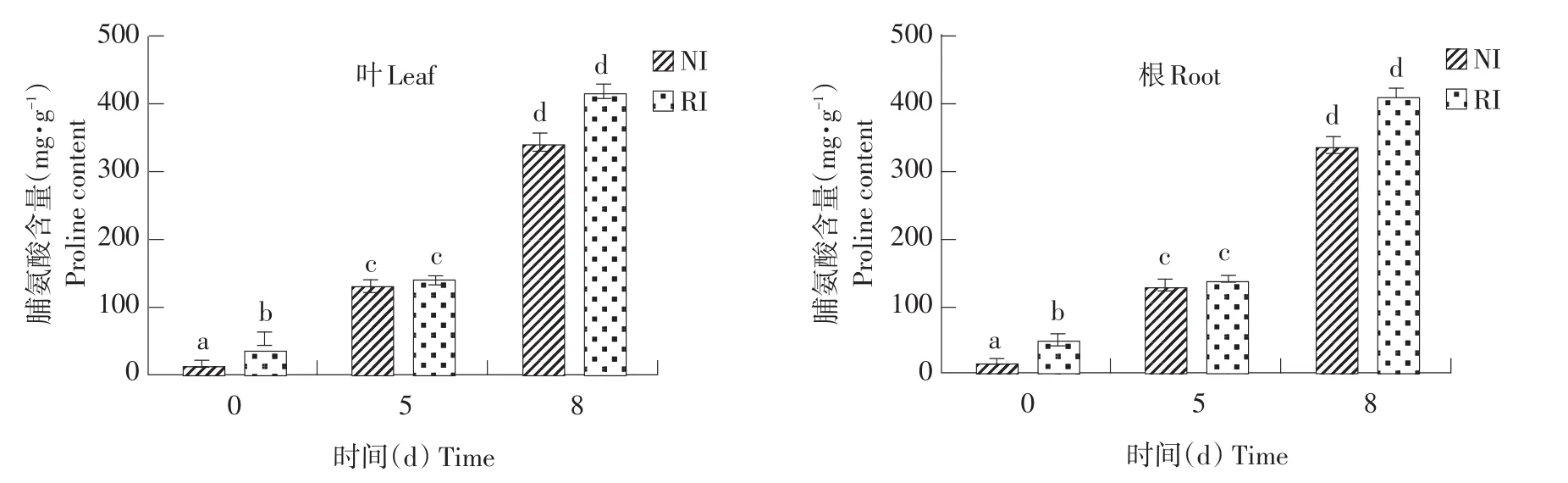
图10 碱胁迫处理不同时间点紫花苜蓿根和叶中脯氨酸含量Fig.10 Proline contents of alfalfa leaves and root under different time points of alkalitreatment
3 讨 论
作为非生物胁迫,碱胁迫比盐胁迫对植物生长影响更严重,主要表现在抑制光合效率[12],影响植株生长和抗逆性[13]。叶绿素作为参与植物光合作用重要物质,将环境中CO2经可见光转化为能量和有机物,供自身生长所需,通过光合作用,不仅为豆科植物提供根瘤固氮所需能量,还为根瘤固氮提供代谢用碳架。当植株遭受碱胁迫时,其叶片细胞结构发生显著变化,光合受阻,光合速率下降,其含量也可衡量植株生长状态[14]。Yang等也证明随盐度和pH增大,紫花苜蓿叶片净光合速率、气孔导度和胞间CO2浓度下降[15]。本研究发现,在正常生长条件下,接种耐碱根瘤菌紫花苜蓿(RI)叶绿素含量显著高于未接种组(NI),经碱胁迫处理后,RI组叶绿素含量变化不显著,而NI组叶绿素含量则极显著下降。由此表明,接种耐碱根瘤菌促进苜蓿光合作用,植株生长健壮,减缓逆境胁迫伤害。RI组相对含水量显著高于NI组,作为反映植株抗性及代谢速率的重要生理指标[16],表明根瘤菌可提高紫花苜蓿代谢速率。
游离脯氨酸是植株应对盐碱胁迫的一种重要渗透调节物质,当植株遭受盐碱胁迫时脯氨酸大量积累[17],利于缓解碱胁迫的渗透伤害,也是其遭受逆境胁迫的信号。本研究发现,正常条件下,根和叶均表现为RI组脯氨酸含量显著高于NI组(P<0.05)。但碱胁迫处理后,根和叶中脯氨酸含量均上升,NI组与RI组无显著差异。课题组前期分析根瘤菌接种苜蓿的代谢组发现,接种根瘤菌后,紫花苜蓿根中氨基酸代谢物质增加,TCA、糖代谢中代谢中间产物增加,其中包括氨基酸、有机酸、海藻糖及各种糖类等渗透调节物质[10]。碱胁迫后,接种根瘤菌苜蓿相对于未接种根瘤菌苜蓿,除脯氨酸外,还有其他渗透调节物质发挥作用,如有机酸和海藻糖等。由此可知,根和叶碱胁迫后,NI和RI组脯氨酸无显著差异。可溶性糖不仅是植物生长重要营养物质,也是响应逆境胁迫的信号分子,在渗透调节中起重要作用[18]。由可溶性糖含量变化可知,接种根瘤菌增强紫花苜蓿渗透调节能力。本研究中可溶性糖含量在碱胁迫初期差异显著,随碱胁迫时间增加,叶可溶性糖含量不断提高,且RI显著高于NI组,表明RI对于碱胁迫比NI适应性更好,随碱胁迫时间延长,可溶性糖迅速积累,有效渗透调节。
相对电导率反映植株在逆境条件下细胞膜受破坏程度[19]。当植株受碱胁迫处理后,除植株表型发生改变外,植株细胞膜结构和功能受损,引起质膜透性增加,机体内部代谢途径也发生相应改变,主要表现在细胞内离子平衡失调、生理代谢受阻、细胞内溶物外渗[20]。通过检测发现,叶片相对电导率随碱胁迫时间延长而增加。NI、RI两组电导率在处理8 d时差异显著,RI电导率显著低于NI未接种组,说明在碱胁迫下其细胞膜受损程度较小,接种根瘤菌显著提高苜蓿细胞膜稳定性。在非生物胁迫下,活性氧大量累积从而对植株造成毒害作用,若不及时清除会破坏细胞完整性,MDA大量累积[21]。测定MDA含量,可间接评价膜系统受损害程度及植株抗逆性[22]。本试验中,碱胁迫处理前两组MDA含量存在显著差异,随碱胁迫时间延长MDA含量上升,但RI组MDA含量显著低于NI。Wang等研究表明,耐盐性较强牧草较盐敏感型牧草MDA含量增长率低[23]。由此表明,接种根瘤菌可缓解碱胁迫对紫花苜蓿细胞膜损伤。
在非生物胁迫下,植株体内产生大量活性氧(ROS),而ROS水平过高则会导致植株死亡。SOD、POD、CAT是植物体内主要抗氧化物酶,通过清除体内活性氧保护酶系统,其活性提高可增强植物清除活性氧自由基能力[24-25]。在盐碱胁迫下,抗氧化酶POD、SOD、CAT活性提高可恢复氧化平衡[26-27]。本研究发现,RI组紫花苜蓿POD、SOD、CAT活性在碱处理前后均显著高于NI组。表明接种根瘤菌可有效提高植株抗氧化能力。
Noor等研究表明,共生根瘤菌可提高紫花苜蓿及豆科植物抗旱和耐盐能力,提高紫花苜蓿产量[28]。研究发现,正常情况下,接种根瘤菌降低MDA含量和电导率,提高可溶性糖和脯氨酸含量,增加SOD、POD、CAT抗氧化酶酶活,可缓解碱胁迫对紫花苜蓿细胞膜损伤,增强渗透调节能力和抗氧化能力,使苜蓿具有耐受碱胁迫能力。另外,本研究使用CCBAU 81024耐碱根瘤菌可耐受pH 10.5,对低碱条件不敏感,在碱胁迫条件下依然保持较高的根瘤固氮促生作用,可用于中度及重度盐碱地苜蓿生产。
