川崎病患儿外周血正五聚蛋白3水平观察
2019-01-10蒋丰智曾俊峰赵青唐明生黎小秀
蒋丰智,曾俊峰,赵青,唐明生,黎小秀
(1 东莞市妇幼保健院,广东东莞523000;2 东莞市第三人民医院)
临床及流行病学资料[1]显示,川崎病(kawasaki disease,KD)是一类因感染触发的急性自身免疫性血管炎综合征,是儿童获得性心脏病的最重要病因。KD患儿的早期识别对治疗及预后非常重要,目前KD的诊断主要依靠临床表现和心脏超声检查,临床上广泛应用的常规炎性指标(WBC、PCT、CRP、ESR)和D-二聚体、PLT等凝血指标特异性不是很高,寻找新的KD生物标志物意义重大[2]。正五聚蛋白3(pentraxin-3,PTX3)作为一种与血管炎症密切相关的急性时相反应蛋白,在KD患儿的治疗中备受关注。本研究观察了KD患儿外周血PTX3水平变化,并探讨其意义。
1 资料与方法
1.1 临床资料 选择2017年1月~2018年5月东莞市妇幼保健院和东莞市第三人民医院收治的KD患儿64例(KD组),其中男39例、女25例,年龄3~70个月。纳入标准:①符合2017年美国心脏协会(American Heart Association,AHA)临床诊断标准[3];②患儿发病年龄<6岁;③按病情进行静脉免疫球蛋白(intravenous immunoglobulin,IVIG)和阿司匹林标准治疗后临床恢复良好者;④能在门诊定期复诊者。排除标准:既往有心血管系统(包括先天性)、免疫系统疾病或近期使用过免疫调节剂的患儿。KD组患儿在治疗前接受心脏彩超检查,参照相关文献[4]标准,依据左、右冠状动脉主干内径测定值评价患儿冠状动脉病变程度,将64例急性期KD患儿分为冠脉损伤组(CAL组,18例)和非冠脉损伤组(NCAL组,46例)。同期选取体检健康儿童30例(健康组,男20例、女10例,年龄6~60个月)、发热超过5 d的呼吸道感染患儿30例(发热组,男16例、女14例,年龄5~62个月)作对照。本研究获两家医院伦理委员会批准,患儿及家长知情同意。
1.2 外周血PTX3和炎症因子(IL-1β、IL-6、TNF-α)检测 KD组患儿分别于临床病程急性期[发病后第5~7天)、亚急性期(发病后第11~13天,连续注射IVIG(1 g/kg)2 d并口服阿司匹林热退48 h以上]以及恢复期(发病后第4~5周)各采集静脉血1次,标本均静置1 h后3000 r/min(离心半径10 cm)离心10 min,分离得血清1.5~2 mL,保存于-30 ℃冰箱备用。健康组和发热组儿童于入组时常规无菌静脉采血3~4 mL。采用ELISA法检测各组儿童外周血PTX3和炎症因子(IL-1β、IL-6、TNF-α)水平。
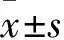
2 结果
2.1 各组外周血PTX3和IL-1β、IL-6、TNF-α水平比较 结果见表1。
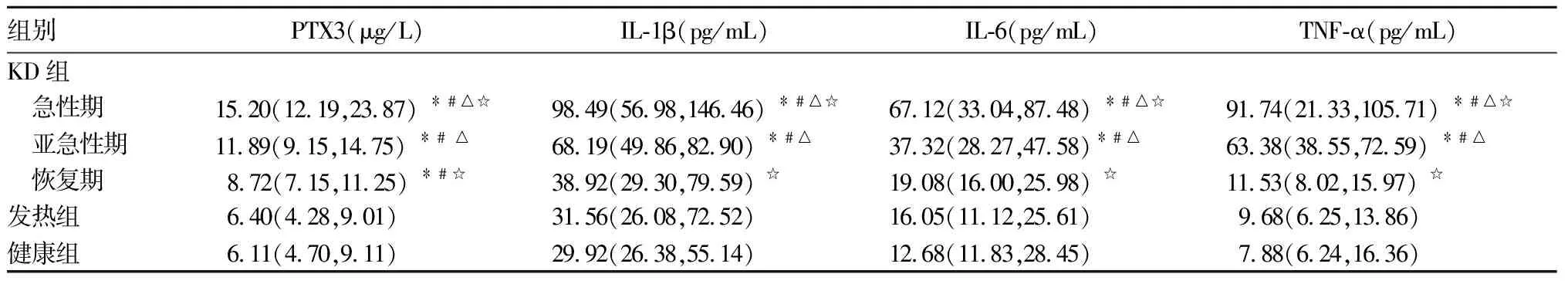
表1 各组外周血PTX3和IL-1β、IL-6、TNF-α水平比较[M(P25,P75)]
注:与健康组相比,﹡P<0.05;与发热组相比,﹟P<0.05;与KD组恢复期相比,△P<0.05;与KD组亚急性期相比,☆P<0.05。
2.2 CAL组和NCAL组患儿外周血PTX3和IL-1β、IL-6、TNF-α水平比较 结果见表2。

表2 CAL组和NCAL组患儿外周血PTX3和IL-1β、IL-6、TNF-α水平比较[M(P25,P75)]
注:与NCAL组相比,﹡P<0.05。
2.3 KD组患儿外周血PTX3与IL-1β、IL-6、TNF-α的相关性分析 KD组患儿外周血PTX3与IL-1β、IL-6、TNF-α均呈正相关(r分别为0.655、0.679、0.605,P均<0.01)。
2.4 KD组患儿急性期外周血PTX3对KD的诊断结果 因发热组和健康组间外周血各指标差异均无统计学意义,合并为对照组。ROC分析显示,KD组患儿急性期外周血PTX3诊断KD的AUC为0.909(95%CI为0.861~0.957,P<0.01),计算可得最大Youden指数为0.682。取PTX3>11.7 μg/L为界值,外周血PTX3诊断KD的灵敏度为76.6%、特异度为91.7%。
3 讨论
研究[5]认为,KD为患儿被多种微生物损伤后促进B细胞、T细胞参与免疫激活,导致炎性介质和细胞因子瀑布样效应,最后引起全身炎症反应。IL-1β、IL-6、TNF-α是研究较多的炎性细胞因子。本研究发现,KD患儿急性期炎症因子IL-1β、IL-6、TNF-α均较健康组和发热组明显升高,治疗后明显下降,恢复期已趋正常,与健康组和发热组无差异,与相关研究[6,7]结果一致。因亚急性期时容易出现IL-1β、IL-6、TNF-α指标假阳性,故IL-1β、IL-6、TNF-α检测仅可考虑作为KD急性期实验室诊断指标。
PTX是先天性体液免疫的重要组成部分,包括长链家族及短链家族成员。长链家族中的PTX3作为惟一的可溶性模式识别受体,仅在接受并结合TNF-α、IL-1β等炎症因子、Toll样受体激动剂、脂多糖等炎症信号配体时合成,正常情况下表达很低。PTX3在体内参与免疫防御、炎症、细胞凋亡、血管重塑等多种生物学反应,与众多免疫相关性疾病有密切关系[8, 9]。PTX3主要由血管内皮细胞和巨噬细胞产生,可直接地反映动脉局部炎症状态[10]。外周血PTX3反应迅速,升高时间约6~8 h,且在炎症反应中存在时间持久[11,12]。研究[13]证实,PTX3在血液中的存在时间较长,易检测,且基因较恒定,不受总胆固醇、高密度脂蛋白、血红蛋白、吸烟、肥胖和性别等因素影响,利于临床应用。在过敏性紫癜性肾炎、抗中性粒细胞胞浆抗体相关性小血管炎等研究[14,15]中均发现血清PTX3水平可反映血管炎严重的程度及活动性。本研究发现,KD组患儿PTX3与炎症因子IL-1β、IL-6、TNF-α成正相关,说明PTX3的产生与免疫应答的机制相关;ROC显示急性期外周血中PTX3诊断KD的效能较高,若以PTX3>11.7 μg/L为诊断界值,特异度可达91.7%、灵敏度为76.6%。CAL组患儿PTX3水平高于NCAL组,且在病程中也表现出与病情活动相关变化趋势,故外周血中PTX3水平与疾病严重程度、活动性及治疗反应相关,适用作为监测血管炎进展的标志物。本研究发现,KD组患儿恢复期PTX3水平仍高于健康组和发热组,说明血管炎症部位产生的PTX3在发病后至少持续1个月,可指导临床上进行持续干预。
综上所述,外周血PTX3作为一种新的生物学标志物,有助于KD患儿的临床诊断、疾病活动性和严重性评估。
