中华眼镜蛇毒膜毒素-12对膀胱癌细胞侵袭、转移的抑制作用及机制
2019-01-10夏成兴孙王宏冯相鑫王海峰颜汝平何进禹路杨德林
夏成兴,孙王宏,冯相鑫,王海峰,颜汝平,何进,禹路,杨德林
(昆明医科大学第二附属医院,昆明650101)
眼镜蛇毒膜毒素12(MT-12)是从中华眼镜蛇毒粗毒中提取出来的一种碱性膜活性多肽[1],属于三指毒素家族,该家族蛋白可以通过高度特异性靶向不同的受体和离子通道实现包括抗炎、抑癌、杀菌等药理作用。其中其抑癌作用近年来在多种肿瘤的研究中被广泛报道[2]。本课题组近年来针对MT-12对膀胱癌的抑癌作用进行了系列研究,发现MT-12在不杀伤正常膀胱上皮细胞的情况下,具有抑制膀胱癌细胞增殖、诱导细胞凋亡的作用[3]。但是关于MT-12抑制人膀胱癌细胞侵袭和转移的作用及分子机制尚不明确。2016年7月~2017年7月,我们应用MT-12作用于膀胱癌细胞系T24、RT4,观察其对膀胱癌细胞侵袭、转移能力的影响,探讨MT-12抑制肿瘤细胞侵袭转移的机制,为膀胱癌的治疗提供新方向。
1 材料与方法
1.1 主要材料与试剂 MT-12单体提取于中华眼镜蛇毒,由中国科学院昆明动物所动物毒素研究室惠赠;为考察多种膀胱癌细胞,纳入两种人膀胱癌细胞系,分别为膀胱移行上皮细胞癌细胞T24、膀胱移行细胞乳头状瘤细胞RT4,均由昆明医科大学第二附属医院中心试验室提供;促瘤剂佛波酯(PMA)购于美国Sigma-Aldrich公司;RPMI-1640培养基及胎牛血清购自美国GIBCO公司;TaqMan逆转录试剂盒、TaqMan PCR Master Mix试剂盒购于美国Applied Biosystems公司;ELISA试剂盒购于上海凯基公司。
1.2 药物配制 MT-12溶液:将1 g MT-12溶于200 mL DMSO溶液里,配置为5 g/L的贮存浓度,-20 ℃保存。使用时,应用培养基稀释获得MT-12工作浓度,分别为0.10、0.25、0.50 μg/mL。PMA溶液:用无水乙醇溶解1 mg PMA,配制成1 mol/L储存液,-20 ℃保存。使用时应用培养基稀释成100 nmol/L的工作液。
1.3 细胞培养 细胞用含10%胎牛血清的RPMI-1640培养基培养,置于37 ℃、CO2体积分数为5%及饱和湿度的条件下培养。
1.4 细胞迁移能力测算 采用细胞划痕实验。将T24、RT4细胞以5×105/孔的密度分别接种于6孔板中,设置空白对照组(Ctrl组)、溶媒对照组(NC组)、0.25 μg/mL组、0.50 μg/mL MT-12组,分别应用PBS、0.1%DMSO、0.25 μg/mL MT-12、0.50 μg/mL MT-12处理细胞24 h。当细胞铺满板时,用200 μL移液器吸头沿底部作“一”字划痕,处理细胞24 h后观察测量划痕距离变化并拍照,计算细胞迁移抑制率=(处理组处理前划痕宽度-处理组处理后划痕宽度)/(空白对照组处理前划痕宽度-空白对照组处理后划痕宽度)×100%。
1.5 细胞黏附能力测算 采用细胞黏附实验。将处于对数生长期的T24、RT4细胞以1×105/孔接种于24孔板,当细胞单层铺满时,设置空白对照组(Ctrl组)、溶媒对照组(NC组)、0.25 μg/mL、0.50 μg/mL MT-12组,分别应用PBS、0.1%DMSO、0.25 μg/mL MT-12、0.50 μg/mL MT-12处理2 h后,去除未黏附的细胞,每孔加100 μL的0.25% Rose Bengal染色液,室温静置5 min后,吸弃染料,每孔加入1∶1的95%乙醇溶液和PBS 200 μL,室温静置30 min。在酶联免疫检测仪波长570 nm处测定各孔的吸光度(D)值。细胞黏附率=(内皮细胞和肿瘤细胞D值-内皮细胞D值)/内皮细胞D值×100%。
1.6 细胞基质金属蛋白酶(MMP)-2、MMP-9酶活性含量检测 采用凝胶酶谱分析法。将T24、RT4细胞接种于6孔板中。待细胞铺满后,设置空白对照组(Ctrl组)、MT-12组、PMA组、PMA+MT-12组,分别应用PBS、0.50 μg/mL MT-12、100 nmol/L PMA、0.50 μg/mL MT-12+100 nmol/L PMA干预细胞24 h。24 h后裂解细胞,4 ℃离心,取上清,采用BCA法测定蛋白浓度。配制10% SDS-PAGE胶,其中分离胶含0.1%Ⅳ型胶原。将各组的样品提取的蛋白,加入泳道(按每泳道100 μg蛋白量计算样品上样量,上样量6~20 μL),电流强度20 mA,4 ℃电泳90 min,将胶带置入含2.5% Triton-X 100的培养皿室温振荡30 min洗脱后,再加入酶反应液 37 ℃摇床过夜。0.5%考玛斯亮蓝R-250染色室温振荡30 min,放入脱色液中至胶原酶消化区透明清晰为止。凝胶于UV Ipro凝胶图像分析系统下观察并摄像,读取各消化条带的灰度和面积,计算酶解活性含量=条带面积×(条带灰度-背景灰度)。
1.7 细胞侵袭转移相关因子mRNA表达检测 采用RT-PCR法。将T24、RT4细胞接种于6孔板中。待细胞铺满后,设置空白对照组(Ctrl组)、MT-12组、PMA组、PMA+MT-12组,分别应用PBS、0.50 μg/mL MT-12、100 nmol/L PMA、0.50 μg/mL MT-12+100 nmol/L PMA干预细胞24 h。TRIzol一步法提取总RNA,cDNA合成及RT-PCR实验步骤按逆转录试剂盒,RT-PCR试剂盒的说明书完成。侵袭转移相关因子各引物分别为:内参β-actin 正向序列5′-TCCGTGACATCAAGGAGAAGC-3′,反向序列5′-GCACCGTGTTGGCGTAGAG-3′;细胞间黏附因子-1(ICAM-1)正向序列5′-ACCACAGGAGCAACTTCT-3′,反向序列5′-CGTTCAGGACCACTTCAC-3′;血管黏附因子-1(VCAM-1)正向序列5′-ACTTCTGGTTGCTCTATTGTG-3′,反向序列5′-CAGTCATCTCAGTGGTAGTG-3′;血管生成因子(VEGF)正向序列5′-AGGGCAGAATCATCACGAA-3′,反向序列5′-TCTTGCTCTATCTTTCTTTGGTCT-3′。
1.8 细胞VEGF蛋白表达检测 采用ELISA法。于6孔板中培养T24、RT4细胞,待细胞铺满后,设置空白对照组(Ctrl组)、MT-12组、PMA组、PMA+MT-12组,分别应用PBS、0.50 μg/mL MT-12、100 nmol/L PMA、0.50 μg/mL MT-12+100 nmol/L PMA干预细胞24 h。取对数生长期细胞严格按照说明书进行操作,VEGF水平采用电化学发光法进行检测,所用仪器为 Lumat LB9507化学发光分析仪。

2 结果
2.1 各组细胞迁移能力比较 T24和RT4细胞中,0.25 μg/mL MT-12组、0.50 μg/mL MT-12组细胞迁移抑制率均低于NC组(P均<0.05)。见表1。
2.2 各组细胞黏附能力比较 T24和RT4细胞中,0.25 μg/mL MT-12组、0.50 μg/mL MT-12组细胞黏附率均低于NC组(P均<0.05)。见表1。
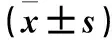
表1 各组细胞迁移、黏附能力比较
2.3 各组细胞MMP-2、MMP-9酶活性比较 T24和RT4细胞中,MT-12组MMP-9酶活性均低于Ctrl组(P均<0.05),PMA组MMP-9酶活性均高于Ctrl组,PMA+MT-12组MMP-9酶活性均低于PMA组(P均<0.05)。T24和RT4两株细胞中,各组间MMP-2酶活性差异均无统计学意义(P>0.05)。见图1~4。

注:1为Ctrl组;2为MT-12组;3为PMA组;4为PMA+MT-12组。
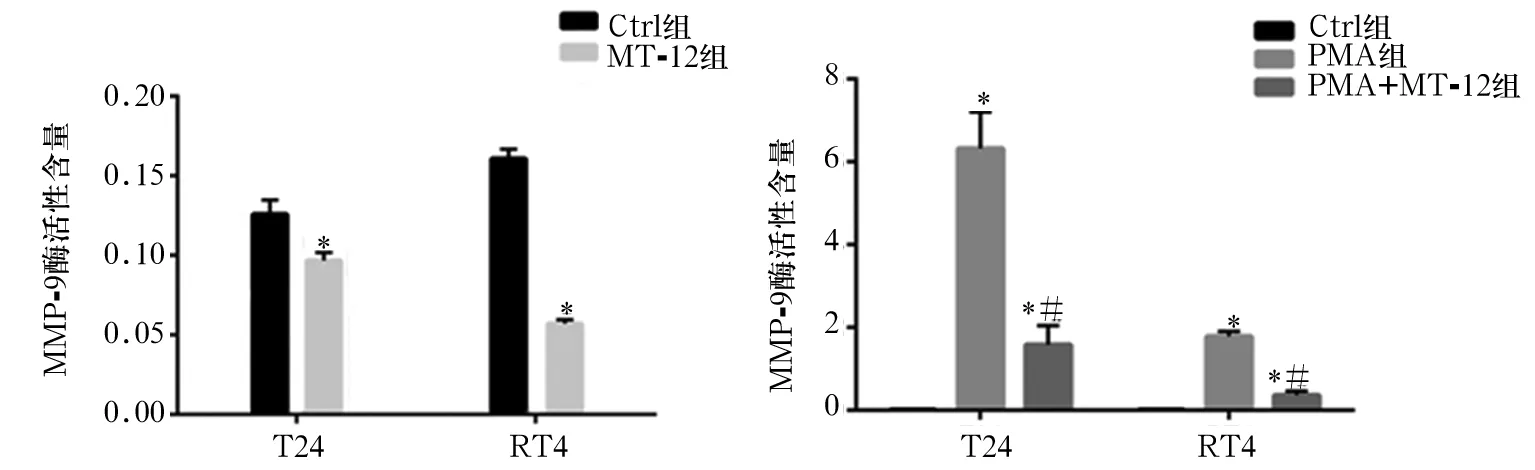
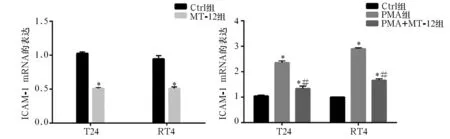
2.4 各组细胞ICAM-1、VCAM-1、VEGF mRNA表达比较 T24和RT4细胞中,MT-12组ICAM-1及VEGF的mRNA表达均低于Ctrl组(P均<0.05),而VCAM-1差异无统计学意义(P均>0.05)。PMA组ICAM-1及VEGF mRNA表达均高于Ctrl组,PMA+MT-12组ICAM-1、VEGF mRNA表达均低于PMA组(P均<0.05)。见图5~7。
2.5 各组细胞VEGF蛋白表达比较 T24和RT4细胞中,MT-12组与Ctrl组VEGF蛋白表达差异无统计学意义(P均>0.05);PMA组VEGF蛋白表达均高于Ctrl组,PMA+MT-12组VEGF蛋白表达均低于PMA组(P均<0.05)。见图8。
3 讨论
膀胱癌是泌尿系统常见肿瘤,近年来发病率和病死率呈逐年上升趋势[4,5],10%~30%的病例会进展为具有高度侵袭性、可迅速进展和转移的肌层浸润性膀胱癌[6],预后往往不佳[7]。故探讨膀胱癌侵袭转移的分子机制,研究抑制其转移能力的药物,在膀胱癌抗肿瘤研究中尤为重要。

图3 T24、RT4细胞中MMP-2酶活性表达比较
注:与Ctrl组比较,*P<0.05;与PMA组比较,#P<0.05。
注:与Ctrl组比较,*P<0.05;与PMA组比较,#P<0.05。
注:与Ctrl组比较,*P<0.05。

注:与Ctrl组比较,*P<0.05;与PMA组比较,#P<0.05。

注:与Ctrl组比较,*P<0.05;与PMA组比较,#P<0.05。
MT作为眼镜蛇毒中提取的膜活性多肽,其对肿瘤的选择性杀伤作用近年来被广泛报道[8]。有学者报道了MT同类毒素CTX1对不同细胞系的毒性作用,包括癌细胞(MCF-7、P388、K562、H22)和正常支气管上皮细胞16HBE,发现CTX1对肿瘤细胞的毒性显著高于正常细胞[9]。同时大量研究表明,MT也可一定程度抑制肿瘤细胞的侵袭转移能力。有学者在对乳腺癌的研究中发现,CTXⅢ能够通过抑制EGF/EGFR和Src介导的信号传导途径来抑制细胞转移[10];在口腔癌中,CTXⅢ可以通过MAPK和MMP信号传导途径抑制癌细胞的增殖和迁移[11]。因此,MT-12作为中华眼镜蛇MT单体,可能具有抑制肿瘤细胞转移侵袭能力的潜力。本研究发现,RT4和T24两株细胞中,0.25 μg/mL MT-12组、0.50 μg/mL MT-12组细胞迁移抑制率、细胞黏附率均低于NC组,提示MT-12低浓度(0.25 μg/mL)及高浓度(0.50 μg/mL)可明显抑制膀胱癌细胞迁移及黏附;考虑到RT4是膀胱移行细胞乳头状瘤,T24是膀胱移行上皮细胞癌,两种细胞的恶性程度不同、肿瘤驱动基因不同、基因突变情况不同,固而本研究结果也表明MT-12对不同膀胱癌细胞的侵袭、转移均有显著抑制作用。
肿瘤发生侵袭与转移是影响患者预后的重要原因。研究表明,肿瘤的侵袭转移和肿瘤细胞与其细胞外基质之间的相互作用密切相关[12]。而基质金属蛋白酶(MMPs)和丝氨酸蛋白水解酶介导的基膜和细胞外基质的降解和细胞迁移过程贯穿于肿瘤侵袭和转移的整个过程[13]。其中MMPs是一种鳌合了锌离子的蛋白酶类,主要作用底物为细胞外基质中的Ⅳ型胶原蛋白,通过降解细胞外基质,可以促进细胞向周围组织及血管的侵袭转移能力[14]。在肿瘤细胞中,MMPs表达量往往显著高于正常细胞,且其表达及活性与肿瘤细胞的恶性程度呈正相关[15]。其中Ⅳ型胶原蛋白酶是内皮细胞和肿瘤细胞分泌的MMPs中最重要的一个,其主要形式为糖化的MMP-9及非糖化的MMP-2[16]。Fiorentini等[17]研究发现,通过抑制MMP-2和MMP-9的活性降低了人转移性前列腺癌细胞和膀胱癌细胞的侵袭性。Yue等[18]研究也证实,人参皂苷Rg3可通过降低细胞MMP-9的活性,抑制恶性肿瘤的侵袭和转移。目前,MMP-9已成为评估肿瘤侵袭转移能力的重要指标,靶向MMP-9已成为临床防治肿瘤侵袭转移的重要策略。本研究结果显示,RT4和T24两株细胞中,MT-12组MMP-9酶活性均低于Ctrl组,提示MT-12可能通过抑制 MMP-9的活性,减缓细胞外胶原蛋白的降解,进而抑制细胞的侵袭转移。
VEGF在肿瘤的侵袭过程中有着重要的地位,不但可以促进肿瘤血管生成,同时可促进血管内皮细胞的收缩,从而加速肿瘤向血管浸润的过程[19,20]。研究发现,恶性肿瘤细胞可旁分泌大量VEGF,提高局部血管通透性,导致周围纤维蛋白沉着,促进单核细胞、内皮细胞和成纤维细胞的浸润,有利于形成肿瘤基质,促进肿瘤细胞进入新生血管,增强其转移能力[21]。Nowicki等[22]研究表明,VEGF作为血管内皮特异性标记物,在肝癌患者血清中升高,并且与侵袭性、转移和生存期较短密切相关。因而,降低细胞VEGF的表达,是抑制肿瘤侵袭转移的潜在靶点。本研究结果显示, MT-12组VEGF mRNA表达均低于Ctrl组,提示MT-12对膀胱癌细胞侵袭、转移的抑制作用可能与其抑制VEGF mRNA及蛋白表达有关。
细胞黏附分子(CAMs)在调控肿瘤细胞的黏附及转移中同样起到重要作用。CAMs是一类调节细胞与细胞之间,细胞与胞外基质间相互结合并起黏附作用的膜表面糖蛋白[23]。在对肿瘤生物学行为的研究中,CAMs中的ICAM-1及VCAM-1对肿瘤侵袭转移能力影响的研究较多[24]。研究表明,当肿瘤细胞大量表达ICAM-1及VCAM-1时,可促进肿瘤细胞黏附于血管内皮细胞,同时大量富集巨噬细胞,促进VEGF等生长因子的分泌,最终导致肿瘤微血管生成,促进肿瘤的转移[25]。Tuncer等[26]在结直肠癌中通过增强TSP-1和ICAM-1的表达改变内皮细胞特征,发现可增强细胞的侵袭能力。本研究发现,MT-12组ICAM-1 mRNA表达均低于Ctrl组,提示MT-12可能通过抑制ICAM-1的表达,抑制肿瘤细胞的黏附能力,从而抑制不同膀胱癌细胞的转移。
同时,为进一步明确MT-12对膀胱癌细胞侵袭、转移抑制作用的分子机制,我们将PMA处理膀胱癌细胞纳入本研究。PMA作为高效促瘤剂,通过活化蛋白激酶C,激活下游信号通路,促进肿瘤的生长、转移。本研究发现,PMA+MT-12组MMP-9酶活性、ICAM-1 mRNA、VEGF mRNA及蛋白表达均高于Ctrl组,表明PMA进一步增强了膀胱癌细胞的促瘤作用;PMA+MT-12组MMP-9酶活性、ICAM-1 mRNA、VEGF mRNA及蛋白表达均低于PMA组,提示MT-12对膀胱癌细胞侵袭、转移能力的抑制作用涉及对细胞MMP-9、VEGF、ICAM-1的调控。
综上所述,MT-12可以有效抑制膀胱癌细胞的迁移及转移能力,其发挥抑制作用的分子机制可能为降低肿瘤细胞中MMP-9、VEGF、ICAM-1的表达。
