膀胱癌细胞及组织中长链非编码RNA UCA1、miR-195表达变化及其与患者预后的关系
2019-01-10程琳孙荣凯付茂辉向桂玲
程琳,孙荣凯,付茂辉,向桂玲
(1山东省立第三医院,济南250031;2解放军第960医院;3复旦大学附属金山医院)
膀胱癌是泌尿系统常见的恶性肿瘤,是全球发病频率最高的恶性肿瘤之一,侵袭性膀胱癌患者5年生存率低于60%[1]。长链非编码RNA(LncRNAs)是内源性非编码的调节性RNA分子,在不同生物进程中具有调节作用,如染色体失活、基因组印记与发育等[2]。近年研究发现,LncRNAs在包括膀胱癌在内的多种恶性肿瘤中表达异常[3]。尿路上皮癌抗原1(UCA1)是第一个在膀胱癌中检测到的致瘤性LncRNAs,位于19p13.12基因位点[4]。UCA1在多种肿瘤中高度表达,如乳腺癌、胰腺癌、胃癌和结直肠癌,UCA1高表达可能作为预测这些肿瘤转移和预后的分子标记物[5]。研究发现,LncRNAs与微小RNA(miRNA)可通过相互调控,影响肿瘤的发生、发展,其中miR-195可抑制胃癌、肺癌的生长和转移,生物信息学软件预测,miR-195可作用于UCA1基因[6]。但二者在膀胱癌中的表达相关性及与临床病理特征的关系尚无报道。2013年6月~2015年1月,我们观察了膀胱癌细胞及组织中UCA1和miR-195的表达变化,探讨UCA1和miR-195表达与膀胱癌患者预后的关系。
1 材料与方法
1.1 细胞、试剂与仪器 人膀胱上皮永生化细胞株SV-HUC-1购自美国菌种保藏中心(ATCC),膀胱癌T24细胞株购自中科院上海细胞库。RPMI1640培养基(美国Gibco公司);胎牛血清(美国Gibco公司);TRIzol试剂(美国Invitrogen公司);Star Spin Small RNA Kit(美国ABI公司);LnRcute LncRNAs cDNA(美国ABI公司);miRNA逆转录试剂盒(美国ABI公司);实时荧光定量PCR试剂盒(日本Takara公司);Nanodrop2000(美国Thermo Scientific公司);荧光定量PCR仪(瑞士Roche公司);高速冷冻离心机(德国Eppendorf公司)。
1.2 细胞培养及细胞分组 SV-HUC-1、T24细胞均培养于含10%胎牛血清的RPMI1640培养基,在5%CO2、37 ℃的培养箱中培养,以SV-HUC-1作为对照组,以T24细胞为膀胱癌细胞组。当细胞生长至对数生长期时,TRIzol法提取细胞的总RNA用于后续实验。
1.3 膀胱癌组织标本及患者资料收集 选择山东省立第三医院2013年6月~2015年1月行根治性膀胱切除术的膀胱癌患者的组织标本50例,其中男42例、女8例,年龄38~74(58.35±7.31)岁。所有患者临床资料完整,术前均未接受放疗、化疗及免疫治疗,术后病理诊断均为膀胱尿路上皮癌。另选取患者离癌组织5 cm以上、外观无异样的癌旁组织作为正常对照,病理诊断均为正常膀胱组织。术中取材后,立即置于液氮罐中速冻,随后在-80 ℃保存。选取的组织标本按WHO标准进行病理分级,其中G1级15例、G2级23例、G3级12例;按国际抗癌联盟(UICC)标准进行临床分期,其中T1期21例、T2期12例、T3期13例、T4期4例;按是否出现肿瘤浸润,其中非肌层浸润性膀胱癌(NMIBC)15例、肌层浸润性膀胱癌(MIBC)35例;肿瘤初发10例,复发40例。采集标本均经患者知情同意及医院伦理委员会批准。
1.4 UCA1、miR-195检测 采用RT-PCR法。参照试剂盒说明书,分别采用TRIzol法和Star Spin Small RNA Kit提取总RNA和总小RNA。选用LnRcute LncRNAs cDNA试剂盒将提取的RNA逆转录为cDNA;miRNA First Strand cDNA逆转录试剂盒将提取的small RNA逆转录为cDNA。以cDNA为模板,采用SYBR Green法检测UCA1(GAPDH为内参)和miR-195(U6为内参)表达水平。UCA1、miR-195及内参引物由上海生物工程股份有限公司合成。UCA1上游引物5′-CTCTCCATTGGGTTCACCATTC-3′,下游引物5′-GCGGCAGGTCTTAAGAGATGAG-3′;miR-195上游引物5′-CTCAAGGCAACCTACCGAAAAG-3′,下游引物5′-TATCGGACCCATCACGGAGTGG-3′;GAPDH上游引物5′-TGAAGGTCGGAGTCAACGG-3′,下游引物5′-CCTGGAAGATGGTGATGCG-3′;U6上游引物5′-GATTAGAACCGTCGGTAACGGAA-3′,下游引物5′-AGCGATCTCGTTGGCCTTTCTACC-3′。UCA1基因反应条件:94 ℃预变性2 min,95 ℃ 15 s、60 ℃ 30 s、72 ℃ 15 s,40个循环;72 ℃延伸10 min。miR-195反应条件:94 ℃预变性2 min,94 ℃ 20 s、60 ℃ 30 s,40个循环。PCR产物特异性用2%琼脂糖凝胶电泳检测,基因表达差异采用2-ΔΔCT法进行分析。以UCA1或miR-141相对表达量 2-ΔΔCT≥1为阳性表达。
1.5 术后随访 术后对50例患者进行随访至2018年1月。采用电话、访视等方式进行随访,第1年每3个月随访1次,随后每6个月随访1次,随访内容包括患者的生存状态,其中已死亡患者包括死亡原因和死亡日期。所有患者均成功获得随访,其间死亡患者以截尾数据统计,存活者均随访3年。

2 结果
2.1 两组细胞中UCA1、miR-195表达比较 膀胱癌细胞组UCA1表达高于对照组、miR-195表达低于对照组(P均<0.05)。见表1。
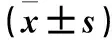
表1 两组细胞中UCA1、miR-195表达比较
2.2 癌旁组织及膀胱癌组织中UCA1、miR-195表达比较 膀胱癌组织中UCA1表达高于癌旁正常组织,miR-195表达低于癌旁正常组织(P均<0.05)。见表2。
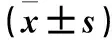
表2 癌旁组织及膀胱癌组织中UCA1、miR-195表达比较
2.3 膀胱癌组织中UCA1、miR-195表达与患者临床病理特征的关系 膀胱癌组织中,UCA1阳性38例,miR-195阳性7例。病理分级较高、临床分期T3~T4者、肿瘤浸润及复发者UCA1表达较高,病理分级低者、临床分期T1~T2者、肿瘤未浸润及初发者miR-195表达较高(P均<0.05)。UCA1、miR-195表达与患者年龄、性别无相关性(P均>0.05)。见表3。
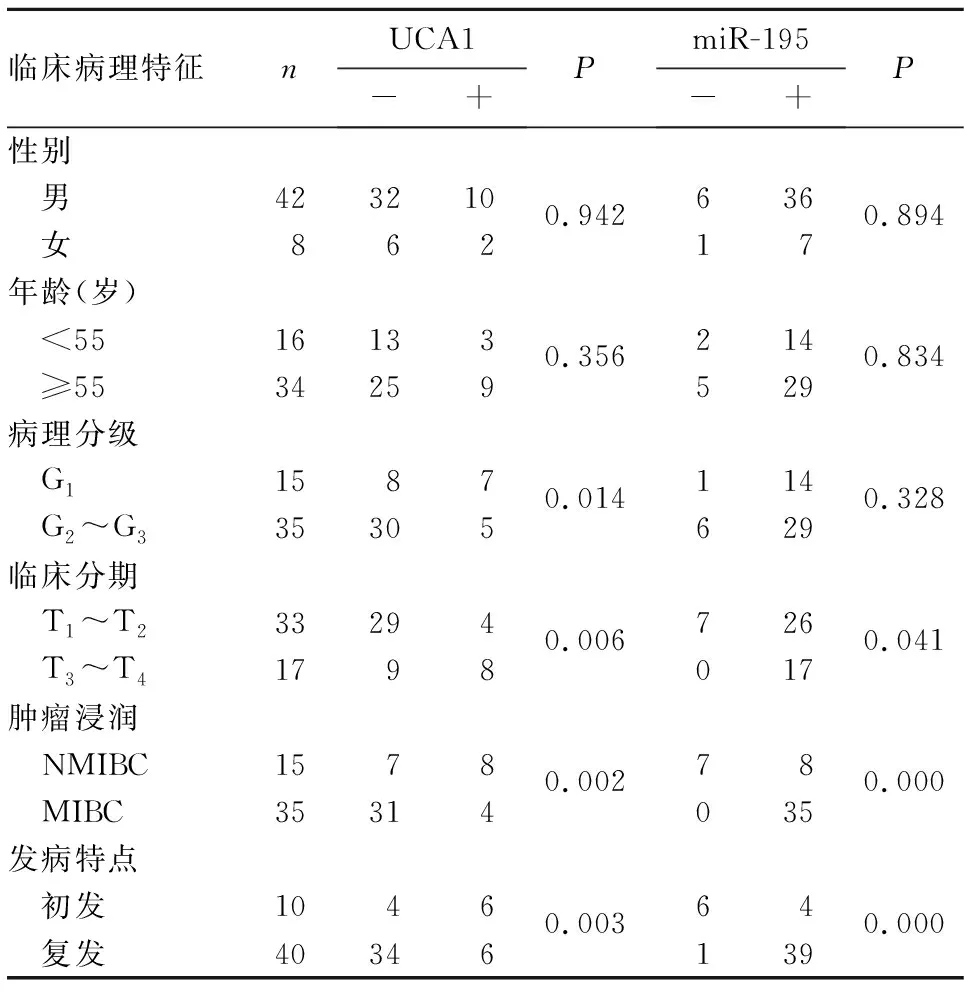
表3 UCA1和miR-195在膀胱癌组织中的表达与临床病理资料的关系(例)
2.4 膀胱癌组织中UCA1与miR-195 mRNA表达的相关性 Pearson相关性分析示,膀胱癌组织中UCA1与miR-195表达呈负相关(r=-0.673,P<0.05)。
2.5 膀胱癌患者生存情况及其影响因素的Cox回归分析结果 随访3年,所有患者均成功获得随访,50例患者中存活患者27例,死亡患者23例,平均生存率为54.00%。采用Kaplan-Meier法计算患者6个月、1年、3年生存率分别为64.41%、61.96%、54.16%。患者生存率与患者的性别、年龄、病理分级、肿瘤浸润及发病特点之间无明显相关性(P均>0.05)。临床分期T1~T2患者生存率高于T3~T4期患者,UCA1阴性表达患者生存率高于阳性表达患者,miR-195阳性表达患者生存率高于阴性表达患者(P均<0.05)。Cox回归模型示UCA1 阳性表达、miR-195阴性表达、临床分期T3~T4及肿瘤转移是影响膀胱癌患者预后的独立危险因素(P均<0.05)。见表4。

表4 影响膀胱癌患者生存因素的Cox回归分析
3 讨论
膀胱癌是最常见的泌尿系统恶性肿瘤,其发病率和病死率一直居高不下。膀胱癌患者死亡的主要原因是肿瘤的复发和转移。当前,膀胱癌的治疗以手术治疗为主,但膀胱癌的多中心起源特性,使其具有易耐药、易侵袭、易复发等特点,故目前对膀胱癌的研究主要集中在寻找从源头调控膀胱癌生物学特性的有效靶点[7]。膀胱癌的发生、发展受多因素影响,如DNA突变、蛋白质异常,RNA异常也影响着膀胱癌的进展。LncRNAs是一类非编码RNA,广泛存在于细胞内,随着对肿瘤发病机制研究的深入,国内外学者意识到LncRNAs在多种肿瘤中发挥重要的调节作用。LncRNAs对肿瘤的调控作用主要是通过影响细胞表观修饰、信号转导通路及RNA编辑等方式[8]。越来越多的报道显示LncRNAs表达失调与包括膀胱癌在内的多种癌症的病理机制密切相关,故LncRNAs未来有望成为肿瘤临床诊断和治疗的分子靶标[9]。
UCA1是膀胱癌中具有特异性和敏感性的致瘤LncRNAs,包含3个外显子和2个内含子,其高表达也与多种癌症的侵袭有关。刘咏松等[10]研究表明,膀胱癌细胞系中UCA1表达水平高于非膀胱癌细胞系,且膀胱癌组织中UCA1表达水平亦高于正常癌旁组织。Liu等[11]研究表明,膀胱癌组织中UCA1表达水平显著高于癌旁正常组织,呈特异性表达。Milowich等[12]报告显示UCA1的表达率越高,肿瘤病理分级越高或患者预后越差,UCA1促进膀胱癌的侵袭和转移。本研究结果显示,UCA1在膀胱癌细胞系中的表达水平显著高于其在非膀胱癌细胞系的表达,膀胱癌组织中UCA1表达高于癌旁正常组织,提示UCA1的阳性表达与膀胱癌密切相关。为进一步探究UCA1与膀胱癌的联系,我们还对UCA1表达与膀胱癌患者的临床参数进行相关性分析,结果显示UCA1表达与病理分级、临床分期、肿瘤浸润及发病特点显著相关,随着肿瘤恶性程度增高而增高。进一步分析显示UCA1阳性表达患者的生存率低于阴性表达患者的生存率,提示UCA1阳性表达与膀胱癌患者的预后不良显著相关,推测UCA1可作为膀胱癌诊断及预测患者预后的分子标志物。
近年来,对miRNA在肿瘤中的调控机制研究的较为广泛,其参与了肿瘤多种生理病理过程,特别是在肿瘤发生、发展中起着重要作用。miRNA依据靶基因的不同,从而发挥不同的作用,既可促进癌症的进展也可抑制癌症的进展[13]。大量研究表明,miR-195在肿瘤增殖、侵袭和转移中发挥着关键的转录调节作用,且在多种癌症中抑制肿瘤细胞生长、迁移和侵袭[14]。Zhang等[15]研究显示,miR-195作为一个抑癌基因,可抑制非小细胞肺癌(NSCLC)细胞的生长和转移,在非小细胞肺癌中表达下调。本研究结果显示,miR-195在膀胱癌细胞系中的表达水平低于其在非膀胱癌细胞系的表达,膀胱癌组织中miR-195表达低于癌旁正常组织,提示miR-195的阴性表达与膀胱癌发生密切相关。为进一步探究miR-195与膀胱癌的联系,我们也对miR-195表达与膀胱癌患者的临床参数进行相关性分析,结果显示miR-195表达与临床分期、肿瘤浸润及发病特点显著相关,随着肿瘤恶性程度增高而降低;进一步分析显示miR-195阳性表达患者生存率显著低于阴性表达患者的生存率,提示miR-195阴性表达与膀胱癌患者的预后不良显著相关,推测miR-195可能调控肿瘤转移和侵袭,可作为判断膀胱癌患者预后的新指标。
LncRNAs可以发挥miRNA“海绵”作用,与内源性RNA竞争,影响miRNA的调控作用。此外,LncRNAs可作为miRNA的前体直接影响miRNA的生物学功能,两者相互作用影响肿瘤的发生、发展[16]。Cai等[17]报道显示,通过沉默LncRNAs-TUG1可靶向上调miR-144表达,提高胶质细胞瘤血-肿瘤屏障的渗透性,增强抗肿瘤药物的利用率。本课题组前期研究通过生物信息学软件预测,发现miR-195可作用于UCA1基因,推测UCA1基因能够与miR-195靶点结合,调控miR-195的表达[6]。本研究结果显示,膀胱癌组织中UCA1与miR-195表达呈负相关,提示高表达的UCA1基因可能通过抑制miR-195表达从而调控膀胱癌的进程,二者在判断膀胱癌预后中发挥着更重要的作用,但具体作用机制有待更进一步的研究。
综上所述,膀胱癌细胞及组织中UCA1表达增高、miR-195表达降低,UCA1表达增高、miR-195表达降低均与膀胱癌患者的预后不良显著相关,UCA1、miR-195对预测恶性肿瘤的生长、侵袭及预后发挥着重要的作用,联合检测UCA1与miR-195表达有望成为预测膀胱癌患者预后的分子标记物,为膀胱癌靶向治疗提供新的思路。
