2.4 mm透明角膜单切口超声乳化白内障吸出术对角膜的影响△
2019-01-10李盼盼管宇陈诵惟孙荪吴坚黄晓波管怀进
李盼盼 管宇 陈诵惟 孙荪 吴坚 黄晓波 管怀进
白内障是全球首位致盲性眼病,占全球盲人的50%左右[1],目前手术治疗仍是唯一公认有效的治疗方法,超声乳化白内障吸出术(phacoemulsification aspiration,PEA)是现阶段应用最为广泛的白内障手术方法。在PEA中,减小或减少角膜切口可以增加术中前房稳定性[2-4],降低眼内炎发生的风险[5],减少术源性散光(surgically induced astigmatism,SIA)[6-7]。随着仪器设备和手术技术的不断改进,白内障术后威胁视力的并发症在不断减少。但PEA术后角膜水肿仍是影响术后早期视功能的主要原因[8-9],角膜水肿与术中角膜内皮损伤密切相关,角膜内皮细胞丢失一般通过角膜内皮显微镜检查角膜中央1 mm 范围内的角膜内皮细胞密度(endothelium corneal density,ECD)和细胞形态的变化来评估[10-11]。因为角膜内皮细胞损伤改变了角膜钠泵的活性,导致角膜基质层液体含量增加[12],国外有学者认为角膜体积(corneal volume,CV)亦可认为是整个角膜内皮细胞功能评估的指标,能够评估整个角膜的情况[13-14]。目前,超声乳化技术包括单手(仅需制作单个切口)和双手超声乳化技术(需制作一个主切口和一个侧切口)[15-16]。本研究的主要目的是比较单切口PEA和双切口PEA术后10 mm范围内CV(10 mm-CV)、中央角膜厚度(central corneal thickness,CCT)、角膜内皮细胞密度及形态,从而评估单切口PEA对角膜的影响。
1资料与方法
1.1一般资料本研究为连续性非随机临床病例对照研究,纳入2016年8月至2017年12月在南通大学附属医院眼科行2.4 mm透明角膜单切口PEA联合人工晶状体植入术的年龄相关性白内障(age-related cataract,ARC)患者(100眼),并选择此时间段内与之眼轴、前房深度(anterior chamber depth,ACD)、晶状体核混浊(nuclear opacities,NO)等眼部和全身情况相匹配的行透明角膜双切口PEA联合人工晶状体植入术的患者(100眼)。所有患者均符合以下纳入和排除标准。纳入标准:为ARC且按晶状体混浊分类系统Ⅲ(lens opacities classification system Ⅲ,LOCS Ⅲ)分级为NO1~NO3者;能够顺利完成超声乳化并将人工晶状体植入囊袋者。排除标准:角膜白斑、角膜瘢痕等角膜病变;囊袋稳定性异常、瞳孔不能散大、晶状体半脱位等植入人工晶状体困难者。按照手术切口分为单切口组和双切口组。本研究共纳入176例(男57例,女119例)200眼(右114眼,左86眼),其中8例一眼行单切口PEA,而另一眼行双切口PEA。单切口组和双切口组患者的性别、眼别、年龄、眼轴、ACD、NO、晶状体厚度、眼压比较,差异均无统计学意义(均为P>0.05)。见表1。

表1两组患者术前基本资料
注:*:Mann-WhitneyU检验;#:独立样本t检验;1 kPa=7.5 mmHg
1.2常规检查所有患者均进行完整的眼科检查,主要包括裸眼远视力(uncorrected distance visual acuity,UDVA)、矫正远视力(corrected distance visual acuity,CDVA)。利用Lenstar(LS900,Haag Streit,瑞士)测量眼轴长度、ACD、晶状体厚度等;利用Pentacam(70700,Oculus,德国)测量10 mm-CV、CCT、角膜散光等;利用角膜内皮显微镜(EM-3000,Tomey,日本)检查角膜内皮细胞;利用Alpin矢量分析法[17]计算SIA。
1.3手术方法所有手术均由同一位经验丰富的医师完成,所有患者均使用Centurion Vision System超声乳化系统(爱尔康,美国),超声乳化参数设置:爆破模式;能量上限60%;灌注液瓶高105 cm;负压500 mmHg;流量32 mL·min-1。术中使用黏弹剂均为透明质酸钠(博士伦,美国),灌注液均为平衡盐溶液。所有患者植入的人工晶状体均为单焦点非球面IOL (PY-60AD,HAOYA,日本)。(1)单切口PEA组:在Verion导航引导下在角膜缘135°上做2.4 mm透明角膜切口;向前房内注入适量的黏弹剂,中央连续环形撕囊,直径为 5.5~6.0 mm;充分水分离、水分层,松动并旋转晶状体核,进行囊下水分离术,使囊膜与囊膜下的皮质分离同时进行层间水分离技术,使混浊的晶状体核从包绕的皮质中充分游离出;超声乳化针尖斜面贴紧晶状体核,轻压晶状体核,低能量超声乳化使针尖嵌入晶状体,在高负压状态下滑向赤道部牢固吸住晶状体核,一面乳化一面转动晶状体核,将核由周边向中央一层层切削,直至完全乳化吸收,注/吸(inspiration/aspiration,I/A)模式抽吸残留皮质;前房及囊袋内注入适量的黏弹剂,用推助器植入可折叠型人工晶状体,调正人工晶状体的位置;I/A吸出前房及囊袋内的黏弹剂;应用灌注液密闭透明角膜切口;结膜囊内涂典必殊眼膏,单眼包扎,安返病房。(2)双切口PEA组:在Verion导航引导下在角膜缘135°上做2.4 mm透明角膜切口;向前房内注入适量的黏弹剂,中央连续环形撕囊,直径为5.5~6.0 mm;充分水分离、水分层;在Verion导航引导下,在角膜缘15°位置做1.0 mm侧切口;超声乳化针尖在晶状体表面先雕刻一个沟槽,将核分成两半,将1/2核块转至下方,再用劈核钩将1/2 核块分割成更小的碎块,逐块乳化,直至完全乳化吸收;其余步骤同单切口组。
术中记录2组超声时间、累积释放能量(cumulative dissipated energy,CDE)、灌注液的使用量和手术时间(开始时间为制作角膜切口,结束时间为松解开睑器)[18]。术后1周、1个月、3个月随访复查UDVA、DCVA、角膜散光、10 mm-CV、CCT及角膜内皮细胞参数。

2结果
2.1术中情况两组患者均顺利完成PEA联合人工晶状体植入术,两组患者均未出现角膜热灼伤、虹膜损伤及后囊膜破裂。单切口组与双切口组的超声时间、CDE、灌注液的使用量及总手术时间比较,差异均无统计学意义(均为P>0.05)。见表2。
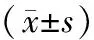
表2两组患者超声乳化参数及手术时间
2.2视力与SIA术后各时间点UDVA和CDVA与术前相比差异均有统计学意义(均为P<0.001);术后1周,单切口组的UDVA和CDVA均高于双切口组,差异均有统计学意义(均为P<0.05),术后1个月、3个月,差异均无统计学意义(均为P>0.05)。两组患者角膜前表面的SIA在术后随访各时间点差异均无统计学意义(均为P>0.05)。术后1周,单切口组角膜后表面的SIA明显低于双切口组(P=0.043),术后1个月和3个月差异均无统计学意义(均为P>0.05)。见表3。
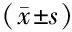
表3两组患者UDVA、CDVA及SIA比较
注:*:独立样本t检验;**:成组t检验;Pa:术前与术后比较;Pb:两组间比较
2.3CV和CCT两组患者术后1周、1个月10 mm-CV较术前均显著升高(均为P<0.05),术后 3个月均恢复至术前水平(均为P>0.05)。术后 1周,单切口组10 mm-CV小于双切口组,差异有统计学意义(P=0.006),术后1个月、3个月两组间差异均无统计学意义(P=0.563、0.290)。两组患者术后1周CCT较术前均显著升高(均为P<0.05)。两组术后1个月、3个月均恢复至术前水平(均为P>0.05)。术后1周两组间差异有统计学意义(P=0.041),术后1个月、3个月两组间差异均无统计学意义(均为P>0.05)。见表4。
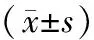
表4两组患者10 mm-CV及CCT
注:*:独立样本t检验;**:成组t检验;Pa:术前与术后比较;Pb:两组间比较
2.4角膜内皮细胞两组患者术后ECD、六角形细胞比例较术前均明显下降(均为P<0.001),两组间在术后 1周、1个月、3个月比较差异均无统计学意义(均为P>0.05)。两组术后1周、1个月、3个月角膜内皮细胞丢失率(endothelium corneal loss,ECL)比较,差异均有统计学意义(均为P<0.05)。两组患者术后1周、1个月、3个月角膜内皮细胞平均面积(average size,Save)较术前均显著升高(均为P<0.001),术后1周两组间差异有统计学意义(P=0.047),术后1个月、3个月两组间差异均无统计学意义(均为P>0.05)。见表5。
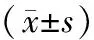
表5两组患者角膜内皮细胞参数
注:HEX%:六角形细胞比例;*:独立样本t检验;**:成组t检验;Pa:术前与术后比较;Pb:两组间比较
3讨论
PEA术后早期视觉质量的提高是术者和患者的共同追求,术后暂时的角膜水肿是影响早期视力恢复的主要原因[9]。本研究中两组患者术后视力均较术前有显著提高,术后1周单切口组的UDVA和CDVA均高于双切口组,差异均有统计学意义(均为P<0.05)。主要是因为术后1周,单切口组CV小于双切口组,即术后1周单切口组的角膜水肿程度轻于双切口组。
角膜内皮细胞损伤是PEA常见的并发症,角膜内皮损伤程度是评判内眼手术安全性的重要指标。角膜内皮细胞结构的完整对维持角膜的透明具有重要的作用,角膜内皮细胞损伤后不能再生,只能依靠相邻细胞扩张和移行来填补缺损区。临床上常用角膜内皮显微镜测量ECD和细胞形态的变化来评估[11]。角膜内皮细胞的缝隙连接与基质构成的机械屏障及内皮细胞离子泵的主动代谢功能使角膜处于相对脱水状态,角膜内皮细胞一旦损伤会引起角膜基质层液体含量增加,CV能够作为评估角膜内皮细胞功能的直接指标[19]。
角膜内皮细胞损伤与术中超声乳化的时间、CDE密切相关,单切口组与双切口组的超声时间、CDE差异均无统计学意义(均为P>0.05)。Czajka等[2]研究显示,单手、双手PEA的CDE及手术时间没有差异。ACD、NO、眼压等也会影响角膜内皮细胞损伤[20-21],为了控制偏倚,本研究中患者术前ACD、NO、眼压差异均无统计学意义(均为P>0.05)。
本研究术后1周单切口组(单手)PEA的CV显著小于双切口组PEA,考虑原因是以下几点:(1)单手PEA不需要辅助器械协助劈核,在超声乳化过程中减少器械直接损伤角膜的机会;(2)单手PEA在超声乳化过程中超乳针尖斜面完全埋进晶状体核表层,堵住能量向外释放,从而减少对角膜内皮以及眼内组织的损伤。ECD和ECL是评估角膜内皮损伤常用的指标。Kawahara等[15]研究显示,单手PEA的ECL轻度低于双手PEA,两组间差异无统计学意义。本研究中单手PEA的ECL低于双手PEA,差异有统计学意义(P<0.05)。国内外均有学者提出单手PEA更适合用于Ⅱ级核和中等硬度的Ⅲ级核,对于Ⅳ级核主张在双切口准备的前提下施行手术,不应为了追求单手PEA效果而引起其他并发症[16]。角膜内皮细胞Save的大小也是角膜内皮损伤的指标,角膜内皮细胞不能再生,一旦损伤只能靠邻近细胞的移行及变形来填充空缺,在修复的过程中角膜内皮细胞Save就会增大。本研究中两组患者术后各时间点Save均较术前增大,差异均有统计学意义(均为P<0.05)。
在本研究中两组间术后1周ECD和CV之间的差异程度不一致(ECD:P=0.939;CV:P=0.006)。我们考虑原因如下:(1)超声乳化后CV的增加并不一定是由于角膜内皮损伤所致。其他的一些原因,如角膜手术过程中的热损伤直接导致的组织水肿,从而增加CV[14];(2)这两个参数测量仪器及测量角膜的范围有差异。本研究中CV是角膜中央10 mm范围,而ECD是角膜内皮显微镜测量的角膜中央 1 mm 范围。
因为单手PEA更适合用于Ⅱ级核和中等硬度的Ⅲ级核,本研究仅纳入NO<3的患者。因此,本研究结论只是局限于软到中等硬度核的白内障患者。此外,本研究只是从流体动力学上论述单切口(单手)PEA具有更好的前房稳定性,未能实时监测两组患者术中眼压的变化,有待进一步研究。
