rno-miR-30b-5p对葡萄膜炎大鼠Notch1和Dll4基因表达的调控作用△
2019-01-10殷学伟刘滨魏慧霞唐凯毕宏生郭大东
殷学伟 刘滨 魏慧霞 唐凯 毕宏生 郭大东
葡萄膜炎是临床常见的一类致盲性自身免疫性眼病,病因复杂,可造成视力不可逆性损害。Notch 信号通路是调节炎症反应和自身免疫性疾病的重要通路,可通过调控naïve CD4+T细胞的分化影响T辅助细胞的比例平衡发挥作用[1]。有研究发现,在葡萄膜炎眼组织中,浸润性Treg细胞主要表达Notch 1、Notch 2、Jag1和Dll4;Notch信号可负调控实验性自身免疫性葡萄膜炎(experimental autoimmune uveitis,EAU)小鼠浸润性Treg细胞的免疫抑制功能;Notch1缺陷型小鼠Treg细胞的转移显著降低了EAU眼组织中促炎细胞因子的产生和炎症细胞的浸润[2]。Ishida等[3]研究表明,Dll4介导的Notch信号的激活在EAU的发展中起重要作用。
MicroRNA(miRNA)是一类在基因转录后水平调控靶基因表达的功能性小RNA分子,可通过RNA干扰(RNA interference,RNAi)方式调控靶基因的表达。有研究发现,miR-30b可通过负调节Notch信号通路中Notch1基因的表达显著上调树突状细胞(DCs)中IL-10和NO的水平,在免疫应答中发挥负调控子的作用[4]。此外,miR-30b还可下调Notch信号通路中Dll4配体的表达水平,在血管发育和血管生成过程中发挥显著的调控作用[5]。但是,rno-miR-30b-5p对Notch信号通路中Notch1和Dll4基因表达的调控作用在葡萄膜炎发病中的作用机制尚不明确。本研究拟通过动物实验探讨rno-miR-30b-5p调控葡萄膜炎大鼠Notch1和Dll4基因表达的作用机制,阐释miR-30b-5p调控Notch1和Dll4基因表达对葡萄膜炎发展进程的影响,为临床治疗葡萄膜炎提供新的靶点和思路。
1材料与方法
1.1主要试剂及仪器LipofectamineTM2000转染试剂、293T细胞(Invitrogen公司,美国);荧光显微镜(Olympus IX71,日本);高纯度质粒抽提试剂盒cDNA逆转录试剂盒、2×SYBR Green I试剂盒(Qiagen公司,德国);CO2培养箱(力康公司,香港);生物安全柜(Thermo公司,美国);miR-30b-5p过表达载体菌液、报告基因检测试剂盒、miRNA转染试剂盒(上海吉满生物科技有限公司);胰蛋白酶、DMEM培养基(Gibco公司,美国);光感受器间维生素A结合蛋白(interphotoreceptor retinoid-binding protein,IRBP)(1177-1191;氨基酸序列:ADGSSWEGVGVVPDV,上海生工生物工程股份有限公司);结核菌素(tuberculin,TB)(H37RA;Difco公司,美国);完全弗氏佐剂(complete Freund’s adjuvant,CFA)(Sigma公司,美国);miRNA组织/细胞快速提取试剂盒(北京艾德莱生物科技有限公司);LightCycler®480实时荧光定量PCR仪(Roche公司,美国);Dual-Glo®Luciferase Assay System(Promega公司,美国);多功能酶标仪(Perkin-Elmer公司,美国);大鼠Notch1和Dll4蛋白ELISA试剂盒(武汉基因美生物科技有限公司)。
1.2实验动物及EAU模型制备选取6~8周龄健康Lewis大鼠(体质量160~180 g;购自北京维通利华公司)12只,随机分为对照组和EAU模型组,每组各6只。EAU模型组大鼠的躯干上皮下、后肢足垫及两侧腹壁各点一次性注射200 μL含有IRBP、TB、CFA和无菌磷酸盐缓冲液(phosphate buffer saline,PBS)的乳糜液以诱导EAU,对照组大鼠的相同部位注射等体积不含IRBP而含TB、CFA和PBS的乳糜液。
1.3双荧光素酶检测rno-miR-30b-5p调控Notch1和Dll4基因将miR-30b-5p过表达载体菌液接种至5 mL LB培养液中,37 ℃摇床(220 r·min-1)培养过夜,用高纯度质粒抽提试剂盒制备Notch1和Dll4基因质粒。用2.5 g·L-1胰蛋白酶将处于对数生长期的空白293T细胞消化,用完全培养基悬浮成单细胞悬液后进行细胞计数,并接种于24孔培养板过夜培养。转染2 h前更换为新鲜的培养基。取2支1.5 mL EP管,均加入50 μL无血清DMEM培养基,一支EP管加质粒后混匀,另一支EP管加0.633 μL的Lipofectamine®2000转染试剂后混匀,5 min后将两管液体合为一管混匀,室温放置15~20 min后均匀滴加到提前换过液的培养板中,置于CO2培养箱中培养。转染48 h后从培养箱中取出细胞,PBS洗涤2次,每孔加100 μL的1×被动裂解缓冲液(passive lysis buffer,PLB)。将样品转移至EP管中,12 000 r·min-1离心5 min,离心后将上清液移入新的EP管,将20 μL样品加入测量管中,另加入20 μL Firefly Luciferase Assay Reagent混匀2~3次后测定相对光单位(relative light unit,RLU)值,并将空白细胞裂解液作为对照孔。将检测后的样品与20 μL配制的Renilla Luciferase Assay工作液混匀 2~3次后测定RLU,同时设置Renilla Luciferase Assay工作液为空白对照孔。通过两次检测的RLU的比值来确定报告基因的激活程度。
1.4Q-PCR检测大鼠脾脏、淋巴结及眼组织中rno-miR-30b-5p、Notch1和Dll4基因的表达免疫后12 d,每组随机各选取4只大鼠,无菌环境下分离脾脏、淋巴结和眼组织,每只大鼠各取部分组织冻存于-80 ℃冰箱中用于ELISA检测,其余样品研磨后尼龙毛柱收集T淋巴细胞,分别提取各部位组织的miRNA和总RNA,K5600分光光度计检测RNA的纯度和浓度(A260/A280为1.8~2.1)。用cDNA反转录试剂盒分别将提取的miRNA和总RNA反转录合成cDNA,Q-PCR检测rno-miR-30b-5p、Notch1和Dll4基因的表达(反应体系为20 μL,每个基因设3个复孔),其中U6为rno-miR-30b-5p的内参,GAPDH为Notch1和Dll4基因的内参。引物序列分别为:U6反转录引物:5’-CGCTTCACGAATTTGCGTGTCAT-3’,双向引物序列包括上游引物:5’-GCTTCGGCAGCACATATACTAAAAT-3’,下游引物:5’-CGCTTCACGA-ATTTGCGTGTCAT-3’;rno-miR-30b-5p反转录引物:5’-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAAT-TGCACTGGATACGACAGCTGA-3’,双向引物序列包括基因特异性引物:5’-GGGCTGTAAACATCCTACAC-3’,反向引物:5’-TGCGTGTCGTGGAGTC-3’;GAPDH上游引物:5’-GACCACAGTCCATGACATCACT-3’,下游引物:5’-TCCACCACCCTGTTGCTGTAG-3’;Notch1上游引物:5’-ATGGCCCCACCTGCAGACAAGATG-3’,下游引物:5’-GGCACGGCAGGCACAGCGATAG-3’;Dll4上游引物:5’-CAAGAATAGCGGCAGTGGTCGTAA-3’,下游引物:5’-GTA-GCGCAGTCTTGTGAGGGTGTT-3’。Q-PCR反应条件为:94 ℃ 5 s,循环1次;94 ℃ 5 s,57 ℃ 15 s,72 ℃ 10 s,循环45次。Q-PCR检测结束后,按照2-ΔΔCt计算rno-miR-30b-5p、Notch1和Dll4基因表达情况,并进行数据统计分析。
1.5ELISA检测大鼠脾脏、淋巴结及眼球中Notch1和Dll4蛋白的表达用液氮分别将两组大鼠的脾脏、淋巴结和眼组织研磨至细粉状,加入350 μL RIPA裂解液溶解后电动匀浆30 s,将样品置于冰上,然后超声波细胞粉碎机冰超声20 min,8000 r·min-14 ℃离心20 min。离心后样品去沉淀,将上清转移至新的EP管,采用微量紫外分光光度计测定各组蛋白浓度,ELISA试剂盒检测Notch1和Dll4蛋白的表达情况。
1.6流式细胞仪检测大鼠脾脏和淋巴结中Th17/Treg细胞比例变化分别取两组剩余大鼠的脾脏和淋巴结,研磨后通过200目细胞筛进行细胞初滤,细胞滤液通过尼龙毛柱过滤,然后用大鼠淋巴细胞分离液分离各个组织得到T淋巴细胞(每组计数约106个细胞)。-80 ℃冰箱取出cocktail细胞刺激液,37 ℃水浴解冻。于T淋巴细胞中加入6 μL的cocktail刺激液和4 μL的Golgistop蛋白转运抑制剂,移液器轻轻吹打混匀。用锡箔纸将EP管严密包裹避光,放入37 ℃、体积分数为5%的CO2培养箱中孵育5 h;孵育后首先进行细胞表面染色,然后用破膜溶液对细胞固定破膜后再进行细胞内染色。染色结束后滤网过滤,流式细胞仪检测大鼠脾脏和淋巴结中Th17、Treg细胞水平并分析结果,分析Th17/Treg细胞比例。

2结果
2.1rno-miR-30b-5p调控 Notch1和Dll4基因双荧光素酶检测结果显示,与对照组相比,rno-miR-30b-5p对Notch1和Dll4基因野生型的RLU值有较显著的下调表达,然而对其预测靶位点进行突变后,突变型载体中的RLU值表达水平未见明显改变(图1)。由此可见,rno-miR-30b-5p可明显调控带有Notch1和Dll4基因片段3′UTR基因的表达,Notch1和Dll4为rno-miR-30b-5p调控的靶基因。
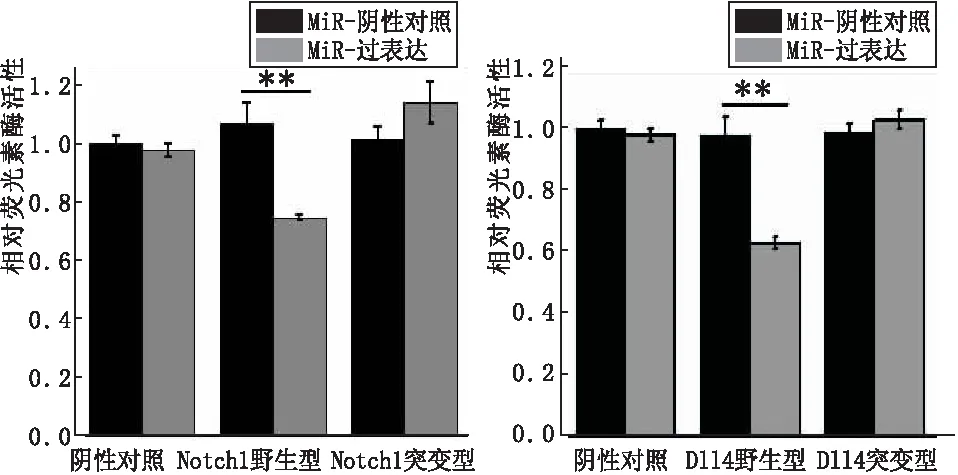
图1miRNA与质粒载体转染293T细胞后Notch1和Dll4的表达水平(**P<0.01)
2.2EAU大鼠脾脏、淋巴结和眼组织中rno-miR-30b-5p基因的表达Q-PCR检测结果显示,与对照组大鼠(1.00)相比,免疫后12 d,rno-miR-30b-5p基因在EAU模型组大鼠脾脏、淋巴结和眼组织中的表达水平分别为0.41±0.12、0.37±0.09和0.25±0.07,均呈显著下调表达(均为P<0.01)。由此可知,rno-miR-30b-5p的表达水平与葡萄膜炎的发生发展密切相关。
2.3Notch1和Dll4基因和蛋白的表达水平Q-PCR检测结果显示,与对照组大鼠相比,免疫后12 d的EAU模型组大鼠脾脏、淋巴结和眼组织中的Notch1和Dll4基因水平呈显著上调表达,且差异均具有统计学意义(均为P<0.05);ELISA检测结果显示,相比于对照组大鼠,免疫后12 d的EAU模型组大鼠的脾脏、淋巴结和眼组织中Notch1和Dll4蛋白水平呈明显的上调表达,且差异均具有统计学意义(均为P<0.01)(图2)。由此可知,rno-miR-30b-5p可负调控Notch1和Dll4的表达水平,从而在葡萄膜炎的发病进程中起调控作用。
2.4大鼠脾脏和淋巴结中Th17/Treg细胞比例变化流式细胞仪分别检测两组大鼠脾脏和淋巴结中Th17、Treg细胞因子的表达水平,结果显示,与对照组大鼠相比,免疫后12 d的EAU模型组大鼠中Th17细胞因子的表达水平明显升高(图3),而Treg细胞因子的表达水平明显降低(图4)。

图2Notch1、Dll4基因和蛋白在两组大鼠脾脏、淋巴结和眼组织的表达水平(*P<0.05,**P<0.01)。A:Notch1基因表达水平;B:Dll4基因表达水平;C:Notch1蛋白表达水平;D:Dll4蛋白表达水平

图3流式细胞仪检测两组大鼠脾脏和淋巴结中Th17细胞因子的表达水平。A:对照组脾脏;B:EAU模型组脾脏;C:对照组淋巴结;D:EAU模型组淋巴结
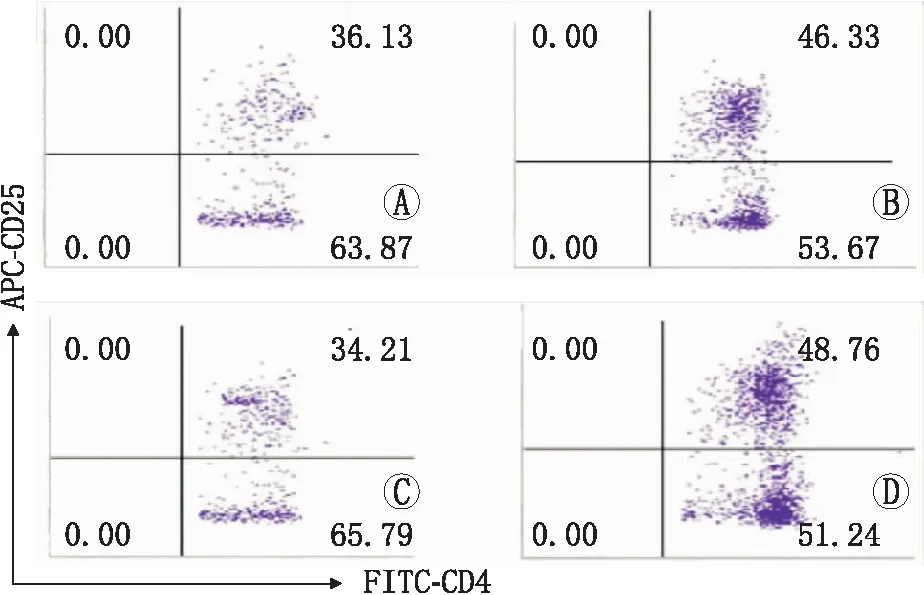
图4流式细胞仪检测两组大鼠脾脏和淋巴结中Treg细胞因子的表达水平。A:对照组脾脏;B:EAU模型组脾脏;C:对照组淋巴结;D:EAU模型组淋巴结
3讨论
葡萄膜炎是一类复杂的眼科疾病,多发于青壮年,主要表现为慢性或反复发作的眼部炎症,严重危害人类健康。Notch信号通路对调节炎症反应和自身免疫性疾病具有重要意义,可通过调控naïve CD4+T细胞向Th17、Treg细胞分化,在维持Th17/Treg细胞平衡中发挥重要作用,进而影响机体的生理功能[6]。Yu等[7]研究发现,免疫性血小板减少症患者用DAPT阻断Notch信号通路后,其外周血中Th17/Treg的比例显著降低。注射抗-Dll4抗体亦可显著降低Th17细胞的分化水平[8],提示Notch信号通路在调节Th17细胞分化、维持Th17/Treg平衡中发挥重要作用。刘滨等[9]证实,Notch信号分子可通过调控Th17和Treg细胞分化、影响Th17/Treg比例平衡,进而影响葡萄膜炎的发生发展。B10.RIII葡萄膜炎小鼠Notch信号通路中Notch1、Notch4、Dll4及NICD等均表达上调。腹腔注射Notch信号通路阻断剂DAPT可明显减轻葡萄膜炎的病情发展[10]。不同时间给予C57BL/6葡萄膜炎小鼠Notch信号通路阻断剂,均可抑制葡萄膜炎的发展[11]。临床研究证实,活动性白塞病患者Notch信号分子高度激活,并伴随Th17高水平应答,阻断 Notch 信号通路可选择性抑制Th17应答[12]。
miRNA是一类在基因转录后水平调控靶基因表达的功能性小RNA分子,可通过RNAi方式调控靶基因的表达。miRNA在多种自身免疫性疾病中表达异常,提示miRNA对自身免疫性疾病的发生发展有重要影响。Cruz等[13]证实,miR-27在小鼠T细胞中的过表达可抑制Treg细胞的分化,导致Treg功能紊乱,进而造成小鼠免疫耐受功能障碍;Mandolesi等[14]研究发现,在IL-1β介导的突触功能障碍中miR-142-3p表达上调起主要作用,可导致多发性硬化症和自身免疫性脑脊髓炎的兴奋毒性损伤;Tang等[15]发现,miR-301a-3p和Th17细胞在类风湿性关节炎的发生发展中发挥重要作用。
miRNA表达异常在葡萄膜炎发病过程中发挥重要作用。动物实验表明,与NF-κB信号通路相关的miR-146a-5p、miR-155-5p、miR-223-3p和miR-147b在葡萄膜炎大鼠虹膜、睫状体中呈高水平表达,而miR-182-5p、miR-183-5p和miR-9-3p呈低水平表达[16]。研究发现,在急性前葡萄膜炎患者外周血中,miR-143、miR-146a、miR-9-3和miR-205表达水平明显降低,而miR-301a和miR-23a表达水平明显升高[17];miR-155可通过靶向作用于Ets-1基因调控Th17细胞的免疫应答,抑制miR-155可减少致病性Th17细胞的数量,从而减轻葡萄膜炎患者的病情[18]。我们前期研究结果显示,EAU大鼠外周血淋巴细胞中有36条miRNA表达上调,有31条miRNA表达下调,推测这些miRNA的差异性表达可能与葡萄膜炎的病理机制关系密切[19];进一步研究表明,rno-miR-30b-5p可调控Atg5、Atg12和Becn1自噬基因的表达水平,rno-miR-30b-5p在EAU大鼠脾脏和淋巴结中呈下调表达,而Atg5、Atg12和Becn1基因呈明显的上调表达[20],表明rno-miR-30b-5p可通过影响自噬通路在葡萄膜炎病理机制中发挥作用。
Su等[21]发现,miR-30b可通过负调节Notch信号通路中Notch1基因的表达显著上调树突状细胞中IL-10和NO的水平,从而在免疫应答中发挥负调控子的作用。此外,miR-30b 还可下调Notch信号通路中Dll4配体的表达水平,在血管发育和血管生成过程中起明显的调控作用[22]。有研究发现,在EAU大鼠脾脏和淋巴结中miR-30b-5p表达下降[23],而Notch1、Notch2和Notch4表达明显升高,Th17/Treg比例失衡[9],生物信息学预测分析和本实验研究均表明,Notch信号通路上Notch1和Dll4基因均为miR-30b调控的靶基因。EAU大鼠的miR-30b-5p在脾脏、淋巴结和眼组织中的低水平表达与葡萄膜炎的发生发展密切相关。miR-30b-5p可通过调控Notch信号通路上Notch1和Dll4基因的表达水平,影响Th17、Treg细胞的分化,进而影响Th17/Treg的平衡,从而影响葡萄膜炎的发生发展。
总之,深入研究miR-30b-5p调控Notch信号通路相关分子表达的作用机制,对于阐明葡萄膜炎发生发展的病理机制、建立基于以miRNA为作用靶点的新型治疗方法、突破常规免疫性疾病治疗思路具有重要意义。
