四株细菌纤维素生产菌株16Sr DNA序列分析及生产性能比较研究
2019-01-10邹小周曹张军
邹小周, 曹张军, 陈 琳, 洪 枫*
(东华大学 化学化工与生物工程学院,上海201620)
细菌纤维素(bacterial nanocellulose,BNC)是由微生物合成的高纯纤维素,其化学结构为β-1,4-糖苷键连接吡喃葡萄糖单体形成的直链多糖[1]。不同于植物纤维素,细菌纤维素具有更高的纯度,不含半纤维素和木质素[1];纤维直径远小于植物纤维素,由此产生的大比表面积使其具有极佳的持水能力[2]。此外,细菌纤维素具有高聚合度、高结晶度和较好的机械性能[3-4],在食品[5]、造纸[6]、纺织[7]等诸多领域有着广泛的应用[1,3]。作为一种无毒、高持水率的天然水凝胶材料,细菌纤维素还可用于伤口敷料[4,8]和药物缓释物[9]等领域。细菌纤维素的结构与细胞外基质,如胶原,有一定的相似性,因此具有很好的生物相容性[10]。近年来,细菌纤维素在小口径人工血管[11-12]、骨组织工程支架等新兴研究领域受到了研究者们的青睐。综上所述,作为一种高附加值产品,细菌纤维素具有广泛的应用前景和可观的商业价值[13]。
细菌纤维素的生产菌株主要分布在醋杆菌属(Acetobacter)、固氮菌属(Azotobacter)、土壤杆菌属(Agrobacterium)、叠球菌属(Sarcina)等多个菌属当中[1]。其中研究最为广泛、产量最高的菌属是木葡糖醋杆菌属(Komagataeibacter xylinus)[1](原名Gluconacetobacter xylinus,Acetobacter xylinus)。生产菌株不同,不仅纤维素产量不同,所产纤维素的性质也存在一定的差异。
本研究对实验室筛选保藏的DHU-HL-Z1、DHU-HL-Z2和DHU-HL-Z3三株BNC生产菌与已广泛报道的K. xylinus ATCC 23770菌株进行比较,通过研究发酵过程中糖耗速率、活细胞增长及BNC产量方面的差异,并对 BNC产物进行红外光谱、结晶度和力学性能等方面的测试分析,比较菌种基本生产性能的差异。通过16SrDNA测序确定三个菌株所属的种属,并与已报道的多株BNC生产菌株进行比对,建立系统进化树分析其亲缘关系的远近,探索菌种亲缘关系与菌种生产特性之间的关系。这些实验的结果将为菌株的合理利用以及进一步的研究奠定基础。
1 实验
1.1 菌种和药品
菌种K. xylinus ATCC 23770购自美国标准菌种库(American Type Culture Collection)。DHU-HL-Z1、DHU-HL-Z2、DHU-HL-Z3为实验室筛选保藏菌种。培养基主要成分为葡萄糖(分析纯)、蛋白胨(国药集团化学试剂有限公司)、酵母粉(英国 Oxoid)。
1.2 16SrDNA 测序和系统进化树的建立
在冰上建立PCR体系,10×扩增缓冲溶液5.0 μL,dNTP引物1 μL,上下游引物(10~20 pmol)各2 μL,TaqDNA聚合酶(10 U/μL)1 μL,加超纯水至50 μL。模板为长在平板固体培养基中的菌种单菌落,用接种针挑取少量充分溶解在PCR体系中。上述体系中的上游引物为BSF8/20,序列为5ʼ-AGA GTT TGA TCC TGG CTA AG-3ʼ;下游引物为 BSR1542/20, 序列为 5ʼ-AAG GAG GTG ATC CAG CCG CA-3ʼ。
将反应体系放在PCR仪中,按照如下程序操作:94℃预变性4 min;94℃,30 s(变性),53℃,30 s(引物退火),72℃,90 s(引物延伸),循环32次;72℃延伸7 min。将PCR产物进行琼脂糖凝胶电泳,确认有1 600 bp左右的条带之后,将PCR产物送到上海生物工程公司进行测序。测序结果用SerialCloner 软件进行处理,序列在BLAST网站上进行比对,并选择与菌株较为相近且已发表模型菌株进行比对。将这些菌株的16SrDNA序列数据用Geneious软件进行处理,构建系统进化树。
1.3 菌种培养
液体培养基(w/V)中含有 2.5%葡萄糖、0.5%胰蛋白胨、0.3%酵母粉,pH用硫酸调至5.0,115℃条件下灭菌30分钟;固体培养基比液体培养基多加入0.2%的琼脂。将菌种接入液体培养基,以180 r/min和30℃的条件进行活化。活化后的菌种在固体平板培养基上划线,30℃下培养直至长出单菌落。
为比较不同菌种的细菌纤维素产量,规定发酵起始的活细胞浓度和葡萄糖浓度应基本相同。在100 mL液体培养基中以单菌落接种,在180 r/min、30℃的条件下对菌种进行预培养,监测菌种的活细胞数目,当活细胞数目达到规定值时,测定预培养液的葡萄糖浓度,用少量100 g/L的无菌葡萄糖液补糖至25 g/L。在无菌操作条件下,将30 mL补糖预培养液加入100 mL无菌锥形瓶中,每个菌种设置三个平行。在30℃的条件下静态培养,分别在发酵第1、2、4、6、8和10天取样,测活细胞数目、pH和残糖浓度。
1.4 活细胞数目测定
用0.22 μL滤膜截留培养基中的游离细胞,将滤膜在0.85%NaCl溶液中进行重悬。用BacLight live/dead荧光染色试剂盒(Invitrogen, 美国)对菌悬液进行染色。通过测定菌悬液的荧光值,利用预先建立的荧光值―细胞浓度标准曲线计算活菌数目。
1.5 葡萄糖测定
用Accu-Chek Aviva血糖测试仪(Roche Diagnotics GmbH, 德国)测定液体样品中的葡萄糖含量。预先建立标线,样品用pH为7.4的血糖仪缓冲溶液(含有8.65 mg/L NaCl,176.4 mg/L CaCl2·2H2O,182.9 mg/L MgCl2·6H2O和201.3 mg/L KCl)进行稀释,用血糖仪直接读数,利用标线计算葡萄糖浓度。
1.6 细菌纤维素产量测定
发酵结束后将得到的纤维素膜用去离子水清洗后,放在预先恒重的坩埚中,在 80℃条件下预先烘干4 h,然后在105℃条件下烘干至恒重。细菌纤维素的质量为坩埚带样品的恒重减去坩埚恒重。细菌纤维素产量(g/L)以及单位糖耗的细菌纤维素转化率(g/g)的计算公式如式(1)、(2)所示。

1.7 拉力测试
在80℃水浴中先将细菌纤维素膜用1%NaOH溶液和去离子水循环清洗,直至洗水为中性。将细菌纤维素膜用手术剪刀剪成4 cm×1 cm的小条,每个样品设置四个平行。用游标卡尺测量四个细菌纤维素小条的厚度,每个小条测量三个位置的厚度取平均值。将准备好的样品用万能材料测试机(H5K-S, Hounsfield分析仪器有限公司,英国)进行拉力测试。测试环境为25℃恒温,相对湿度大约50%。
1.8 红外谱图
将上述清洗过的膜用液氮预冻后在冻干机中冻干48 h。得到的冻干膜样品压成片用傅里叶红外光谱仪PerkinElmer Spectrum Two(PerkinElmer,美国)进行红外扫描,扫描范围是 4 000~400 cm-1,步长为 4 cm-1。
1.9 X-射线广角衍射测试
将冻干的细菌纤维素膜样品用D/max-2550 PC X-射线衍射仪(Rigaku公司,日本)进行X-射线广角衍射测试(XRD),2θ角的范围为3º~60º,扫描速度为10º/min。得到的结果经过Jade软件分析,根据图谱和峰面积计算结晶度。
1.10 场发射扫描电镜观察
纤维素膜样品经过纯化冻干,取横断面制样。在S-4800场发射扫描电镜下拍摄照片。分辨率1 nm,加速电压15 kV。用Image J 软件统计纤维直径,Origin软件做纤维直径正态分布统计图。
2 结果与讨论
2.1 16SrDNA 序列及系统进化树分析
图1为16SrDNA序列分析(a)琼脂糖凝胶电泳(b)BNC生产菌株系统进化树分析。

图1 16SrDNA序列分析(a)琼脂糖凝胶电泳,(b)BNC生产菌株系统进化树分析
图1a为16SrDNA PCR产物琼脂糖凝胶电泳结果,在1 600 bp左右可见清晰的电泳条带,将四个菌种两个平行样品中条带较亮的一个样品送往上海生工公司进行基因测序。具体的基因序列由于版面限制此处不具体列出。如图 1b,本实验室筛选保藏的 DHU-HL-Z3、DHU-HL-Z1、DHU-HL-Z2三个菌株均属于Komagataeibacter。经过信息收集,将已报道的BNC生产菌株与该三株菌进行16SrDNA序列比对,建立系统进化树。16SrDNA为保守序列,经过信息处理,生产BNC菌种16SrDNA序列相似度都很高,此处只选取若干典型菌株进行情况说明。K. xylinus ATCC 23770菌株利用廉价碳源[14-15]降低细菌纤维素生产成本以及人工血管[16]等高附加值产物的开发等方面都有应用研究。DHU-HL-Z1、DHU-HL-Z2与K. xylinus E25以及K. xylinus BPR 2001亲缘性更为接近。Kubiak等对K. xylinus E25菌株进行了全基因组测序[17],发现了该菌株与抗性相关的质粒和基因,为后续菌株的耐受性研究[18-19]提供了理论基础。K. xylinus BPR 2001适合于动态发酵,耐受剪切力,是液体深层搅拌发酵性能优良的菌种[20]。亲缘性较近的菌株在生长代谢和产物性质上可能存在相似性,这一推论还需要更多菌种的相关实验来验证。
2.2 菌种生产性能比较
四个菌株在发酵过程中的葡萄糖浓度变化如图1a所示,经过9天的发酵周期,发酵初始培养基中的约25 g/L葡萄糖被全部利用。DHU-HL-Z3耗糖比其他三个菌株更快。在发酵第一天,DHU-HL-Z3已经有明显的糖耗,而其他三个菌种明显处于延迟期,没有明显的糖耗。发酵第5天,DHU-HL-Z3已经消耗完所有的葡萄糖,发酵第7天,K. xylinus ATCC23770 消耗完所有葡萄糖。DHU-HL-Z1和DHU-HL-Z2两个菌株的糖耗较慢,到第9天消耗所有葡萄糖。虽然培养基的起始pH值都调为5.0,但是为达到特定的细胞浓度,四个菌种经过不同时间的预培养后,三个菌种的pH下降到3.5,只有ATCC 23770初始pH是4.0。在发酵过程当中,培养基的pH值都有所下降,主要原因推测为产细菌纤维素菌株在耗糖同时会产生有机酸[1,21]。K. xylinus菌种在发酵过程中会产生大量的葡糖酸[22],这种副产物导致培养基的pH下降。

图2 发酵过程参数(a)葡萄糖浓度(b)pH(c)活细胞变化(d)细菌纤维素产量
在细菌纤维素的静态发酵体系中,细菌纤维素膜会在培养基和空气的交界面逐渐形成。体系中的活细胞大部分被包裹在生成的细菌纤维素素膜中,这部分活细胞不易测算和计数。用荧光染色的方法测定培养基中的游离活细胞数目,其结果如图 2a所示。在发酵的第一天内,四个菌株中的活细胞数目都没有明显的变化。在随后的八天时间中,四个菌种的游离细胞显现出明显的变化差异。四个菌种中K. xylinus ATCC 23770的游离活细胞数目较多,增殖较快,在发酵第5天活细胞数目达到20.8×106cell/mL,之后游离活细胞的增长进入稳定期。DHU-HL-Z3的游离活细胞数目相对于K. xylinus. ATCC23770较少,发酵第7天活细胞数目达到16.8×106cell/mL,之后游离活细胞数目少量降低。DHU-HL-Z1和DHU-HL-Z2两个菌种游离细胞数在发酵过程中没有明显变化,但是可以观察到细菌纤维素膜的生成。
如图2c所示,DHU-HL-Z1以及DHU-HL-Z2在发酵清液中的活细胞没有明显的增长,但与此同时BNC膜在逐渐增厚,说明这两个菌株的活细胞主要分布在细菌纤维素膜中。菌株DHU-HL-Z3与K. xylinus ATCC 23770相似,在静态发酵的上清液中可以观测到明显的活细胞增长,并可观测到增长期和稳定期,与前述两个菌株有明显的区别。活细胞分布的研究结果对于 BNC生产菌株的应用和生产实践具有一定的指导意义。譬如DHU-HL-Z1和DHU-HL-Z2两个菌种在保种的过程中,应注意其游离细胞较少,不能采用常规的微生物保种方式,而应采用含有大量活细胞的细菌纤维素膜来进行保种,避免用游离细胞保种导致菌种退化和死亡。如图2d所示,经过9天的发酵培养周期,DHU-HL-Z1和DHU-HL-Z2的细菌纤维素产量(粗干重)分别为12.8 g/L和12.9 g/L,两者的产量之间没有明显差异(p>0.05)。这两个菌种的产量明显高于(p<0.05)K. xylinus ATCC 23770的8.7 g/L。DHU-HL-Z3的细菌纤维素产量为14.8 g/L,明显高于其他三个菌种(p<0.05)。计算表明,DHU-HL-Z3菌种单位糖耗的细菌纤维素转化率最高,为 0.59±0.02 g/g,随之是DHU-HL-Z1 和 DHU-HL-Z2(分别为 0.52±0.01 和 0.49±0.01 g/g),最低的是 ATCC 23770(0.34±0.03 g/g)。
2.3 细菌纤维素性能表征
如图 3a所示,四个菌种产生的细菌纤维素样品在红外图谱中都显示出纤维素的红外特征峰,如1059 cm-1处的C-O伸缩振动,1165 cm-1处的C-O-C 不对称伸缩振动,2900 cm-1左右的甲基,亚甲基和次甲基C-H伸缩振动峰和3300 cm-1左右由纤维素中羟基O-H振动引起的宽吸收峰[23-25]。
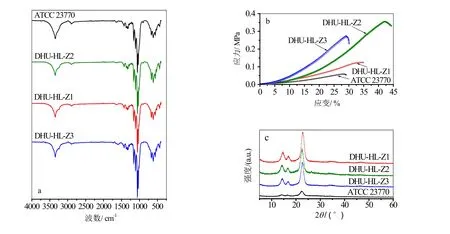
图3 细菌纤维素性能表征(a)红外谱图(b)水凝胶膜的应力-应变曲线(c)XRD测试
图3b为四个菌种产生的细菌纤维素水凝胶膜的应力-应变曲线,其中DHU-HL-Z2 和DHU-HL-Z3的机械性能较优,杨氏模量分别130和96 KPa。ATCC 23770和DHU-HL-Z1的机械性能比Z2和Z3的弱,杨氏模量分别为23和39 KPa。图3c为四种BNC的广角X-射线衍射曲线,在2θ角分别为14.2º、16.7º和22.4º的位置分别有代表(1ī0)、(110)和(200)晶面的衍射峰[23]。其中,DHU-HL-Z1和DHU-HL-Z2的结晶度较高,分别为87.64%和86.65%,这两个菌种在系统进化树上的亲缘性较近。另外亲缘性较近的两个菌种DHU-HL-Z3和K. xylinus ATCC 23770的结晶度较低,分别为64.51%和62.34%。
图4为四种BNC的场发射扫描电镜照片及纤维直径统计情况。从放大5 000倍的电镜图可知,BNC都呈现三维的纤维网络结构。放大20 000倍照片上可以观察到单根的纤维以及纤维分支。随机统计不同照片上的200根纤维,对纤维直径做统计分析可知,纤维分布基本符合正态分布,偶尔出现的大于90~100 nm的纤维一般为两根或多根成股纤维,在这些纤维的末端可以看到纤维分支。DHU-HL-Z2和 DHU-HL-Z3的纤维平均直径分别为44 nm和37 nm,比DHU-HL-Z1和ATCC 23770的(48 nm和46 nm)略小。相反地,这两个菌种的杨氏模量更大,纤维微观结构和宏观力学性能之间的关系有待进一步研究。


图4 场发射扫描电镜照片及纤维直径分析
3 结论
实验室保藏的DHU-HL-Z1、DHU-HL-Z2和DHU-HL-Z3三个菌株比对照菌K. xylinus ATCC 23770具有更高的BNC产量和转化率,在BNC的研究和工业生产中具有较大的潜力。经16SrDNA测序和建立多菌株系统进化树研究,可知 DHU-HL-Z1、DHU-HL-Z2和 DHU-HL-Z3菌种均属于木葡糖酸醋杆菌Komagataeibacter。四个菌株的BNC产物红外图谱都显示了纤维素特征峰。静态发酵时,亲缘性较近的菌株Z1和Z2在培养液中的活细胞数目比另两个亲缘性较近的菌株Z3和ATCC 23770的少,表明Z1和Z2的菌株保藏应采用BNC膜而不是清液。在所产BNC性能方面,Z1和Z2两个菌种的BNC产物具有更高的结晶度。Z2和Z3所产生的BNC的力学性能优越,同时具有更小的纤维直径。以上结果为这些产纤维素菌株的进一步研究和应用奠定了很好的工作基础。
