秸秆纤维素降解菌的筛选及其产酶特性研究
2019-01-10关春峰王昱蓉
张 悦 , 季 静 *, 关春峰 , 金 超 ,李 倩 , 闫 豹 , 王 罡 , 王昱蓉
(1. 天津大学 环境科学与工程学院,天津 300072;2. 天津市天大天福生物技术有限公司,天津 300384;3. Division of Biological Sciences, University of California San Diego, San Diego, California, USA. )
秸秆还田是一项多效的农业措施,既可以增强土地肥力又可带来增产的效果,众所周知我国是农业第一大国,而且每年生物质能源中秸秆资源占50%,但因为降解技术不发达、工业化难度较大、资源利用成本高,使秸秆综合利用率呈现下降趋势,所以还田玉米秸秆的腐解成为目前研究的热点[1]。经中国东北及内蒙古地区玉米秸秆还田的研究结果表明,因为冬季气温较低且持续时间长导致秸秆入土后腐解速度较为缓慢,这不仅会使播种质量受到影响,还会导致一些病虫的滋生,给农田生产带来诸多潜在危害[2]。因此,不仅要实现玉米秸秆腐化,更要重视秸秆腐解效率的提高。通过微生物菌剂来降解秸秆,不仅能够让秸秆高效还田还是该问题的有效解决方法之一[3]。
大部分研究致力于利用单一微生物进行秸秆降解,而单一菌株其降解能力有限,所以降解效果并不理想,构建复合菌系就变得越来越重要[4]。有研究表明,复合霉菌降解和单一菌株对秸秆的降解相比,秸秆的失重率可提高21.3%~59.6%[5]。其中构建复合菌系可以通过单菌株组合法或直接混合法。多数研究采用后者,通过多代连续培养来构建[6],而利用不同单菌株的组合来构建复合菌系的相关研究还较少。但直接混合筛选法存在很多问题,例如菌系中菌株组成种类多会导致对其鉴定困难[7]。但直接组合单菌株的方法其稳定性与高质量可控,且每种菌株的特性较为清晰明确[8]。
综上所述,本研究欲从田间腐化的秸秆中筛选并分离单株纤维素降解高效菌株,后通过合理的组合构建并优化高效复合菌系。
1 实验
1.1 材料
1.1.1供试样品
供试秸秆样品为田间腐化玉米秸秆,取样选取腐化程度较大的玉米秸秆,样品取得后冷藏备用。
1.1.2培养基
羧甲基纤维素钠(CMC-Na)固体培养基:NH4NO31 g;蛋白胨1 g;琼脂 20 g;蒸馏水1 000 mL;CMC-Na 15 g;KH2PO41 g;Mg2SO4·7H2O 0.5 g;pH 7.0,121℃灭菌 20 min。
羧甲基纤维素钠(CMC-Na)液体培养基:NH4NO31 g;蛋白胨1 g;蒸馏水1 000 mL;CMC-Na 15 g;KH2PO41 g;Mg2SO4·7H2O 0.5 g;pH 7.0,121℃灭菌 20 min。
天然秸秆液体发酵培养液:NH4NO31 g;蛋白胨 1 g;蒸馏水1 000 mL;KH2PO41 g;Mg2SO4·7H2O 0.5 g;pH 6.5,121℃灭菌 20 min。
1.1.3实验主要试剂
1)浓度为0.05 mol/L的柠檬酸缓冲液(pH 5.0)
A液为0.1 mol/L浓度的柠檬酸钠溶液:准确地称量柠檬酸钠样品29 g,将其充分的溶解于无菌的蒸馏水,后移入容量瓶内,定容至1 000 mL备用。
B液为0.1 mol/L浓度的柠檬酸溶液:精确地称取21 g柠檬酸样品,将其完全溶解于无菌的蒸馏水内,再移入容量瓶,定容至1 000 mL备用。
上述步骤准备完毕后,准确地称量295 mL A液(柠檬酸缓冲液),再准确地称量205 mL B液(柠檬酸溶液),最终定容于1 000 mL容量瓶。
2)浓度为0.51%的CMC-Na标准溶液
精确地称取0.51 g CMC-Na样品,并将样品置于少量的柠檬酸缓冲溶液中,搅拌混合后于50~70℃的水浴锅内加热至其完全溶解,待其冷却后再用柠檬酸缓冲溶液定容至100 mL容量瓶内。
3)DNS试剂
准确地称0.5 g 3,5-二硝基水杨酸样品,再配制20 mL浓度为 2 mol/L的NaOH溶液,并准备50 mL的无菌蒸馏水,将称取好的3,5-二硝基水杨酸样品加至NaOH溶液和蒸馏水中,充分的搅拌使其完全的溶解后,再称取30 g酒石酸钠样品,溶解于内,待其完全冷却后,先定容至100 mL容量瓶中,再置于棕色试剂瓶中避光冷藏保存。
4)浓度为1 mg/mL的葡萄糖标准溶液
取少许的葡萄糖样品加热烘干至其恒重,再精确地称取0.1 g已烘干的葡萄糖样品,用无菌蒸馏水并定容至100 mL容量瓶中,冷藏备用。
1.2 实验方法
1.2.1样品富集
将采集的腐化秸秆适当粉碎后溶于无菌水30℃条件下振荡7 d,制备成含有秸秆腐化菌的富集液。
1.2.2纤维素降解菌的初筛
称取1 mL富集液与99 mL无菌水混合,30℃条件下,120 r/min振荡培养30 min,静置30 min取上清液进行梯度稀释。后选取浓度为10-3~10-7的稀释液接种于CMC-Na固体培养基上进行培养筛选,待菌落长出后,分别挑取不同单菌落进一步纯化。
将不同组合培养获得的单菌落培养基用刚果红进行染色,此步骤用于对不同菌种对纤维素降解的能力进行初步筛选。首先利用1 mg/mL刚果红染色液染色待测培养基30 min,再用1 mol/L NaCl溶液脱色30 min,观测透明圈产生效果,以其清晰度与菌落直径比作为依据初判其降解能力。
1.2.3菌株的鉴定
1.2.3.1形态鉴定
观察菌落形态,并扩增菌液进行革兰氏染色后镜检。
1.2.3.2分子生物学鉴定
进行16S rDNA序列鉴定。以菌株的总DNA为模板,上下游引物分别为27F:5ʼ-AGAGTTTGATCC TGGCTCAG-3ʼ和1492R:5ʼCGGCTACCTTGTTACGAC3ʼ,扩增菌株的16S rDNA并进行PCR反应,其体系为:27F和1492R(10 μmol/L)引物各1 µL,DNA 模板2 µL,Mix 25 µL,dd H2O加至50 µL。反应条件为:3 min 97℃变性,1 min 97℃变性,1 min 56℃退火,1 min 72℃延伸,30个循环;5 min 72℃延伸。后将PCR产物送于金唯智生物技术公司进行序列比对测定。
1.2.3.3构建系统发育树
将所测菌株的16S rDNA测序结果首先在Gen Bank中比对BLAST相似性,后以FASTA的格式下载与其相似度高的基因序列,运用软件MEGA 7.0,通过邻接法(neighbor-joning, N-J)进行系统发育树的构建[9]。
1.2.4菌间兼容性研究
将菌株两两接种于CMC-Na固体培养基上进行30℃共培养,3~5 d后,观察是否有存在拮抗现象。
1.2.5纤维素降解菌系的构建
将初步筛选得到的菌种进一步接种于液体培养基中,在温度为30℃、120 r/min的条件下恒温振荡培养,后进行CMC和FPA酶活力测定,作为进一步复筛的依据。
粗酶液:后续所用粗酶液获得于待测液在6 000 r/min条件下离心10 min后的上清液。
酶活力的定义:1个酶活力单位(U/mL)为1 mL酶液在1 min内水解底物产成1 μmol的还原糖含量。
酶活力的计算方法按照公式(1)进行。

式中,X为待测定的酶活力大小,S为还原糖含量,V为粗酶液体积,V1为稀释后粗酶液的定容体积,V2为待测酶液的体积。
1.2.5.1还原糖法测定纤维素酶活力
1)CMC酶活力大小检测
分别准备4支洗净、干燥的25 mL相同试管,将其中的1支试管作为空白组对照,剩余的3支试管作为待测组备用,取之前配制好的CMC-Na标准溶液,分别向所有的试管中加入1.5 mL,将所有试管放入50℃水浴锅内进行5 min的预热,与此同时预热少许粗酶液,预热结束后只向待测组的试管中加入0.5 mL的粗酶液并充分振荡混匀,再将所有试管置于50℃的水浴锅中加热反应30 min,待其反应结束后,再向空白组的试管中加入0.5 mL粗酶液,以上所有步骤完成后分别向所有试管中加入3 mL的DNS试剂,再置于沸水水浴锅中反应5 min,反应结束后迅速将其冷却,并用无菌蒸馏水定容至25 mL刻度处。所有反应结束后,调至540 nm波长下,利用空白组试管调零,检测待测组溶液的吸光度,并根据其标准曲线进一步测定还原糖的含量,计算CMC酶活力大小。
2)FPA酶活力测定
分别准备4支洗净、干燥的25 mL相同试管,将其中的1支试管作为空白组对照,剩余的3支试管作为待测组备用,取之前准备好的滤纸条,分别向所有的试管中加入0.5 g,将所有试管放入50℃水浴锅内进行5 min的预热,与此同时预热少许粗酶液,预热结束后只向待测组的试管中加入0.5 mL的粗酶液并充分振荡混匀,再将所有试管置于50℃的水浴锅中加热反应30 min,待其反应结束后,再向空白组的试管中加入0.5 mL粗酶液,以上所有步骤完成后分别向所有试管中加入3 mL的DNS试剂,再置于沸水水浴锅中反应5 min,反应结束后迅速将其冷却,并用无菌蒸馏水定容至25 mL刻度处。所有反应结束后,调至540 nm波长下,利用空白组试管调零,检测待测组溶液的吸光度,并根据其标准曲线进一步测定还原糖的含量,最终计算FPA酶活力大小。
1.2.5.2绘制葡萄糖标准曲线
分别准备6支洗净、干燥的25 mL相同试管,再量取不同含量的葡萄糖标准溶液,以及不同含量的无菌蒸馏水,将其混匀于不同试管中,再加入之前配制好的DNS试剂3 mL置于沸水水浴锅中反应5 min,反应结束后迅速将其冷却,并用无菌蒸馏水定容至25 mL刻度处。所有反应结束后,调至540 nm波长下,对每组的吸光度进行检测。葡萄糖标准曲线以葡萄糖的含量为横坐标,以吸光度大小为纵坐标。
1.2.6复合菌系的产酶条件研究
1.2.6.1菌系产酶受培养时间的影响
将复合菌系于30℃,120 r/min下,在CMC-Na液体培养基中进行振荡培养,每天测定一次CMC、FPA酶活,连续测定7 d,根据酶活力大小比对确定复合菌系的最佳产酶时间。
1.2.6.2菌系产酶受培养温度的影响
分别于 20~45℃之间每隔 5℃设置一个温度梯度,将复合菌系置于设置好的不同温度的培养基中,120 r/min条件下恒温振荡培养,并在上步已经确定的最佳产酶时间进行取样,进而对样品的CMC、FPA 酶活进行测定,根据不同培养温度所测酶活的变化趋势确定复合菌系的最适产酶温度。
1.2.6.3菌系产酶受pH的影响
分别于4.5~8.5之间,每隔0.5设置一个pH值梯度,并将复合菌系置于不同初始pH值的液体培养基中,在上步确定的最适产酶温度下,120 r/min恒温振荡培养,并在之前已经确定的最佳产酶时间进行取样,进而对样品的 CMC、FPA酶活进行测定,根据不同培养温度所测酶活的变化趋势确定复合菌系的最适产酶pH值。
1.2.6.4菌系产酶受培养基氮源的影响
分别更换将液体培养基的氮源更换(NH4)2SO4,蛋白胨,尿素和KNO3四种,并将复合菌系置于不同氮源的液体培养基中,在之前确定的最适产酶温度及最适pH值条件下,120 r/min恒温振荡培养,并在之前已经确定的最佳产酶时间进行取样,进而对样品的 CMC、FPA 酶活进行测定,根据不同培养温度所测酶活的变化趋势确定复合菌系的最适产酶氮源。
1.2.7秸秆降解效果测定
1.2.7.1秸秆降解实验
研磨烘干玉米秸秆。取20 g与200 mL天然秸秆液体发酵液混合,以相对于培养液2%的接种量将复合菌系接种于灭菌后混合发酵液中,最适培养温度下120 r/min振荡培养15 d,后进行秸秆降解效果测定。
1.2.7.2降解率测定
本实验采用失重率测定的方法,将连续振荡培养15 d后的培养体系进行高温灭菌,无菌水洗涤剩余干物质并烘干,记剩余物的质量为 M1(g),记发酵前物质的质量为 M0,利用公式(2)进行秸秆失重率 D的计算。

式中,D为待测定的失重率(%),M0为发酵前的秸秆质量(g),M1为发酵后剩余干物质的质量(g)。
2 结果与讨论
2.1 纤维素降解菌的初筛
刚果红染色后所有培养基均获得大小不同的透明圈,各组透明圈大小对比如图1所示,透明圈直径与菌落直径比值的结果比较如表1所示。

图1 透明圈大小对比图

表1 透明圈直径与菌落直径比值大小
由于纤维素可结合刚果红染液,故刚果红染色后复合物会呈现出红色。但如果培养基中纤维素类物质已经被分解,刚果红则因无可结合受体而在脱色中被洗涤掉,致其出现以菌落为中心的透明圈,叶姜瑜等认为可通过透明圈是否产生及其大小来判断产纤维素酶能力是否存在[9]。高榕等提出可利用透明圈直径和菌落直径比值来判断产纤维素能力大小,这种方法也适合于实践应用中。而后来大量的研究结果也证实了其所具备的可参考价值,并且应用于图 1不同菌系透明圈直径与菌落直径对比图的实际操作中[10]。根据表1中的测量结果对比可以初步判断不同菌系产纤维素酶活力的大小为:③>①>②。
2.2 纤维素高效降解菌的鉴定
2.2.1菌种形态学观察
所得菌株①的菌落生长较为迅速,菌落呈淡粉色且光滑扁平,单个、成对的杆状菌体,如图2所示。

图2 菌株①形态与镜检图
菌株②生长较为迅速,菌落呈淡白色且小而光滑。利用革兰氏染液染色后100×油镜镜检显示其菌液为阴性,且油镜下可观察到其形态为单个、成对或链状菌体,如图3所示。

图3 菌株②形态与镜检图
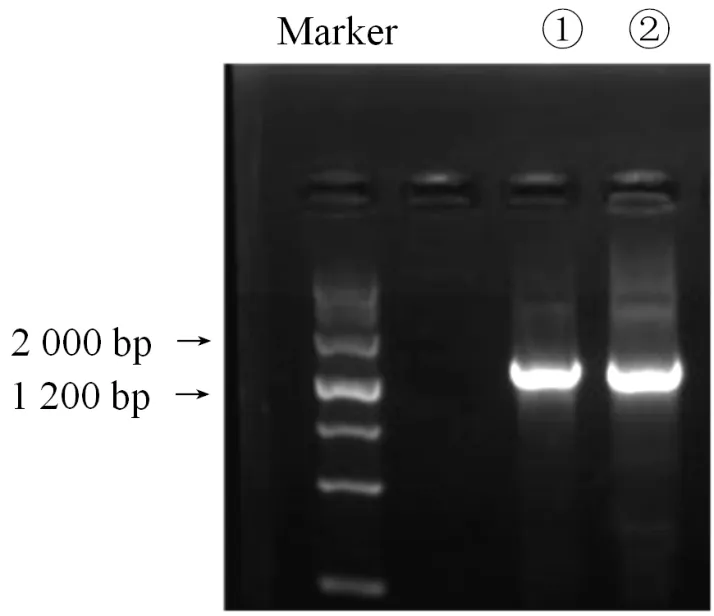
图4 PCR产物电泳图谱
2.2.2分子生物学鉴定
分别对菌株①、②进行16S rDNA的序列测定,测定后的PCR电泳图谱如图4所示。
根据图4显示,荧光条带约出现在1 200 bp和2 000 bp之间,证明该PCR扩增结果可以满足后续进一步测定。
2.2.3系统发育树结果分析
选取与菌株①相似度均高达99%的10株参考序列以邻接法构建系统发育进化树(见图 5),图中编号JWJX1XCB014即为菌株①,可看出其与Pelomonas.聚集在一起,且相似度达到99%,故鉴定菌株①属于:细菌界-变形杆菌门-β-变形菌纲-伯克氏菌目-丛毛单胞菌科-Pelomonas.属。
选取与菌株②相似度均高达99%的10株参考序列以邻接法构建系统发育进化树(见图6),图中编号JWN9KMF1014即为菌株②,可看出其与Curvibacter.相似度达到100%,故鉴定菌株②属于:细菌界-变形杆菌门-β-变形菌纲-伯克氏菌目-丛毛单胞菌科-Curvibacter.属。

图5 菌株①基因系统发育进化树

图6 菌株②基因系统发育进化树
2.3 菌种间的兼容性测定
将筛选出的菌株进行拮抗实验,观察后得出两菌株间无明显拮抗作用。
2.4 纤维素降解菌系的构建
2.4.1葡萄糖标准曲线的测定
葡萄糖的标准曲线,如图7所示。
2.4.2菌株酶活力力的测定
纤维素酶(CMC酶)对纤维素大分子水解生成纤维二糖和三糖的过程有很大影响,因此其可以作为纤维素酶能力强弱的一个重要判断依据[11]。
而纤维素酶在以滤纸条为底物进行降解时所体现出的酶活性被称为 FPA酶活力,由于滤纸中纤维素的结构较为松散,结晶度和聚合度较低,故降解利用较为容易,所以 FPA酶活力可判断纤维素酶系的总酶活,不同酶系之间的协同作用大小既是通过FPA酶活力体现的。
将初筛所取得的3种菌系分别接种到CMC-Na液体培养基中振荡培养,测定纤维素酶活,不同菌系的相关酶活性比较如表2所示。
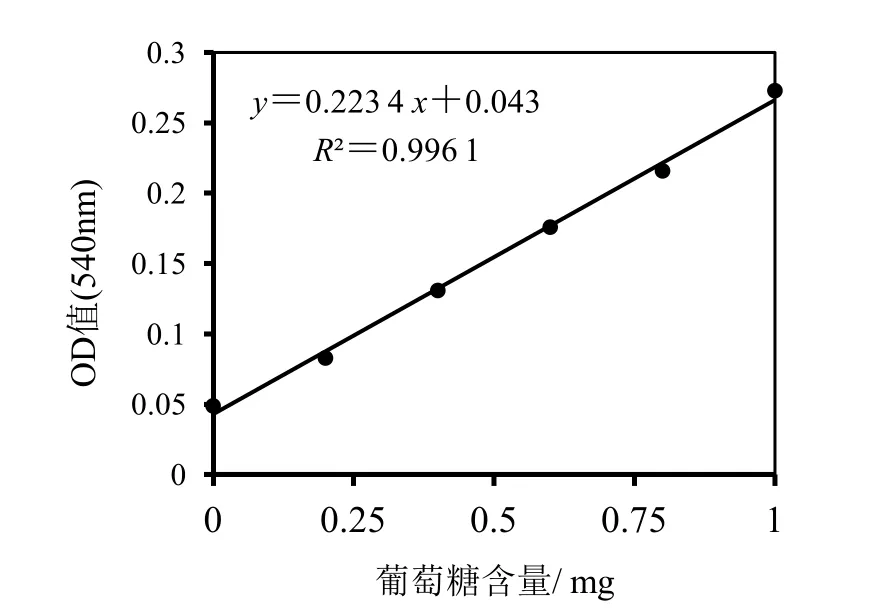
图7 葡萄糖的标准曲线
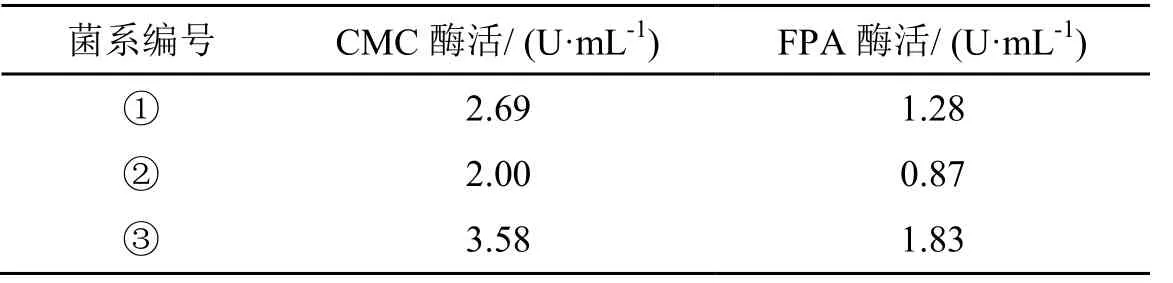
表2 不同菌株酶活力大小对比图
对3种菌系酶活力大小进行比较如图8所示。由两图可知同一种酶的活性在不同种菌株间有差别,即使是同一种菌株产各种酶的能力也不一样,所以不能靠单一的菌种来提供一个完整的纤维素降解酶系,要结合不同功能比较强的酶协同作用。综合表1中透明圈与菌落直径的比值对比及图8中不同菌系酶活的大小也可以确定③号菌系的综合能力较强,故对其培养条件进一步研究。

图8 不同菌系两种酶活对比图

图9 不同培养时间对菌系酶活的影响
2.5 纤维素高效降解菌系的培养条件优化
结合上述上述初筛与复筛结果,选取③号菌系(Comamonadaceae gx.+Comamonadaceae zj.)进行后续培养条件的优化探究。
2.5.1不同的培养时间对菌系产酶影响的测定
根据图9可得,不同的培养时间会对菌系的产酶活力产生很大影响。在整个培养过程中,菌系的产酶活性整体出现先增后减的变化趋势。在培养初期,菌系的酶活呈现较低状态,酶活力大小分别为CMC酶活0.76 U/mL,FPA酶活0.65 U/mL,而菌系的产酶活力随着其进入对数生长期后明显升高。培养第4 d,菌系进入稳定期,其产酶活力达到峰值,分别为CMC酶活3.62 U/mL及FPA酶活1.85 U/mL。而第4d后,培养基中营养物质被不断消耗,菌系代谢产物也不断积累,菌系的产酶活力大小整体呈现出下降趋势。综上所述,菌系的最佳产酶时间为培养第4 d,最大酶活力分别为CMC酶活3.62 U/mL,FPA酶活1.85 U/mL。
2.5.2不同培养温度对菌系产酶的影响
菌系产酶活力受温度变化的影响较为明显。酶的催化效率随温度的升高而不断加强,温度最适时酶的催化效率最强,而随着温度的再度升高会使酶活性降低最终导致变性失活,所以只有确定菌系培养的最适温度对研究其最大酶活力来说很有必要。菌系产酶活力大小和温度的关系如图10所示。
由图 10可看出,菌系酶活受温度影响的整体趋势表现为:逐渐增强,最适温度时达到最大酶活力,随着温度不断升高呈现下降趋势。温度升至35℃时,酶活力达到峰值,分别为CMC酶活 3.75 U/mL,FPA酶活1.79 U/mL,之后两种酶活都随温度升高表现为下降趋势。综上所述可知,菌系在35℃时达到最大酶活,酶活力大小分别为CMC酶活3.75 U/mL,FPA 酶活1.79 U/mL。

图10 不同菌系酶活受培养温度的影响对比图

图11 菌系酶活受不同初始pH的影响对比图
2.5.3不同初始pH对菌系产酶的影响
pH值对酶活力大小主要的影响为:破坏其蛋白空间的结构使其活性丧失;影响其活性部位催化基团的解离状态,导致无法分解底物;影响活性部位结合基团的解离状态,导致无法结合底物。菌系产酶活性受不同初始pH的影响如图11所示。
根据图11所示,培养基的初始pH值对菌系酶活力大小产生了很大影响。pH值为4.5时,酶活力分别为CMC酶活0.76 U/mL,而FPA酶活0.63 U/mL,此时酶活力较低。而当pH升至6时,CMC酶活较大为3.32 U/mL,而CMC酶活在pH为6.5时达到峰值3.56 U/mL,由此可得其CMC酶的最适pH范围为6~6.5,最适pH为6.5。其菌系的FPA酶活也在pH为6.5时出现峰值1.86 U/mL,pH升至7时,仍维持相对较高,达到1.79 U/mL,由此可见菌系的FPA酶最适pH范围为6.5~7,最适pH为6.5。可见菌系的酶活力大小整体表现为随着pH值的增大先升高后降低。综上所述可得:菌系的最适产酶pH范围为6~7,最适产酶pH为6.5。
2.5.4不同氮源对菌系产酶的影响
氮是核酸和蛋白质的主要组成元素,其本身虽不能诱导菌体产生纤维素酶,但是它对菌体的生长很重要。所以对不同氮源影响菌系产酶的研究是很必要的。本实验分别以尿素、(NH4)2SO4、蛋白胨和 KNO3作为菌体培养基的唯一氮源进行研究,结果如图12所示。
通过图12可知,其他条件相同时,菌系对(NH4)2SO4和蛋白胨的利用率相对较高,所产酶活力较强。当以蛋白胨为唯一氮源培养时酶活力最高分别为CMC酶活3.83 U/mL,FPA酶活1.77 U/mL,可见菌系的最适氮源为蛋白胨。
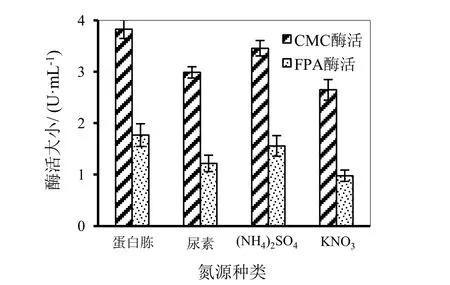
图12 菌系酶活受氮源影响对比图
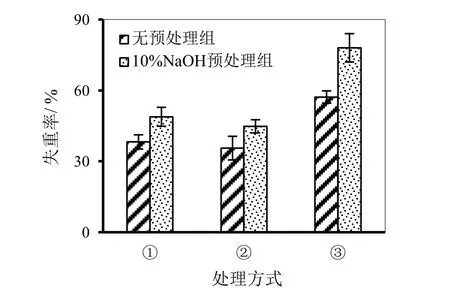
图13 秸秆失重率对比图
2.6 秸秆降解效果研究
分别将菌株①、②和复合菌系③的菌液与秸秆液体发酵培养液混合发酵,通过秸秆失重率的测定探究各菌系对玉米秸秆降解效果的影响。各组失重率测定情况如图13所示。
10% NaOH预处理组进行7天预处理,预处理后将发酵液pH值调至6.5后接菌再发酵15 d,而无预处理组则接菌后直接发酵15 d,后测定各处理组的秸秆失重率。由图13可知,复合菌系发酵的秸秆失重率相交其他两种单一菌株较高,而复合菌系的10% NaOH预处理组秸秆失重率最高,达到了78.10%,与单一菌种的最大失重率相比分别提高了29.18%和33.23%。综上所述可知,复合菌系③的10% NaOH预处理组降解效果最好。
3 结论
研究结果表明,在纤维素降解菌的初筛过程中,通过对透明圈与菌落直径比值对比可知,Pelomonas gx.+Curvibacter zj.复合菌系产纤维素酶能力较高,透明圈与菌落直径比可达到10.5,而在纤维素高产菌株的培养条件优化中,通过CMC酶活与FPA酶活大小的比较可得出,复合菌系Pelomonas gx.+Curvibacter zj.在温度35℃、pH为6.5、蛋白胨为氮源的条件下培养4 d产酶最优,产酶能力明显高于单一菌株,其在结合化学预处理后秸秆降解率最高,秸秆干粉失重率可达78.10%。
与前人相比,段杰等[5]研究了木霉与青霉属的复合菌系降解玉米秸秆,失重率达34.52%。王海滨等[12]研究了弗留明拜叶林克氏菌等不同细菌复合菌系降解玉米秸秆,失重率达63.10%。本研究所筛两种菌虽尚未有纤维素降解相关研究,但其基因序列与假单胞菌属序列相似度很高,而大量研究表明假单胞菌属具有纤维素降解功能,且实验结果表明此两种菌所构复合菌系降解玉米秸秆失重率可达78.10%,较前人研究降解率均较高。在化学法预处理中得出添加10% NaOH溶液对秸秆预处理降解效果最好的结论,这与李轶等在试验中添加 10% NaOH溶液后加入绿色木霉的处理方式对秸秆木质素的降解效果较好且降解率达到39.28%的研究结果一致[13]。
但对于原材料的选择方面,本研究仅选取玉米秸秆作为实验原材料,可在以后的研究中适当增加材料的选取种类,对其他农作物秸秆进行有关研究,以便更好的发挥其实际应用价值。
