牦牛乳制品中马尿酸和苯甲酸含量快速检测方法
2019-01-10刘怡雯唐善虎李思宁宋凯红
刘怡雯,唐善虎,*,李思宁,宋凯红
(1.西南民族大学生命科学与技术学院,四川成都610041;2.四川新华西乳业有限公司,四川成都611732)
马尿酸和苯甲酸普遍存在牛乳制品中,据报道马尿酸含量为 30 mg/L~60 mg/L、苯甲酸为 0~22.7 mg/L[1]。有研究表明,牛乳在发酵形成酸奶过程中,乳酸菌能够将马尿酸转化为苯甲酸,但此反应不能逆向进行[2],从而导致酸奶中苯甲酸的含量高于普通乳制品。
目前苯甲酸及其钠盐是我国最常用的食品添加剂之一,GB 2760-2014《食品安全国家标准食品添加剂使用标准》给出了苯甲酸及其钠盐的安全使用范围,但同时也规定了酸奶中不允许添加苯甲酸及其钠盐,并有研究表明,长期摄入过量苯甲酸会导致神经兴奋、腹泻甚至可能会引发癌症[3-4]。
牦牛是高海拔牧区的特色畜禽资源,其所产的牦牛奶富含丰富的氨基酸、钙、铁、锌、维生素等营养物质,相比普通牛奶,牦牛乳含有更高的功能性脂肪酸和蛋白质,越来越受到人们的喜爱[5]。但由于高原牧区经济落后,牦牛乳长期以来主要以自给自足的方式进行生产,在生产过程中由于手工采集、器皿清洁的不达标、较差的卫生环境、质量的不稳定等因素导致其苯甲酸含量过高,限制了牦牛乳市场发展,导致其无法登上中国乳制品的主流销售渠道[6]。为了保障牦牛酸乳品质质量和特性,打造地方特色产品品牌,更好地促进地区经济发展和农牧民增收致富,我们迫切地需要建立牦牛乳中马尿酸转化为苯甲酸动态检测的方法、制定牦牛酸奶中马尿酸、苯甲酸的最高限量,从而保证人们的食品安全、提高牧区百姓的收入。
国外目前主要利用毛细管电泳[7]、气相色谱[8]和液相色谱[9-14]等方法来检测乳制品中马尿酸、苯甲酸含量,但大部分方法主要集中于分开检测两种物质,同时检测两种物质的方法报道尚少。与此同时,国内有关同时检测马尿酸和苯甲酸的食品安全国家标准尚属空白,相关研究也相对较少。高效液相色谱法是检测马尿酸和苯甲酸最为常用的方法之一,具有设备普及率高、操作简单、检测成本低等特点[15-16]。鉴于以上研究,本文参考章唯[17]、赵贞等[18]学者在高效液相色谱对马尿酸、苯甲酸同时检测方法的基础上,通过讨论比较不同比例的流动相、流速、沉淀剂等因素对检测结果的影响情况,从而对其进行优化选择,建立一种更加快捷、灵敏度高、重现性好的方法。
1 材料与方法
1.1 仪器与试剂
Waters2695高效液相色谱仪、TB-215D分析天平:北京赛多斯仪器系统公司;KQ5200DB超声清洗器:中国曙峰企业;甲醇(色谱纯)、乙酸(色谱纯)、乙酸铵(色谱纯)、草酸钾(分析纯)、磷酸氢二钠(分析纯)、乙酸铅(分析纯)、亚铁氰化钾(分析纯)、乙酸锌(分析纯)、正己烷(分析纯):成都市科龙化工试剂厂;马尿酸标准品(纯度98%)、苯甲酸标准品(纯度98%):上海源叶生物技术有限公司。
1.2 试验方法
1.2.1 溶液的制备
草酸钾-磷酸氢二钠溶液:称取草酸钾15 g、磷酸氢二钠35g,加少量水,充分搅拌溶解,定容至500 mL。
乙酸铅溶液:称取100 g乙酸铅,加少量水,充分搅拌溶解,定容至500 mL,配制成质量浓度为200 g/L的溶液。
亚铁氰化钾溶液:称取53 g亚铁氰化钾,加少量水,充分搅拌溶解,定容至500 mL。
乙酸锌溶液:称取109.5 g二合水醋酸锌,加水溶解后,再加入16 mL冰乙酸,加少量水,充分搅拌溶解,定容至500 mL。
乙酸铵溶液:称取0.77 g乙酸铵,加水溶解,充分搅拌溶解,定容至500 mL,配制成浓度为0.02 mol/L的溶液。
马尿酸储备液:准确称取0.0500g马尿酸,用10mL甲醇溶解,加少量水,超声充分溶解,定容至50 mL,配制成质量浓度为1 mg/mL的马尿酸溶液。
苯甲酸储备液:准确称取0.0500g苯甲酸,用10mL甲醇溶解,加少量水,超声充分溶解,定容至50 mL,配制成质量浓度为1 mg/mL的苯甲酸溶液。
1.2.2 样品处理
液固态样品:准确称取样品(5.00±0.05)g于试管中,待测。
乳粉样品:准确称取样品(3.00±0.05)g于试管中,加入10 mL 40℃左右温水溶解,待测。
在上述准备好的样品中加入乙酸铅溶液和草酸钾-磷酸氢二钠溶液各4 mL,涡旋1min,50℃超声20 min,8 000 r/min离心10 min,取其上清液,加5 mL正己烷,涡旋1 min,8 000 r/min离心5 min,取其下清液转入50 mL定容瓶中,加水定容,摇匀,上述溶液再经0.45 μm滤膜过滤,待液相色谱分析测定。
1.2.3 样品沉淀剂的选择
蛋白质沉淀常用的方法有酸碱沉淀法、无机重金属沉淀法和有机沉淀法[19]等。本试验选择重金属沉淀法来除去牦牛酸奶的蛋白质。通过查阅相关文献,本试验选择亚铁氰化钾-乙酸锌和乙酸铅2种沉淀剂,通过比较其滤液澄清度、样品回收率确定出最佳沉淀剂。
1.2.4 检测波长的选择
通过waters仪器二级管阵列检测器对马尿酸、苯甲酸在190 nm~400 nm范围内进行全波段扫描,确定出最佳检测波长。
1.2.5 流动相的选择
通过查阅文献可知,在马尿酸和苯甲酸高效液相色谱法中有机相通常是甲醇,水相是乙酸和乙酸铵两种物质[19-20]。本试验将甲醇作为有机相,比较乙酸和乙酸铵两种水溶液;通过分析讨论马尿酸、苯甲酸的检测时间、分离效果、峰面积等因素比较乙酸和乙酸铵两种水溶液,从而选择出更适宜的水相。
1.2.6 流动相的最佳比例
根据上述试验的结果,在流速1 mL/min、进液量20 μL、马尿酸和苯甲酸混合标准液浓度为1 μg/mL的条件下,探究流动相的比例,确定流动相的最佳比例,具体比例设定见表1。

表1 流动相比例的设定Table 1 Setting of mobile phase ratio
1.2.7 流速的选择
根据上述试验,在最佳流动相比例的条件下,比较不同流速对马尿酸、苯甲酸分离情况,选出最适宜的流速。具体设定见表2。

表2 流速的设定Table 2 Flow rate setting
2 结果与分析
2.1 样品沉淀剂的确定
本试验分析讨论了样品加标后分别采用亚铁氰化钾-乙酸锌和乙酸铅—草酸钾-磷酸氢二钠溶液2种沉淀剂处理,其马尿酸、苯甲酸的回收率及样品过滤后澄清度情况,从而确定出最适宜的沉淀剂。具体数据见表3。

表3 不同沉淀剂处理样品后马尿酸、苯甲酸的回收率及相对标准偏差结果Table 3 Result of rate of recovery and relative standard deviation(RSD)of hippuric acid and benzoic acid after treatment with different precipitators
由表3可知,加标样品选用乙酸铅—草酸钾-磷酸氢二钠溶液处理后,其澄清度和回收率、精确度都普遍优于用亚铁氰化钾-乙酸锌溶液处理的样品。(赵贞等[18]在利用高效液相色谱法检测乳品中的马尿酸和苯甲酸研究中,通过比较不同沉淀剂对样品沉淀的效果也认为乙酸铅—草酸钾-磷酸氢二钠溶液的沉淀蛋白效果最佳。)祝伟霞等[20]在探讨测定乳制品中苯甲酸和山梨酸含量的方法中选用乙酸锌-亚铁氰化钾溶液作为沉淀剂,样品加标回收率为87.4%~110.0%。王淼等[21]建立的高效液相色谱法同时测定乳及乳制品中苯甲酸、山梨酸、安赛蜜和糖精钠的方法中利用亚铁氰化钾-乙酸锌溶液作为沉淀剂,方法回收率在95.0%~103.0%,相对标准偏差(relative standard deviation,RSD)为1.70%~2.03%。祝伟霞和王淼等[20-21]得出的乙酸锌-亚铁氰化钾处理后样品加标回收率普遍高于本试验苯甲酸的加标回收率,这可能是由于牦牛酸乳的pH值跟普通牛乳存在差异所导致,考虑到亚铁氰化钾对眼睛、呼吸系统及皮肤有一定的刺激性并受热分解,对检测人员身体存在安全隐患,综上所述,选择乙酸铅—草酸钾-磷酸氢二钠溶液作为样品沉淀剂。
2.2 检测波长的确定
经waters仪器二级管阵列检测器对马尿酸、苯甲酸在190 nm~400 nm范围内进行全波段扫描,为避免低波长杂质的干扰,本试验综合考虑,选择230 nm作为检测波长。而章唯[17]在红原牦牛乳制品中苯甲酸溯源分析研究中选择的最佳检测波长为235 nm,这可能是由于不同的仪器和流动相导致在不同波长下马尿酸和苯甲酸的响应值略有不同。
2.3 流动相的确定
本试验在有机相为甲醇,有机相与水相比例为50∶50(体积比)的条件下,0.4%乙酸溶液和 0.1 mol/L乙酸铵溶液分别为水相时,比较检测物质的检测时间、检测时间及峰面积,确定出最佳流动相。具体数据见表4。
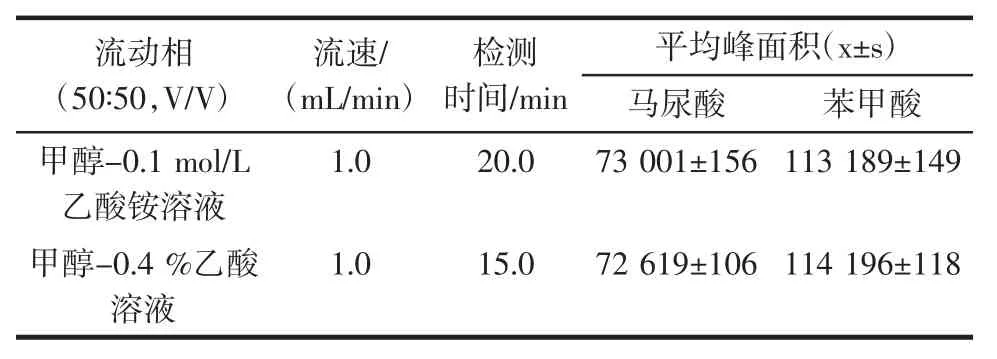
表4 不同流动相的检测结果Table 4 Detection results of different mobile phases
由表4可知选择乙酸铵盐类作为流动相时,马尿酸和苯甲酸的检测时间为20 min,此外,每次上机前需要用高水相(10%甲醇)过滤冲洗,以避免造成堵塞,检测周期准备时间长,不利于马尿酸、苯甲酸的快速检测;而选择0.4%乙酸水溶液无需使用高水相进行过滤冲洗,马尿酸和苯甲酸检测时间仅为15 min,且马尿酸、苯甲酸的峰面积大小在不同流动相下差异不明显,且操作更加简单、检测周期短。综上所述,本试验确定将0.4%乙酸水溶液和甲醇作为流动相。
2.4 流动相的最佳比例
本试验在甲醇-0.4%乙酸水溶液作为流动相,检测波长230 nm,进液量20 μL,马尿酸、苯甲酸混合标准液浓度为1 μg/mL的条件下,通过单标、混标和空白对照的方式确定样品中马尿酸、苯甲酸的定性位置,采用单因素试验设计方法,流速为1.0 mL/min,甲醇与0.4%乙酸水溶液的体积比从60∶40调整到40∶60,得到的结果见图1。
由图1A可知,当流速为1.0 mL/min,甲醇∶0.4%乙酸水溶液=60∶40(体积比)时,马尿酸出峰时间为3.26 min,苯甲酸出峰时间为5.49 min。该条件下马尿酸出峰时间太早,与杂质峰出峰时间接近,样品峰将出现严重重叠,不适宜作为样品的分析条件。
由图1B可知,当流速为1.0 mL/min,甲醇 0.4%乙酸水溶液=50∶50(体积比)时,马尿酸出峰时间为3.89 min,苯甲酸出峰时间为8.57 min。该条件下马尿酸出峰时间与杂质峰基本分离,两样品峰完全分离,适宜作为样品的分析条件。


图1 流动相的比例选择Fig.1 Selection of the proportion of mobile phase
由图1C可知,当流速为1.0 mL/min,甲醇∶0.4%乙酸水溶液=40∶60(体积比)时,马尿酸出峰时间为5.13 min,苯甲酸出峰时间为15.29 min。该条件下马尿酸出峰时间与杂质峰基本分离,两样品峰完全分离,但流动相若水相比例较大的话,在大批量样品处理过程中,对柱子的损伤较大,且随着水相的增加,检测时间有15 min增加到25 min,检测周期加长,故不适宜作为本试验样品的分析条件。
综上所述,本试验的流动相最佳比例确定为甲醇∶0.4%乙酸水溶液=50∶50(体积比)。
2.5 流速的确定
本试验采用单因素试验设计方法,流动相为甲醇∶0.4%乙酸水溶液=50∶50(体积比),流速从1.0 mL/min调整到0.8 mL/min,得到的结果见图2。不同流速下,马尿酸和苯甲酸的平均峰面积值见表5。
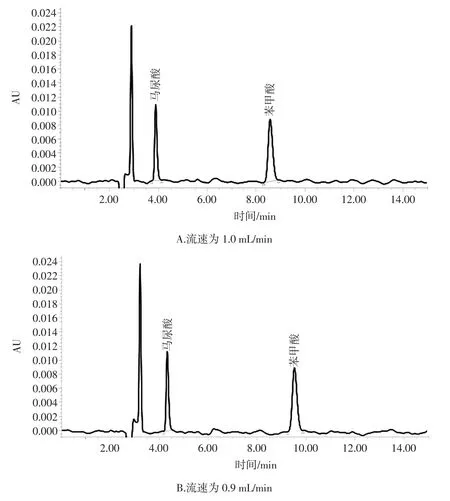

图2 不同流速下的峰面积Fig.2 Peak area at different velocities
表5 马尿酸、苯甲酸的平均峰面积(±s)Table 5 Average peak area of hippuric acid and benzoic acid(±s)

表5 马尿酸、苯甲酸的平均峰面积(±s)Table 5 Average peak area of hippuric acid and benzoic acid(±s)
流速/(mL/min)标准品(1 μg/mL)马尿酸 苯甲酸1.0 72 619±106 114 196±118 0.9 77 278±68 120 424±89 0.8 90 399±97 142 381±103
通过比较马尿酸、苯甲酸在不同流速下的平均峰面积可知,随着流速降低,马尿酸、苯甲酸的平均峰面积逐渐增大,峰宽增大。考虑到峰型和试样样品成分复杂,为避免流速过低,杂质可能无法不能完全冲出色谱柱从而导致色谱柱堵塞等因素,将本试验的流速确定为0.9 mL/min。
2.6 高效液相色谱(high performance liquid chromatography,HPLC)分析
通过试验数据最终确定HPLC色谱条件为:测定波长:230 nm;色谱柱:C18色谱柱(250 mm×4.6 mm,5 μm);流动相:甲醇 ∶0.4%乙酸水溶液=50 ∶50;流速:0.90 mL/min;进样量:20 μL;柱温:30 ℃;进样时间15 min。以此条件得到标准品和耗牛酸奶的HPLC图见图3和图4。
由图4可知,马尿酸于4.33 min出峰,苯甲酸于9.52 min出峰。两者出峰时间不同,马尿酸、苯甲酸得到了很好的分离。
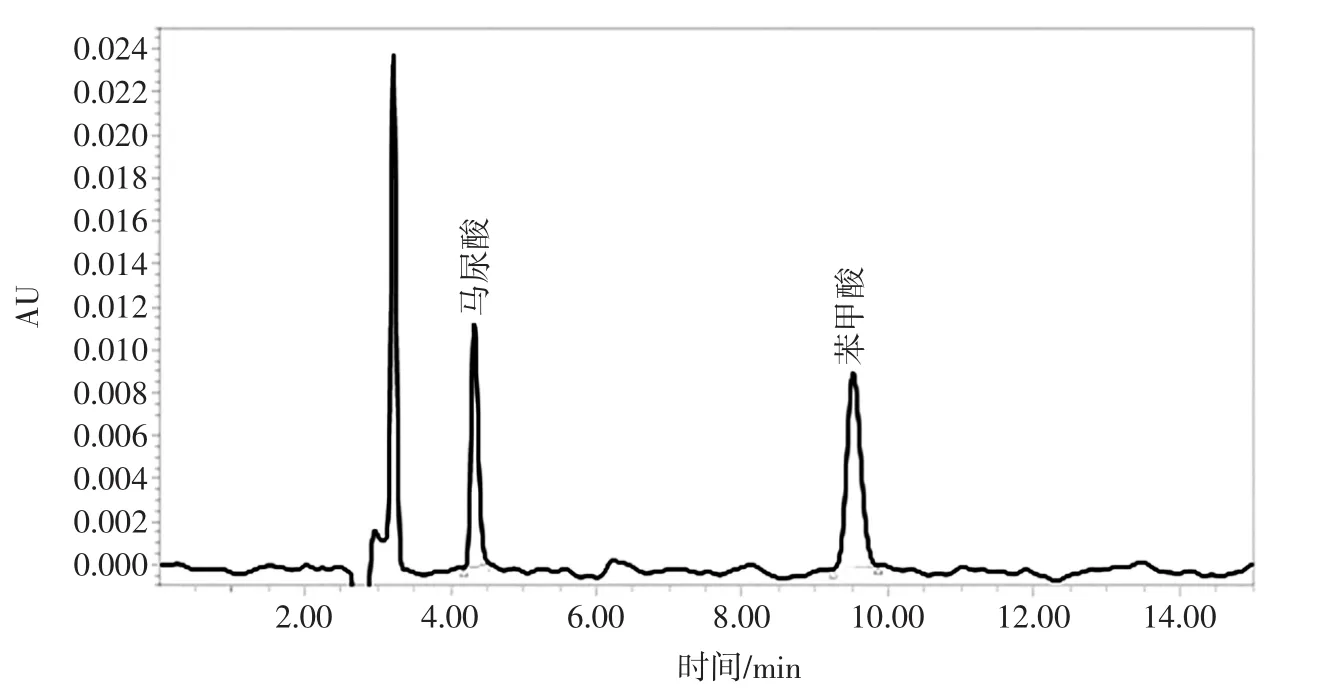
图3 标准品的HPLC色谱图Fig.3 HPLC chromatogram of standard products
2.7 标准曲线建立、线性范围、检出限
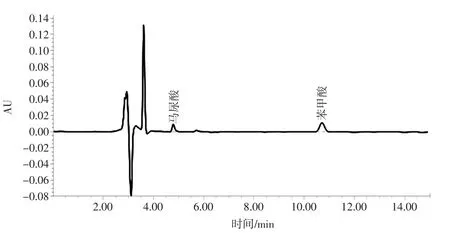
图4 牦牛酸奶的HPLC色谱图Fig.4 HPLC chromatogram of yak yoghurt
配制浓度为 0、2.5、5.0、10、25、50、100 μg/mL 的马尿酸苯甲酸混合标准溶液,测定峰面积,以峰面积对浓度制作标准曲线,建立线性方程:马尿酸:y=10-5x+0.106 9;R2=0.999 9;苯甲酸:y=8-6x+0.256 8;R2=0.999 5。由此可知2种物质的线性关系良好,R2均大于0.999。最低检测浓度按3倍信噪比,进样20 μL计算,最低检测限为 0.038 μg/mL,线性范围 1 μg/mL ~100 μg/mL。谢国祥等[22]在乳制品中马尿酸的检测及其在发酵过程中的动态变化研究表明在以C18为固定相,甲醇-水-醋酸体系为流动相,最低检出量为1.8 ng,最低检出浓度为0.09 mg/kg。赵贞等[18]在高效液相色谱法同时检测乳品中的马尿酸和苯甲酸研究中,在C18反相色谱柱分离,以乙酸铵-甲醇溶液为流动相条件下,按照信噪比RS/N=10计算得出,马尿酸和苯甲酸的定量检出限为1 mg/kg。屈莉等[15]在高效液相色谱法直接测定尿中马尿酸的研究中,采用甲醇:磷酸盐缓冲液(20∶80,体积比)为流动相,流速0.8mL/min,PE4.6×150mm C18/5 μm柱分离,二极管阵列检测器检测波长220 nm,方法检出限为1.2 mg/L。由此可知,本试验建立的高效液相色谱法同时测定牦牛酸乳中马尿酸、苯甲酸的检出限比之前相关学者建立的方法得出检测限更低,对马尿酸、苯甲酸在发酵过程中的动态检测将更加精准。
2.8 回收率和精密度
发酵乳样品中加入不同浓度的马尿酸和苯甲酸,平行测定5次,每个样品添加标准品后,涡旋10 s,放置10 min,再按提取净化与测定的步骤进行含量的测定,得出平均回收率和相对标准偏差。具体结果见表6、表 7。
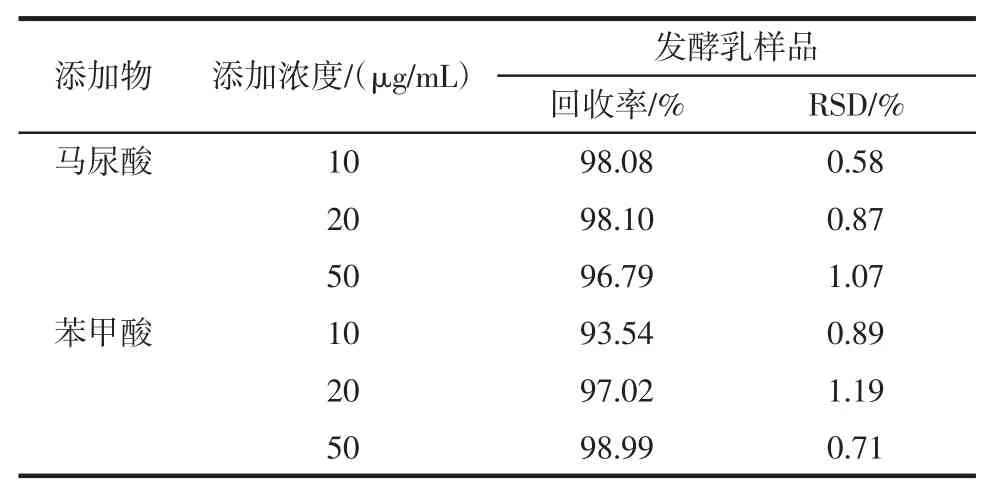
表6 发酵乳样品的添加回收率结果Table 6 Results of added recovery of fermentation milk samples
由表6、表7可知,本方法测定马尿酸平均回收率为96.79%~98.10%,RSD为0.58%~1.07%,苯甲酸平均回收率为93.54%~98.99%,RSD为0.71%~1.19%;对加标的牛乳和发酵乳样品平行测定5次,RSD值分别为0.58%和1.07%。章唯[17]在红原牦牛乳制品中苯甲酸溯源分析中建立了高效液相色谱法同时检测牦牛奶粉中马尿酸和苯甲酸的方法,马尿酸、苯甲酸的平均回收率为88.6%和92.23%。赵贞等[18]建立了高效液相色谱法同时检测乳品中的马尿酸和苯甲酸方法,该方法马尿酸平均回收率为95.3%~97.7%,相RSD为0.37%~1.52%,苯甲酸平均回收率为102.7%~103.6%,RSD为0.57%~1.33%。综上所述,本试验建立的方法在回收率、精确度和重现性上优于章唯[17]学者建立的高效液相方法,虽然苯甲酸的回收率不及赵贞等[18]检测的方法,但是差异不大,重现性更好。

表7 方法精密度试验结果Table 7 Precision experiment results of the method
3 结论
本研究建立优化了牦牛酸乳中马尿酸和苯甲酸的 HPLC 检测方法,在C18(250 mm×4.6 mm,5.0 μm)为分离柱,检测波长为230 nm,进液量为20 μL条件下,流动相为甲醇与0.4%乙酸水溶液,其体积比为50∶50,流速为0.9 mL/min时,最低检测限为0.038 μg/mL,在线性范围1 μg/mL~100 μg/mL内有良好的线性关系,R2>0.999,尿酸平均回收率为96.79%~98.10%,RSD为0.58%~1.07%,苯甲酸平均回收率为93.54%~98.99%,RSD为0.71%~1.19%,马尿酸和苯甲酸加标样品5次平行测定的RSD值分别为0.58%和1.19%。该方法检测时间短、回收率和精密度高、检出限低,为监测牦牛乳制品中马尿酸和苯甲酸的含量水平提供了一种可行的分析方法。
