紫草素诱导卵巢癌SKOV3和A2780细胞坏死性凋亡的作用及其机制研究
2019-01-10马建文饶梅冬
冯 伟,马建文,饶梅冬 △
(1.新疆维吾尔自治区乌鲁木齐市妇幼保健院,新疆 乌鲁木齐 830001; 2.新疆医科大学附属中医医院,新疆 乌鲁木齐 830001)
卵巢癌发病率居女性生殖系统恶性肿瘤第3位,但死亡率远远超过其他任何一种妇科恶性肿瘤,位居第1位[1]。其主要原因是发病隐匿,早期症状不明显,缺乏有效的早期诊断方法,60%~70%的患者确诊时已属晚期,5年生存率仅30%[2]。传统的化学治疗(简称化疗)药物主要细胞毒性类药物,其作用机制主要依赖于肿瘤细胞与正常细胞生长、修复、死亡动力学等之间的差异,往往缺乏特异性[3]。因此,选择性杀死肿瘤细胞而减少对正常组织的损伤作用是恶性肿瘤化疗的新挑战。紫草素(shikonin)是一种由草本植物紫草根部衍生而来的萘醌化合物,具有良好的抗炎和抗菌活性,用于治疗烧伤、皮肤病和喉咙疼痛等[4];还具有显著的抗肿瘤活性,如诱导肝癌细胞凋亡、抑制黑色素瘤的增殖、杀死白血病细胞等[5-6]。其抗肿瘤作用机制与诱导肿瘤细胞的凋亡(apoptosis)和坏死性凋亡(necroptosis)有关,且在引起肿瘤细胞凋亡和坏死性凋亡过程中活性氧(ROS)的过量产生往往有着重要作用[7-8]。作为一种细胞程序性死亡方式,坏死性凋亡跟多种抗肿瘤药物的作用机制相关[9]。本研究中探讨了紫草素对人卵巢癌细胞SKOV3和A2780增殖的影响及可能的作用机制,现报道如下。
1 材料与方法
1.1 仪器、试药与细胞
仪器:BX53型荧光显微镜(日本奥林巴斯公司);BD FACSVia型流式细胞仪(美国BD Biosciences公司)。
试药:MEM培养基、胎牛血清均购于美国Hyclone公司;紫草素(纯度≥98%,批号为S7576,规格为10 mg),二甲基亚砜(DMSO,纯度≥99.7%,批号为D2650-5X,规格为 5 mL),Hoechst 33342(纯度≥98.0% ,批号为B2261,规 格 为 25 mg),PI(纯 度 ≥ 98.0% ,批 号 为04511-1KT-F),受体相互作用蛋白激酶 1(RIP1)抑制剂(Nec-1,纯度≥98.0% ,批号为 SML1990,规格为5 mg),N-乙酰 -L-半胱氨酸(NAC,纯度≥98.0%,批号为 1009005,规格为 200 mg),PI-Annexin V-FITC 试剂盒(批号为 APOAF-20TST)和 2′,7′- 二氯荧光黄双乙酸盐 (DCFH-DA)荧光探针(纯度≥97.0% ,批号为D6883,规格为50 mg),均购于美国Sigma公司;小鼠抗人单克隆RIP1和RIP3抗体(美国Abcam公司),小鼠抗人单克隆β-Actin抗体(美国Santa Cruz Biotechnology公司);Cy3标记的山羊抗小鼠IgG多克隆抗体(二抗,中国中山金桥生物技术公司)。
细胞:人卵巢癌细胞SKOV3(编号为HTB-77)和A2780(编号为C0049),人正常卵巢上皮细胞IOSE80(编号为C1390),均购于中国科学院典型培养物保藏委员会细胞库。
1.2 方法
细胞培养和分组:将 SKOV3,A2780,IOSE80细胞置MEM培养液中,其培养基中含10%胎牛血清、链霉素100 U/mL和青霉素100 U/mL,在5%CO2及37℃条件下培养。待细胞铺满瓶壁70% ~80%时,再以胰蛋白酶消化传代培养,取对数生长期细胞进行实验。IOSE80细胞只进行不同浓度紫草素处理后细胞活性的检测。按SKOV3细胞和A2780细胞分为对照组、紫草素组、NAC预处理合并紫草素组和Nec-1预处理合并紫草素组。紫草素组加用不同浓度的紫草素处理;NAC预处理合并紫草素组先使用1 nmol/L的NAC预处理2 h,离心,换液,然后用 5 μmol/L 紫草素处理 24 h 后检测;Nec-1预处理合并紫草素组先使用100 μmol/L的 Nec-1 预处理 2 h,离心,换液,然后用 5 μmol/L 紫草素处理24 h后检测。
四甲基偶氮唑盐(MTT)法检测细胞增殖:取已准备好的单细胞悬液,以5×105个/mL的密度接种于96孔培养板,每孔100 μL,每组设5个复孔。标准条件培养过夜后,于48 h加入新的含紫草素的培养液,紫草素每孔终浓度分别为 2.5,5.0,7.5,10.0,12.5,15.0 μmol/L,对照组不加药物(只含等量培养基),每组细胞均培养24 h后加入20 μL 5 g/L的MTT溶液处理,培养结束后,加入 150 μL DMSO,避光振荡 10 min,置酶标仪于492 nm波长处检测各孔吸光度,计算增殖抑制率。另外,不同时间的实验选择紫草素的浓度为6.25 μmol/L,分别处理 6,12,18,24,30,36 h,其他实验步骤同上。存活率 =A处理组/A对照组×100%。
流式细胞术检测细胞坏死性凋亡:将细胞用磷酸盐缓冲液(PBS)洗涤2次后重悬于Binding Buffer,然后加入 5 μL的 Annexin V-FITC 染色,混匀,再加入 5 μL PI,混匀,室温避光反应10 min,采用流式细胞仪检测细胞凋亡率。
Hoechst 33342和PI染色观察细胞形态:将对数期细胞按每孔1×105个置预先置入玻璃盖玻片的6孔培养板中,每孔加细胞悬液2 mL,24 h后给药,再孵育24 h后吸尽培养液,PBS洗2遍,每孔加入1 mL固定液[甲醇 - 冰醋酸 (3 ∶1)],固定 15 min,去除固定液,用PBS 洗 2 遍,加入 10 μg/L的 Hoechst33342,染色 10 min,用 PBS 洗 2 遍,再加入 10 μg/L 的 PI,染色 10 min,用PBS洗2遍,于荧光显微镜下观察细胞形态。
活性氧测定:采用DCFH-DA荧光探针测定。不同浓度紫草素处理细胞后,取对数生长期细胞并调整细胞浓度至 1~10×106个 /mL,加入终浓度为 10 μmol/L的 DCFH-DA,37℃及 5%CO2培养箱中静置0.5 h,每隔3~5 min混匀1次,使探针和细胞充分作用。用温暖的PBS洗涤细胞3次,去除未进入细胞内的DCFH-DA,最后收获各组细胞,采用流式细胞术测量DCF荧光强度。
蛋白质印迹(Western Blotting)法检测:取对数生长期细胞接种于培养瓶,离心,弃培养液,加入RIPA细胞裂解液裂解30 min,BCA法测定裂解液中的蛋白浓度。取30 μg蛋白样品进行SDS-PAGE电泳,TBST漂洗,将PVDF膜置含有RIP1,RIP3,β-Actin对应单克隆抗体一抗中(1∶1 000),4℃冰箱孵育,过夜,用TBST漂洗,再与Cy3标记的山羊抗小鼠IgG多克隆抗体(1∶5 000)室温孵育2 h,漂洗后,用Tanon 5500型凝胶成像系统拍照,并分析蛋白产物条带的相对光密度值。
1.3 统计学处理
2 结果
2.1 抑制卵巢癌细胞增殖
结果见图 1。不同浓度紫草素处理24 h后,对SKOV3和A2780细胞的增殖均有明显的抑制作用,且呈现一定剂量的依赖性,半数抑制浓度(IC50)分别为6.25 μmol/L 和 10.0 μmol/L;对 IOSE80 细胞的增殖无显著的抑制作用。6.25 μmol/L紫草素处理不同时间后,对SKOV3和A2780细胞的增殖均有明显的抑制效应,且呈现时间依赖性。

图1 紫草素对卵巢癌细胞增殖的影响(X ± s,n=3)
2.2 诱导卵巢癌细胞坏死性凋亡
结果见图 2 和图 3。可见,5 μmol/L 和 10 μmol/L 紫草素处理后,SKOV3和A2780细胞的早期凋亡率(Annexin V+/PI-细胞)无明显变化,而 PI+细胞和Annexin V+/PI+细胞的比例明显增加,与对照组相比,差异有统计学意义(P< 0.05,P< 0.01)。进一步使用Hoechst 33342和PI染色进行定性分析,结果见图4。PI+细胞无明显细胞凋亡特征,说明Annexin V+/PI+细胞不是晚期凋亡的细胞,PI+细胞和Annexin V+/PI+细胞主要是坏死性凋亡的细胞。提示紫草素诱导SKOV3和A2780细胞坏死性凋亡呈剂量和时间依赖性。

图2 紫草素诱导卵巢癌细胞Annexin V-FITC/PI双染色流式分析结果
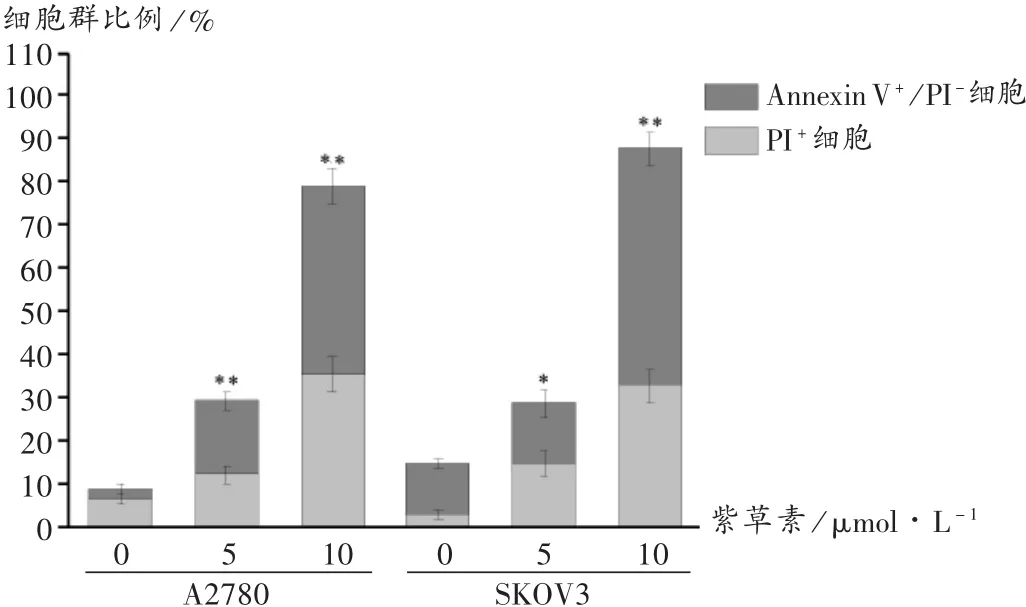
图3 紫草素诱导卵巢癌细胞坏死性凋亡定量分析(X ± s,n=3)
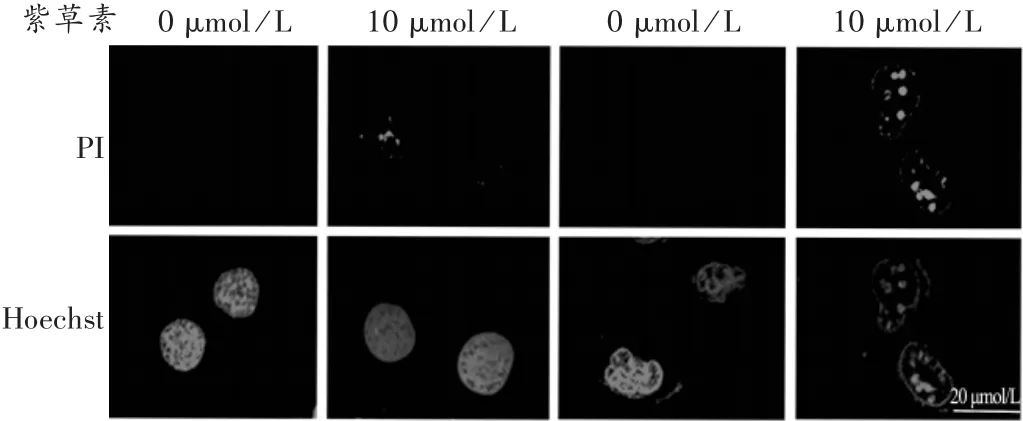
图4 紫草素诱导卵巢癌细胞调亡Hoechst 33342和PI染色定性分析结果(×200)
2.3 诱导卵巢癌细胞活性氧产生
使用DCFH-DA荧光探针检测紫草素诱导卵巢癌细胞活性氧的产生。由图 5 可见,5 μmol/L 或 10 μmol/L紫草素处理后,可明显诱发SKOV3和A2780细胞活性氧的产生,与对照组相比,差异有统计学意义(P<0.01)。
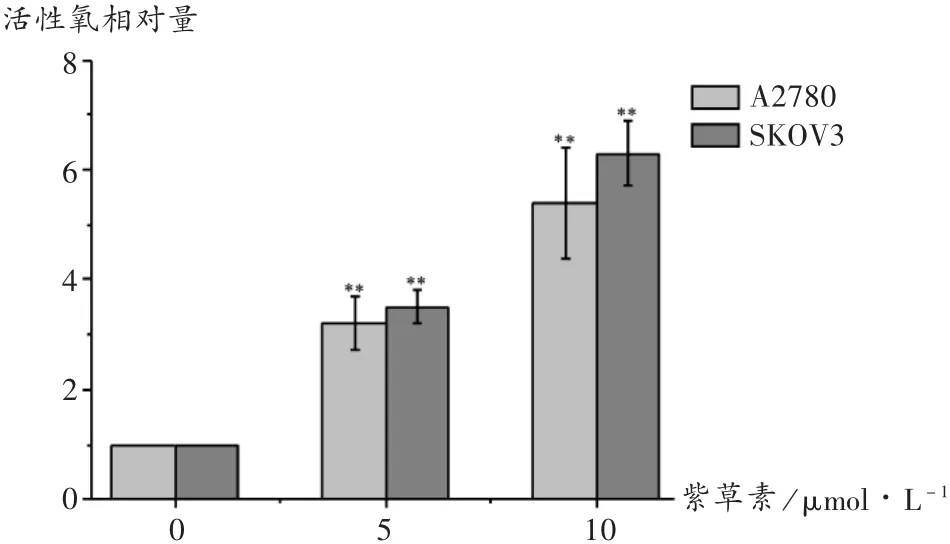
图5 紫草素诱导卵巢癌细胞活性氧相对量(X ± s,n=3)
2.4 卵巢癌细胞RIP1和RIP3蛋白的表达
结果见图 6 和图 7。5 μmol/L 和 10 μmol/L 的紫草素处理后,可明显上调坏死性凋亡相关蛋白RIP1和RIP3的表达,与对照组相比,差异有统计学意义(P<0.05,P<0.01)。
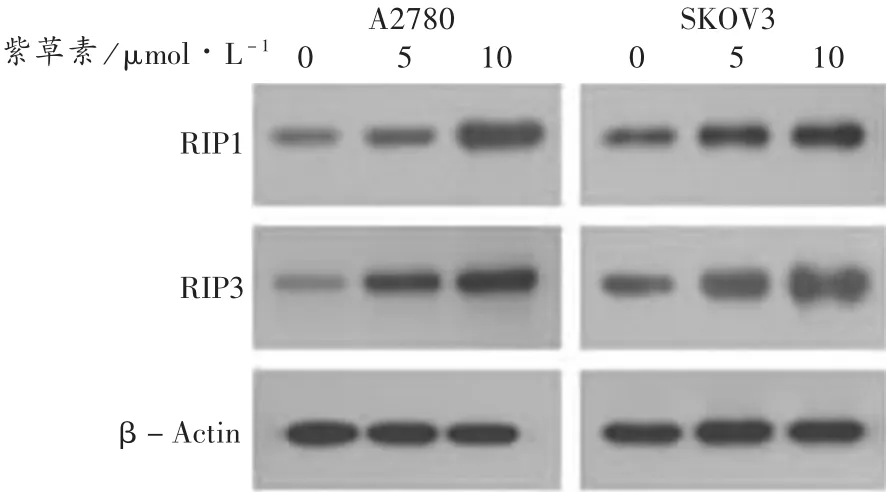
图6 紫草素诱导卵巢癌细胞RIP1和RIP3蛋白表达的定性分析
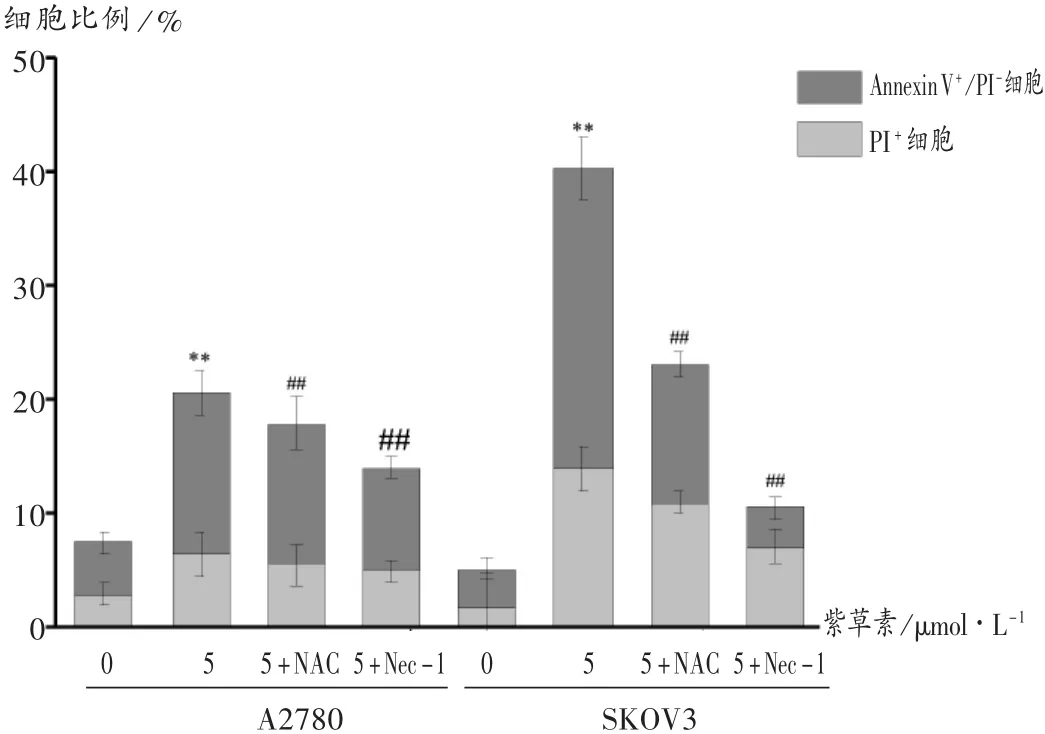
2.5 NAC和Nec-1的影响
结果见图8和图9。当预先使用NAC或Nec-1预处理后,再使用 5 μmol/L的紫草素诱导 SKOV3和A2780细胞时,抑制剂预处理组SKOV3和A2780细胞的坏死性凋亡率(PI+细胞和Annexin V+/PI+细胞)明显下降,相比紫草素组(5 μmol/L),差异有统计学意义(P<0.05,P<0.01)。
3 讨论
植物中通常含有多种抗肿瘤成分,且许多植物提取物已用于治疗癌症,如长春新碱、紫杉醇、拓扑替康,紫草素是一种从中草药植物中提取的活性化合物。其安全性和有效性已得到了肯定,尤其在妇科肿瘤如宫颈癌[10]和乳腺癌[11]中的抗肿瘤作用。李红英等[12]的研究发现,紫草素可促使卵巢癌HO-8910细胞树突状细胞的成熟,从而刺激机体产生特异性的抗肿瘤免疫。

图7 紫草素诱导卵巢癌细胞RIP1和RIP3蛋白表达的定量分析(X ± s,n=3)

图8 NAC,Nec-1对紫草素诱导卵巢癌细胞Annexin V-FITC/PI双染色流式分析结果
本研究中发现,紫草素以剂量和时间依赖的方式抑制人卵巢癌SKOV3和A2780细胞的增殖,对于人正常卵巢上皮IOSE80细胞的影响很小,说明紫草素用于治疗卵巢癌是安全的。作为细胞的终末事件,坏死性凋亡是一种由多种信号分子有序调控的程序化死亡过程[13]。本研究结果发现,紫草素可显著增加 PI+细胞和Annexin V+/PI+细胞的比例,而对于Annexin V+细胞的比例无明显影响。进一步使用Hoechst 33342和PI染色定性分析显示,紫草素处理的卵巢癌细胞并没有表现出明显的染色体凝聚、细胞核碎片化等细胞凋亡样特征。说明紫草素诱导SKOV3和A2780细胞以剂量和时间依赖性的形式发生坏死性凋亡。
活性氧引起严重的DNA损伤和基因突变,及肿瘤细胞的活性炎症,对于肿瘤细胞的增殖、侵袭、转移和血管生成具有促进作用;活性氧水平一旦达到阈值,肿瘤的生长将受到抑制,引起细胞结构分解和死亡[14]。后者也是大多数化疗和放射治疗杀死癌细胞的依赖机制。有研究显示,活性氧往往是肿瘤细胞坏死性凋亡的“执行者”[15],可引起细胞内源性分子包括蛋白质、脂质及核酸的损伤,从而促进坏死性凋亡进程[16]。本研究中使用DCFH-DA荧光探针检测紫草素诱导卵巢癌细胞活性氧的产生,结果显示,紫草素处理后可明显诱发SKOV3和A2780细胞活性氧的产生。说明紫草素导致卵巢癌细胞发生的坏死性凋亡进程和活性氧的过量累积有关。
注:与对照组相比,**P <0.01;与紫草素组相比,#P <0.05,##P < 0.01。
对坏死性凋亡的机制研究发现,RIP1通过和RIP3结合而激活RIP3,形成RIP1/RIP3复合物,从而触发了典型的坏死性凋亡过程[17]。因此,RIP1和RIP3是重要的坏死性凋亡相关蛋白。本研究中检测RIP1和RIP3蛋白的表达活性显示,紫草素处理后,卵巢癌细胞中RIP1和RIP3蛋白的表达显著上调。另外,当预先使用NAC,Nec-1抑制剂预处理后,再使用紫草素诱导SKOV3和A2780细胞时,抑制剂预处理组SKOV3和A2780细胞的坏死性凋亡率明显下降。进一步说明,紫草素抑制卵巢癌细胞的增殖和导致卵巢癌细胞发生坏死性凋亡相关,整个过程和活性氧的过量产生及激活RIP1和RIP3蛋白的表达密切相关。
综上所述,紫草素可明显抑制卵巢癌SKOV3和A2780细胞增殖,而对正常卵巢细胞毒性较低,其作用机制和诱导卵巢癌细胞产生大量的活性氧和上调RIP1和RIP3蛋白的表达,进而激活坏死性凋亡进程有关。
