低氧高碳酸环境对大鼠肺炎模型中左氧氟沙星分布的影响*
2019-01-10刘春漪周向东
李 琪 ,匡 扶 ,刘春漪 ,许 瑞 ,周向东 △
(1.海南医学院第一附属医院,海南 海口 570102; 2.重庆医科大学附属第二医院,重庆 400010)
大肠埃希菌是常见革兰阴性菌肺炎致病菌,近年来的感染率明显增加,在医院内获得性肺炎中的比例增加尤为明显,是肠内营养、机械通气、慢性阻塞性肺疾病(COPD)等患者发生肺部感染的主要致病菌[1-2]。左氧氟沙星(LVFX)作为呼吸喹诺酮类的代表性药物,以其在抗菌谱、安全性、经济性、有效性等多方面的综合良好表现,成为目前呼吸科广泛运用的喹诺酮类抗菌药物[3-4]。而机体微环境改变也可能影响药物抗菌效应的发挥,如pH对喹诺酮类药物介导的杀伤有明显影响[5]。在对奇异变形杆菌的杀菌效应研究中,pH为5和9时,环丙沙星的杀菌率下降,而pH为7时杀菌时间最短[6]。盐酸左氧氟沙星在酸性条件下的抗菌活性降低,随着血清浓度及细菌接种量的提高,盐酸左氧氟沙星的最低抑菌浓度(MIC)值增大 2 ~4 倍[7]。左氧氟沙星对幽门螺杆菌体外抗菌活性的研究结果显示,pH为4~5时的抗菌活性明显低于pH为7时[8]。在慢性气道炎症如COPD合并感染的情况下,气道微环境常常发生变化,尤其是发生低氧高碳酸血症时,机体、气道局部pH的改变是否会影响喹诺酮类如左氧氟沙星的抗菌效应,目前国内外尚未见报道。本研究中通过建立低氧高碳酸血症大鼠肺炎模型,考察了低氧高碳酸环境下左氧氟沙星在血液、支气管肺组织及支气管肺泡灌洗液(BALF)中的分布及浓度情况,为临床合理应用左氧氟沙星提供参考。
1 材料与方法
1.1 仪器、试药与动物
仪器:Agilentl 100型高效液相色谱仪系统(美国Agilent公司,包括泵系统,可调波长紫外检测器,Agilent 1100型工作站);SK-1型快速混匀器(江苏中大仪器厂);B160A型医用低速离心机(河北省安新县自洋离心机厂);GF.1型高速分散器(江苏其林医用仪器厂);BP61型电子天平(德国Sartorius公司)。
试药:盐酸左氧氟沙星氯化钠注射液(江苏扬子江药业集团有限公司,批号为15041131,规格为每瓶0.3 g∶100 mL);环丙沙星(中国食品药品检定研究院,批号为130451-201203);甲醇、二氯甲烷均为色谱纯,其他试剂均为分析纯。大肠埃希菌标准菌株(ATCC25922,由重庆医科大学附属第二医院细菌室提供)。
动物:健康合格SD大鼠112只,SPF级,体质量为180~200 g,雌雄各半,由重庆医科大学实验动物中心提供(实验动物使用许可证号为SCXK<渝>2012-0001)。所有动物实验遵照海南医学院生物医学伦理委员会动物实验伦理委员会规定(科伦审第<2014>126号)。
1.2 方法
1.2.1 色谱条件
色谱柱:AmethystC18-H 柱(150mm ×4.6mm,5μm,120A);预柱:Dikma EasyGuard ⅡSilica Kit柱(10 mm ×4 mm);流动相:甲醇 -0.008 mol/L 磷酸盐缓冲液 -0.5 mol/L 四丁基溴化铵(V/V/V,25 ∶75 ∶4);流速:0.4 mL /min;检测波长:290 nm;柱温:40 ℃ ;进样量:40 μL;内标:环丙沙星。
1.2.2 模型建立
大鼠低氧高碳酸血症模型:将大鼠置低氧高浓度CO2密封舱(10%O2,7% ~8%CO2,氮气平衡),每天 7 h,连续4周;对照组为正常空气环境下饲养。
单纯肺炎模型:参考DEVANEY等[9]方法并作改进,将大肠埃希菌标准菌液调制成0.5麦氏浓度的菌液,每只大鼠给予0.2 mL菌悬液缓慢注入气管,建立感染大肠埃希菌的大鼠肺炎模型。
低氧高碳酸血症肺炎模型:在低氧高碳酸血症建模成功的基础上予以大肠埃希菌感染,方法同上。
给药:感染24 h后,予左氧氟沙星干预,尾静脉注射左氧氟沙星氯化钠注射液50 mg/kg[10]。
1.2.3 标本采集
取大鼠 56 只,分别于给药后 0.5,1,2,4,8,12,24 h时取全血,并按时间点分为7个小组,每组8只。以2 500 g(g为重力加速度)转速离心5 min,取上层血浆;同时,将大鼠麻醉处死,取肺支气管组织,并用2 mL生理盐水反复冲洗支气管,收集BALF;肺组织和支气管组织称定质量后分别制成匀浆,将匀浆与BALF分别以2 500 g(g为重力加速度)转速离心 5 min,取上清液,置-20℃ 冰箱冷藏。
1.2.4 样品处理
取大鼠血浆 100 μL,加入 33.62 μg /mL 的内标环丙沙星20 μL,或取肺组织/支气管组织上清液500 μL,BALF 上清层 1 mL,各加入 33.62 μg/mL 的内标环丙沙星10 μL,涡旋10 s混匀,加入4 mL二氯甲烷,涡旋混匀1 min,以3 000 g(g为重力加速度)转速离心5 min,静置分层,小心吸取上清液,置40℃水浴中,氮气吹干。以 100 μL流动相复溶,40 μL进样分析。
1.3 统计学处理
采用Kinetica 4.4软件计算药代动力学参数,采用SPSS 13.0统计软件进行分析。计量资料以均数±标准差(X±s)表示,行配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 样品色谱行为
按拟订色谱条件测定,血浆、支气管肺组织、BALF中左氧氟沙星、内标环丙沙星的保留时间分别为5 min和8 min,二者峰形良好,未受血浆、组织内源性物质干扰,色谱图见图1。
2.2 方法学考察

图1 高效液相色谱图
标准曲线、线性关系考察与最低定量浓度确定:在空白血浆、支气管肺组织匀浆和BALF中加入左氧氟沙星标准品,分别配制成不同质量浓度:0.015,0.306,0.612,1.225,2.450,4.900,9.800,19.600mg/L;0.039,0.078,0.156,0.312,0.625,1.250,2.500,5.000 mg /L;0.015,0.030,0.060,0.090,0.120,0.240,0.360,0.480 mg /L。同 1.2.4 项下方法处理样品,每个样品测定5次。计算左氧氟沙星峰面积与内标环丙沙星峰面积之比(As/Ai),以As/Ai(Y)对左氧氟沙星质量浓度(X)进行线性回归,所得空白血浆、支气管肺组织匀浆和BALF中左氧氟沙星的标准曲线分别为:Y1=1.7038X1+0.043 3(r=0.999 8),Y2=2.503 6X2-0.048 4(r=0.999 9),Y3=8.515 7X3+0.124 4(r=0.999 6)。线性范围分别为 0.015 ~9.800 mg/L,0.039 ~5.000 mg/L,0.015~0.480 mg/L,RSD均小于 10% (n=5);最低定量浓度分别为 15,39,15 μg /L(n=5),符合生物样本的测定要求。
精密度、提取回收率与内标回收率试验:用空白样本加入左氧氟沙星配制3种不同质量浓度,同1.2.4项下方法处理样品,每个质量浓度的样本各5份,考察日内精密度(每个质量浓度1 d内测定5次)和日间精密度(每个浓度连续测5 d,每天测1次)。测得日内精密度、日间精密度的RSD均小于10%(n=5)。按测定量与加入量之比计算相对回收率,结果见表1。

表1 日内及日间精密度、提取回收率、内标回收率
稳定性试验:样品配制浓度同2.2项下“精密度与相对回收率”,冷冻稳定性考察参数:反复冷冻(-20℃)、融化(60℃左右)3次;温度因素考察参数:4℃ 、室温22℃左右、60℃;时间因素考察参数:室温分别放置2,4,8 h后处理。结果显示,在以上条件下各浓度样品测定值的RSD均小于10%(n=3),表明左氧氟沙星在各组织中的稳定性良好。详见表2。
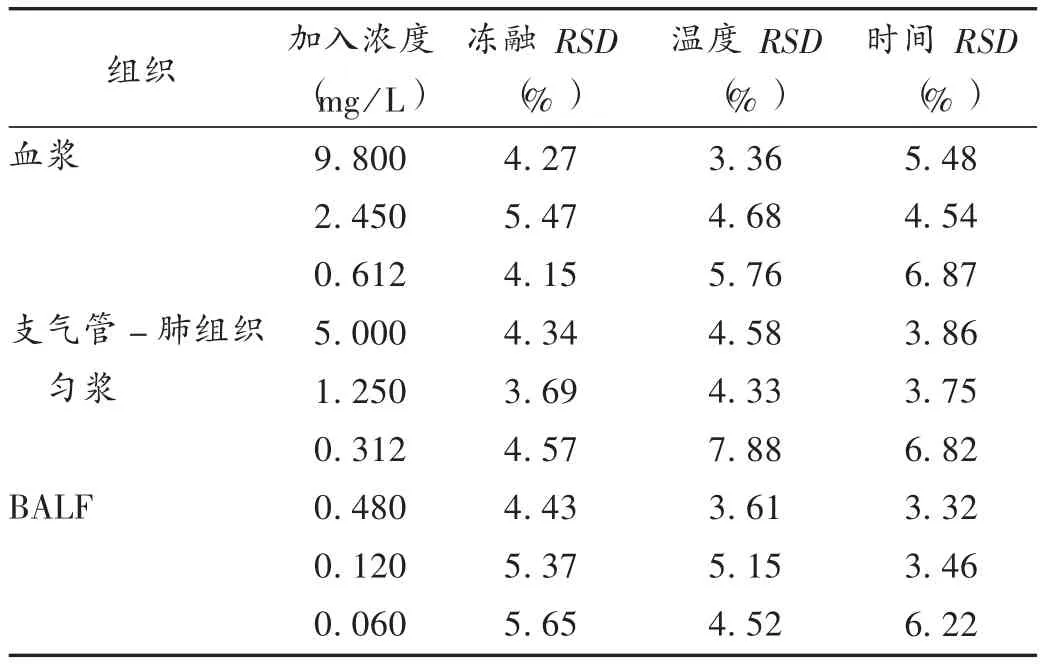
表2 稳定性试验结果(X ± s,n=3)
2.3 建模结果
结果见表3,可见低氧高碳酸血症模型造模成功。

表3 各组大鼠动脉血气指标比较(X ± s,n=8)
2.4 大鼠血液、支气管肺组织和BALF中药物浓度
各组大鼠按50 mg/kg静脉注射盐酸左氧氟沙星注射液后,测定各时间点的血药浓度。结果见表4。
2.5 药代动力学参数
将血浆、支气管肺组织和BALF中所测左氧氟沙星浓度、时间数据经Kinetica 4.4软件分析均符合二室模型。低氧高碳酸血症环境下的单纯肺炎组中,血浆、支气管肺组织及BALF中的AUC0-24与单纯肺炎组相比,均明显下降,差异有统计学意义(P<0.05);支气管肺组织、BALF中清除率也有所增加(P<0.05)。详见表5。

表4 各组大鼠静脉注射左氧氟沙星后各指标比较(X ± s,n=8)
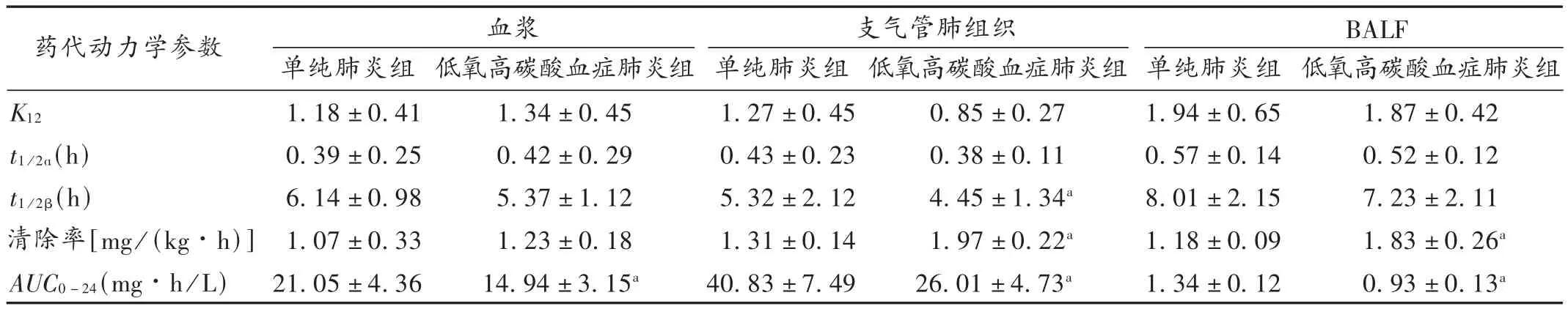
表5 各组大鼠静脉注射左氧氟沙星主要药代动力学参数(X ± s,n=8)
3 讨论
左氧氟沙星在肺组织中穿透力强,尤其是肺泡巨噬细胞、支气管黏膜及分泌物中浓度较高,安全性和耐受性良好[11],抗菌谱覆盖了呼吸道主要致病菌,对革兰阳性菌和阴性菌均有广谱抗菌活性,对支原体、衣原体、军团菌和分支杆菌属等也有较好活性,故治疗呼吸道感染优势明显,被称为“呼吸喹诺酮”。其对支原体、衣原体、军团菌和分支杆菌属等病原体比R(+)-氧氟沙星的活性更显著[12],但不同气道微环境对左氧氟沙星的抗菌效能有何影响至今鲜有报道。COPD患者常合并低氧及高碳酸血症,机体出现一系列复杂的病理生理改变,常出现药物疗效不佳的情况,可能与药物的吸收及分布变化有关。
大肠埃希菌是引起革兰阴性菌肺炎的仅次于肺炎克雷伯菌的第2位常见病原菌,由于人口老龄化、基础疾病的增加、医疗管道的使用等因素,致其发生率呈逐年上升趋势。COPD急性加重住院患者常合并肺部感染,而大肠埃希菌感染的比例也较高,故本研究中选取大肠埃希菌建立肺炎模型。本研究结果显示,在低氧高碳酸血症肺炎组中,左氧氟沙星在血液、支气管肺组织、BALF中的浓度较单纯肺炎组明显降低,尤其在支气管肺组织中变化尤为明显,AUC0-24降低,而药物在肺组织中的半衰期缩短,清除率增加,表明在低氧高碳酸血症环境下,机体对左氧氟沙星的吸收和生物利用度降低。肺组织局部血药浓度降低也可能与低氧环境下肺动脉收缩、肺血流减少致药物分布减少有关。有研究显示,在酸性环境中,左氧氟沙星离子反应增强,光降解率增加[13];在低氧状态下,体内羟自由基生成增多,这也会促进左氧氟沙星的降解[14],提示在低氧高碳酸环境中,左氧氟沙星的降解会有不同程度的增加,这也是致血药浓度降低的原因之一。
在治疗重症加强护理病房机械通气相关性肺炎的病例中,左氧氟沙星在12 h间隔给药情况下,其血液AUC0-24低于健康受试者30% ~40%,可能与药物的清除率增加,导致t1/2β清除半衰期缩短有关[15]。本研究结果发现,在低氧高碳酸组,左氧氟沙星在血液、支气管肺组织、BALF中的浓度及AUC0-24普遍下降,表明在低氧高碳酸血症环境下,机体对左氧氟沙星利用率的普遍下降可能与低氧高碳酸环境下机体发生的一系列复杂病理生理改变有关,这与临床情况相符,如慢性呼吸衰竭患者常出现肾功能不全,致肾血管痉挛、肾血流减少,一定程度地影响了血液中药物清除率。
综上所述,慢性呼吸衰竭合并肺部感染是临床治疗中的一大难题,患者常因治疗反应不理想而延长住院时间,进一步增加了感染尤其是耐药菌感染的概率。临床治疗中应积极纠正该类患者机体的低氧高碳酸血症状态,或寻求最利于药物分布和吸收的治疗方案,从而减少抗菌药物的使用种类及剂量,更合理地运用抗菌药物,减轻患者负担,降低细菌耐药率。
