Cdk13表达对神经元轴突伸长的影响
2019-01-09王荣跃鲁文洁邱海凡戴芬
王荣跃 鲁文洁 邱海凡 戴芬
[摘要] 目的 探讨智力障碍相关基因Cdk13对神经轴突伸长的影响。 方法 通过基因敲除模型、质粒细胞转染等方法,荧光共聚焦显微镜成像技术检测神经元轴突的形态,观察轴突伸长的变化。 结果 Cdk12和Cdk13在神经系统中有表达,在敲除Cdk12和Cdk13后轴突长度比对照组减少,两者比较有统计学差异(P<0.05),敲除Cdk12和Cdk13基因后Cdk5 mRNA水平降低。 结论 Cdk13和Cdk12的表达对神经元轴突的生长至关重要,其失活会引起神经元轴突形态异常,可能是导致智力障碍的病理机制。
[关键词] 智力障碍;Cdk13;Cdk12;神经元;轴突伸长
[中图分类号] R446.1 [文献标识码] A [文章编号] 1673-9701(2019)33-0043-03
[Abstract] Objective To investigate the effect of mental retardation related gene Cdk13 on the axon elongation of neurons. Methods The gene knockout model, plasmid cell transfection and other methods as well as the fluorescence confocal microscopic imaging technique were used to detect the morphology of neuron axons and observe the changes of axon elongation. Results Cdk12 and Cdk13 were expressed in the nervous system. After knocking out Cdk12 and Cdk13, the length of axon was decreased compared with the control group, with statistically significant difference(P<0.05). The Cdk5 mRNA level was decreased after knocking out Cdk12 and Cdk13 genes. Conclusion The expression of Cdk13 and Cdk12 is critical for the growth of neuronal axons and their inactivation leads to abnormal morphology of neuron axons, which may be the pathological mechanism leading to mental retardation.
[Key words] Mental retardation; Cdk13; Cdk12; Neuron; Axonal elongation
智力障碍(Mental retardation)是由多种因素引起的神经系统疾病,主要表现为智力低于同龄小孩水平,并伴有社会适应能力缺陷的一组疾病[1,2]。发病率高,全世界发病率为1%~3%[3]。随着研究的深入,遗传因素占的比重越来越高,包括染色体病、基因组病、单基因病或多基因突变等。目前已知Cdk13(cyclin-dependent kinase-13)与非综合征型发育迟缓相关的遗传基因[4,5]。Wang R等[6]在前期研究发现Cdk13基因缺失会导致智力低下,但是其发病机制仍不清楚。
蛋白激酶是一种能影响细胞周期、分化、代谢、细胞死亡和各种其他关键细胞过程的关键调节因子。Cdk12和Cdk13具有92%的同一性的蛋白激酶结构,并且已知与细胞周期蛋白L和细胞周期蛋白K相互作用[7]。在分子水平上,它们能够促进具有许多外显子的长基因的转录,并参与mRNA选择性剪接。在细胞水平,Cdk12和Cdk13能够在胚胎干细胞中维持自我更新[8]。本研究深入探讨了Cdk12和Cdk13异常对神经元轴突伸长的影响。
1 材料与方法
1.1 动物和试剂
C57BL/6小鼠以及載体构建购自广州赛业科技生物公司。靶向敲除Cdk12和Cdk13小鼠均由广州赛业科技生物公司合成。抗小鼠Cdk13的寡核苷酸合成序列以及克隆到载体中已获得pCdk13-s,pCdk-i2和pCdk13-i1,小鼠Cdk5激活剂,p53通过PCR扩增,所有构建体通过限制性内切酶测序。
1.2 细胞培养和转染
P19细胞购自于武汉博士德生物技术公司,脂质体Lipofectamine3000购自Invitrogen公司。P19细胞于10%胎牛血清DMEM培养基中,37℃,5%CO2饱和湿度条件下培养。转染后,施用8 μg/mL嘌呤霉素7 h以选择转染的细胞。转染后32 h,将培养基更换为含有1%血清的MEM。在转染后80 h收获细胞用于免疫细胞化学,RNA提取或蛋白质提取。转染后48 h收获细胞用于蛋白质提取。
1.3 免疫荧光和神经轴突计数
将细胞用4%多聚甲醛固定15 min,并用37℃ PBS清洗,0.1% Triton X-100通透20 min,用合适的一抗封闭样品,然后用荧光二抗山羊抗小鼠抗体避光孵育1 h,荧光显微镜下观察照相。封固前加入DAPI(1 μg/mL)避光孵育5 min。具有TuJ-1阳性信号的细胞被认为是分化的神经元。轴突长度采用Image J软件进行测量,采用最长的分支神经突长度来代表细胞的神经突向外生长。随机选取10个高倍视野,每个视野内选取5个最长的轴突进行测量,长度单位为μm[9]。
1.4 蛋白质印迹分析
将转染的细胞用磷酸盐缓冲盐水洗涤一次,并溶于放射免疫沉淀测定(RIPA)裂解缓冲液(20 mM HEPES,pH 7.8,150 mM NaCl,1mM EDTA,0.1%Triton X-100,50 mM NaF,1 mM二硫苏糖醇)中和蛋白酶抑制剂鸡尾酒)。通过两次以14 000 rpm离心10 min清除细胞裂解物,并将上清液用于Western印迹分析。将等量的细胞裂解物进行SDS-聚丙烯酰胺凝胶电泳,然后转移至硝酸纤维素膜上。用5%脱脂奶封闭后,加入一抗4℃孵育过夜。洗涤膜并在室温下与辣根过氧化物酶(HRP)偶联的二抗孵育1 h,用化学发光法将蛋白印迹曝光到胶片上。
1.5 RT-PCR测定
Tirzol法提取经质粒转染培养的至细胞培养第3天(DIV3)的神经元RNA,用病毒进行反转录,使用Invitrogen公司的核酸提取试剂盒,扩增用的引物和探针序列由Invitrogen公司合成。PCR扩增引物由武汉博士德生物技术公司合成。
1.6 统计学方法
应用SPSS 22.0软件处理数据,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析(one-way ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 Cdk12和Cdk13在神经发育系统中的表达
使用原位杂交和蛋白质印迹来检测Cdk12和Cdk13在mRNA和蛋白质水平上的表达模式。Cdk12 mRNA存在于E6.5胚胎滋养细胞中,在E7~E7.5期间,Cdk12在所有细胞中表达,但在原条(PS)中表达更强。在E8.5和E9.5胚胎中,在前脑、中脑中检测到更强的信号,Cdk13也普遍表达,但在所检查的各种发展阶段都没有在心脏中表达。见封三图4。
2.2 Cdk12或Cdk13对维持神经轴突伸长的作用
在体外培养3 d后,在Cdk12和Cdk13耗尽的皮质神经细胞中,轴突的平均长度减少[对照为(101.00±5.25)μm],Cdk12耗尽细胞中轴突长度为(42.00±3.30)μm,Cdk13耗尽细胞中轴突长度为(41.00±2.05)μm(P<0.05)。见封三圖5。
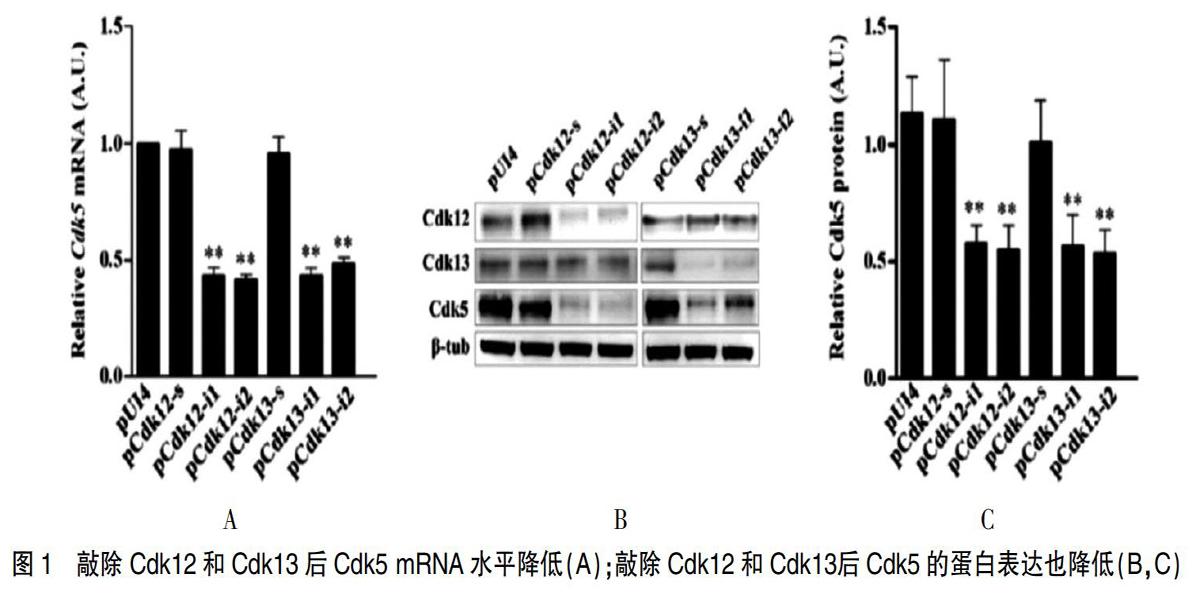
2.3 Cdk5的表达受Cdk12和Cdk13的调控
发现Cdk12或Cdk13的敲减将Cdk5 mRNA水平降低至对照水平的约40%(图1A),Cdk5蛋白表达也降低至对照组约50%(图1B,C)(P<0.05),这表明Cdk12和Cdk13对Cdk5的调节主要作用在RNA水平。
3 讨论
智力障碍严重危害社会生活,给家庭带来灾难,而缺氧引起的脑神经损伤是引起智力障碍的重要原因。然而临床上尚无特效的治疗方法,因此寻求新的治疗策略具有重要的科学意义。Cdk13是最晚发现的细胞周期依赖性激酶(Cyclin-dependent kinases,CDKs)家族成员,又名CDC2L5,普遍存在于人体组织中,目前研究比较少。其家族蛋白C端有一特殊结构,20个ATP依赖的丝氨酸-苏氨酸蛋白激酶结构,可通过整合细胞外和细胞内的信号,实现细胞内循环和基因转录过程的调控功能。Cdk12和Cdk13具有较多的重复同源序列,最近发现其可能在转录和RNA加工过程中发挥重要作用[10]。人类Cdk13蛋白分子量较大,为165 kDa,Cdk13、Cdk12与周期蛋白Cyclin K结合形成蛋白复合物发挥生物学功能[11]。Cdk13主要定位于细胞核,尤其集中在存储RNA剪接因子的核斑。Cdk13除了C端具有ATP依赖的蛋白激酶用于磷酸化RNA多聚酶Ⅱ,促使基因的转录和RNA的延伸外,还有三个功能域,用于参与CDK13与目标蛋白的相互作用:一个是位于N端的包含200~435个氨基酸残基的富丝氨酸-精氨酸(Serine-arginine Rich,SR)模体,此模体可促使Cdk13与SR蛋白家族成员相互作用,参与RNA加工和前提mRNA剪接的调控[12,13]。国外研究[14]同时报道Cdk13的错义变异会导致运动和语言发育迟缓、智力障碍。
本研究发现Cdk12和Cdk13有助于轴突生长,同时在Cdk12或Cdk13耗尽后,培养的P19细胞和原代皮质神经元失去了将轴突延伸到更远距离的能力,轴突受Cdk12和Cdk13影响的一种蛋白质是Cdk5,研究发现敲除Cdk12和Cdk13后Cdk5的mRNA含量降低,提示通过Cdk5调控轴突的伸长(图3)。其还参与了许多类似的生物学过程[15]。CDK12敲除后的小鼠表现小头畸形,通过DNA损伤影响神经细胞的改变,增加了自发凋亡[16]。非功能性CDK13敲除小鼠可表现神经系统损坏导致智力障碍[17]。Cdk12和Cdk13在维持小鼠胚胎干细胞的多能性方面发挥着不可或缺的作用[8]。Cdk12和Cdk13都参与RNA剪接调节[18]。Cdk12和Cdk13的表达发生在早期发育阶段,比如在E6.5小鼠胚胎。Cdk12和Cdk13之间表达模式和功能的相似性详见图1。此外,Cdk13通过RNAPII的羧基末端结构域的Ser2的磷酸化参与蛋白质调节[19]。CDK13能介入翻译和mRNA进程,从而在基因表达上发挥重要作用[20,21]。
最新研究[22]显示,轴突结构异常与遗传性智力低下的学习障碍相关,常见的是21三体导致的Down综合征,表现为智力低下,特殊面容,伴有心脏异常等。Cdk12和Cdk13的敲除不影响3DIV的SMI312阳性皮质神经元。这表明Cdk12和Cdk13都能够调节轴突特异性微管组织,促进神经元轴突伸长。然而,Cdk12和Cdk13产生这种差异效应的潜在机制仍不清楚。Cdk12和/(或)Cdk13的沉默也可能导致异常的微管重塑和轴突中微管动力学的变化。下游Cdk12和Cdk13底物蛋白是如何对轴突的长度变化具体机制仍需要进行更深入的研究。
[参考文献]
[1] 张丹妍,冯雪菲,戴礼猛,等.应用多重连接依赖探针扩增和微阵列比较基因组杂交技术检测不明原因智力障碍患儿[J].中国优生与遗传杂志,2017,25(2):11-12.
[2] 郭輝,刘富华,欧明林,等.智力障碍小家系中致病基因的研究[J]. 第三军医大学学报, 2016,38(8):889-892.
[3] Altiner S,Yurur KN.Importance of patient selection criteria in determining diagnostic copy number variations in patients with multiple congenital anomaly/mental retardation[J]. Mol Cytogenet,2019,12:23.
[4] Hamilton MJ,Suri M. CDK13-related disorder[J]. Adv Genet,2019,103:163-182.
[5] van den Akker W,Brummelman I,Martis L M,et al. De novo variants in CDK13 associated with syndromic ID/DD: Molecular and clinical delineation of 15 individuals and a further review[J]. Clin Genet,2018,93(5):1000-1007.
[6] Wang R,Lei T,Fu F,et al. Application of chromosome microarray analysis in patients with unexplained developmental delay/intellectual disability in South China[J]. Pediatr Neonatol,2019,60(1):35-42.
[7] Greenleaf AL.Human CDK12 and CDK13,multi-tasking CTD kinases for the new millenium[J].Transcription,2019, 10(2):91-110.
[8] Dai Q,Lei T,Zhao C,et al. Cyclin K-containing kinase complexes maintain self-renewal in murine embryonic stem cells[J]. J Biol Chem,2012,287(30):25344-25352.
[9] 陈甲,矫树生,梁春荣,等.脑源性神经营养因子前体对小鼠海马神经元存活和突起生长的抑制作用[J].解放军医学杂志,2014,39(9):690-694.
[10] Malumbres M,Harlow E,Hunt T,et al. Cyclin-dependent kinases:A family portrait[J]. Nat Cell Biol,2009,11(11):1275-1276.
[11] Greifenberg AK,Honig D,Pilarova K,et al. Structural and functional analysis of the Cdk13/Cyclin K complex[J].Cell Rep,2016,14(2):320-331.
[12] Lipp JJ,Marvin MC,Shokat KM,et al.SR protein kinases promote splicing of nonconsensus introns[J]. Nat Struct Mol Biol,2015,22(8):611-617.
[13] Wu HJ,Pu JL,Krafft PR,et al. The molecular mechanisms between autophagy and apoptosis:Potential role in central nervous system disorders[J]. Cell Mol Neurobiol,2015,35(1):85-99.
[14] Trinh J,Kandaswamy KK,Werber M,et al. Novel patho-genic variants and multiple molecular diagnoses in neurodevelopmental disorders[J].J Neurodev Disord,2019,11(1):11.
[15] Bosken CA,Farnung L,Hintermair C,et al.The structure and substrate specificity of human Cdk12/Cyclin K[J]. Nat Commun,2014,5:3505.
[16] Chen H,Juan H,Wong Y,et al. Cdk12 regulates neurogenesis and late-arising neuronal migration in the developing cerebral cortex[J]. Cerebral Cortex,2016,27(3):2289-2302.
[17] Kohoutek J,Novakova M,Vrabel D,et al. Mouse model of congenital heart defects, dysmorphic facial features and intellectual developmental disorders as a result of nonfunctional CDK13[J].Frontiers in Cell and Developmental Biology,2019,7:155.
[18] Lei T,Zhang P,Zhang X,et al. Cyclin K regulates prereplicative complex assembly to promote mammalian cell proliferation[J]. Nat Commun, 2018,9(1):1876.
[19] Ghamari A,van de Corput MP,Thongjuea S,et al.In vivo live imaging of RNA polymerase II transcription factories in primary cells[J].Genes Dev,2013,27(7):767-777.
[20] 王晶,王芳,张琼,等.大鼠发育过程中海马星形胶质细胞与神经元细胞周期蛋白依赖性激酶的表达差异[J].神经损伤与功能重建,2012,7(1):13-18.
[21] 蒋世一,吴学潮,郭中叶,等.长链非编码RNA SNHG12在脑胶质瘤中的表达及其功能研究[J].中华神经外科杂志,2018,34(12):1268-1273.
[22] Fan Y,Yin W,Hu B,et al.De novo mutations of CCNK cause a syndromic neurodevelopmental disorder with distinctive facial dysmorphism[J].Am J Hum Genet,2018, 103(3):448-455.
(收稿日期:2019-07-03)
