真菌菌体直接PCR扩增的方法研究
2019-01-09林艳云陈忆婷黄晓明林峻
林艳云,陈忆婷,黄晓明,林峻*
(1.福州大学 至诚学院,福建福州 350001;2.福州大学 生物科学与工程学院,福建福州 350108)
真菌的种类繁多,既有对人类生产生活有益的真菌,同时也有对人类健康有害的病原真菌[1]。真菌与其他微生物共同作用,对生态环境具有重要的作用,能够保持生态系统中有序的物质循环和能量流动[2]。真菌可以作为生态系统的分解者[3],具有生物防治病原体[4]、富集重金属[5-6]、降解农药[7-8]等多种作用。现今人们进一步加大对真菌资源的开发利用,例如利用黑曲霉代谢系统及产酶系统来生产柠檬酸[9]、木聚糖酶[10]、淀粉酶[11]等;米曲霉可作为发酵调味品的生产菌株[12],普遍用于蛋白酶和淀粉水解酶的生产,同时它被美国食品与药品管理局认定为安全微生物菌种[13];利用里氏木霉的代谢特点可将木质纤维转化为生物质原料[14],生产可再生能源,不仅能实现对废物的再利用,也能提供新型能源。对这些重要的生产用真菌的生产控制,科研人员不仅从代谢调控和发酵条件等方面进行优化,也从基因工程的角度对其进行改造,如构建食品级木聚糖酶黑曲霉工程菌[15]。在对真菌进行基因改造时,难以避免需要对真菌基因组进行提取,而传统的真菌基因组提取方法较为繁琐,因此本文以黑曲霉513.88(Aspergillus niger 513.88),米曲霉 2397(Aspergillus oryzae 2397),尼崎青霉(Penicillium amagasakiense),里氏木霉(Trichoderma reesei)作为研究对象,研究并探讨了一种能够简便快速提取真菌基因组,并且对其进行直接PCR扩增的方法,这能够为真菌基因组的快速提取与扩增提供另一种思路。
1 材料与方法
1.1 试验材料
黑曲霉513.88、米曲霉2397、尼崎青霉、里氏木霉,均由福州大学应用基因组学研究所提供。
1.2 主要仪器及试剂
1.2.1 主要仪器
台式高速离心机(Eppendorf 5430),梯度PCR仪(Biosafer 9700),电热恒温水浴锅(HWS12型),超微量核酸光度计(Nanodrop 2000),生化培养箱(BPC-70F),全自动凝胶成像分析仪(JS-680D)。
1.2.2 主要试剂
康为世纪2×Taq PCR mix,Takara 250 bp DNA Ladder Marker,λ-Hind Ⅲ digest DNA Marker,液氮,生工生物工程(上海)有限公司真菌基因组DNA快速提取试剂盒,A公司产细胞裂解液,B公司产细胞裂解液,实验室自制细胞裂解液。
1.3 试验方法
1.3.1 菌种培养
将菌种接种于PDA培养基中,30 ℃恒温培养,直至单菌落形成。
1.3.2 液氮研磨法提取基因组
收集琼脂平板上的真菌菌体,在研钵中用液氮快速研磨,形成粉末,然后使用真菌基因组DNA快速提取试剂盒提取真菌DNA,对提取得到的产物做琼脂糖凝胶电泳,进行进一步验证。
1.3.3 裂解液提取基因组
用无菌枪头挑取菌落,分别加入到50 μL A公司细胞裂解液、B公司细胞裂解液、实验室自制裂解液中,进行裂解,其裂解条件为:A公司细胞裂解液(80 ℃,5 min),B公司细胞裂解液(80 ℃,15 min),实验室自制裂解液(85 ℃,15 min)。
1.3.4 PCR引物
用于扩增在真菌中保守的18s rRNA基因的PCR引物设计如下:
18sF:5'-GAGCG GATAA CAATT TCACA CAGG-3'
18sR:5'-CGCCA GGGTT TTCCC AGTCA CGAC-3'
1.3.5 PCR
将裂解后的产物进行直接PCR,反应体系为:3 μL裂解产物,上游引物1μL,下游引物1 μL,引物浓度为 10 μmol/L,2×Taq PCR mix 25 μL,无菌水20 μL,PCR扩增循环程序为:预变性94 ℃,10 min;变性 94 ℃ 30 s,退火 53 ℃ 30 s,延伸 72 ℃90 s,35个循环;72 ℃终延伸10 min。PCR结束后,取PCR反应液做琼脂糖凝胶电泳,以便进一步验证。
1.3.6 PCR结果测序及产物序列比对
将PCR产物送交安徽通用生物系统有限公司进行Sanger测序,并使用Blast生物信息学分析工具,对测序得到的DNA序列进行分析。
2 结果与分析
2.1 液氮研磨法提取基因组DNA结果分析
经液氮研磨,真菌基因组DNA快速提取试剂盒提取得到的产物,其琼脂糖凝胶电泳结果如图1、图2所示。由图可知,该试剂盒能够成功提取到4种真菌的基因组DNA,但里氏木霉和米曲霉2397有拖带现象,提示所提取的基因组DNA有部分降解。

图1 黑曲霉513.88基因组DNA抽提结果
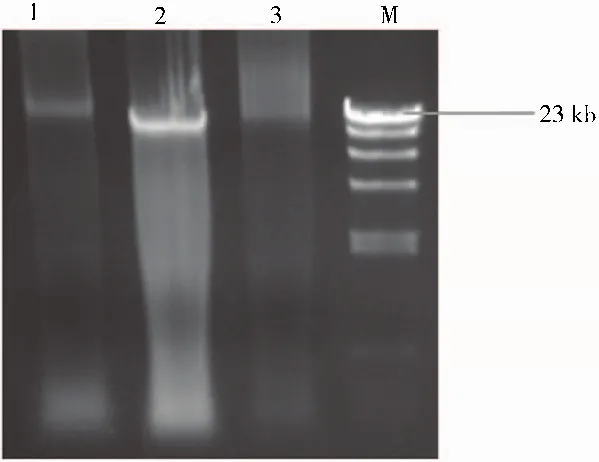
图2 里氏木霉、尼崎青霉、米曲霉2397基因组DNA抽提结果
2.2 液氮研磨产物PCR扩增结果分析
液氮研磨产物经试剂盒提取后进行PCR扩增,结果如图3所示。4种真菌均有目的条带,里氏木霉、尼崎青霉、黑曲霉513.88的扩增条带明亮,试剂盒抽提效果好,但是米曲霉2397 PCR扩增条带较暗,可见该试剂盒对米曲霉2397基因组提取效果不佳。
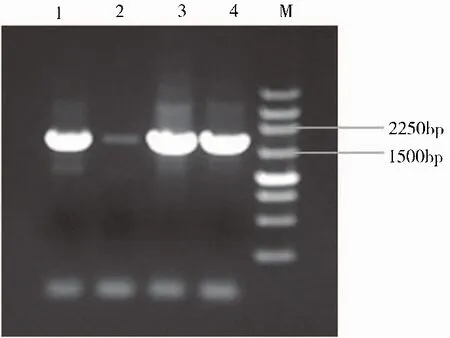
图3 液氮研磨产物PCR扩增结果
2.3 黑曲霉513.88裂解产物直接PCR扩增结果分析
对黑曲霉513.88进行裂解液处理并直接PCR后,产物电泳结果如图4所示。目的条带为1 634 bp,1、2、3泳道在1 500~2 250 bp有清晰条带,可见使用3种裂解液都能提取到黑曲霉513.88的基因组DNA并成功进行后续的PCR扩增。

图4 黑曲霉513.88基因组直接PCR扩增结果
2.4 黑曲霉513.88 PCR扩增产物测序分析
经过Sanger法测序,测序得到单峰峰图,对该测序结果在NCBI网站进行Blast比对,与Aspergillus niger的基因组序列相似度为99%,PCR扩增产物可以确定为黑曲霉的基因组DNA。
2.5 米曲霉2397裂解产物直接PCR扩增结果分析
PCR电泳产物检测结果如图5所示。电泳结果没有目的条带,可见此法并不适用于米曲霉的基因组提取与扩增。

图5 米曲霉2397基因组直接PCR扩增结果
2.6 尼崎青霉裂解产物直接PCR扩增结果分析
尼崎青霉PCR产物电泳检测结果如图6所示。电泳结果没有条带,可见此法并不适用于尼崎青霉的基因组提取与扩增。

图6 尼崎青霉基因组直接PCR扩增结果
2.7 里氏木霉裂解产物直接PCR扩增结果分析
分别采用3种裂解液裂解里氏木霉,其基因组PCR扩增结果如图7所示。第1、2、3泳道在1 500~2 250 bp有条带。但使用实验室自制裂解液提取的基因组扩增产物条带明亮,A公司细胞裂解液裂解效果次之,B公司细胞裂解液基因组扩增产物电泳条带最暗。

图7 里氏木霉基因组直接PCR扩增结果
2.8 里氏木霉PCR扩增产物测序分析
里氏木霉PCR产物经过Sanger法测序,测序得到单峰峰图,在NCBI网站上进行测序结果比对,该菌的基因组序列与Trichoderma reesei的基因组序列相似度为99%,PCR扩增产物可以确定为黑曲霉基因组DNA。
3 结论
PCR扩增能否成功,其重点在于提取的真菌基因组DNA质量的高低。真菌的细胞壁富含多糖等特殊成分,抗逆性强,而要提取到高质量的真菌基因组DNA,关键问题就在于破壁的成功。实验室常用的破壁方法包括液氮研磨法、尿素裂解法、冻融法、打击震荡法、氯化苄法和酶消化法等。对于某些真菌,因其细胞壁较为“柔软”,采用酶消化法就可以实现对真菌的破壁处理,并提取到基因组DNA。但是对于绝大多数的真菌,由于其细胞壁的结构与成分的特殊性,具有较强的耐受性,为了达到良好的破壁效果,就需要应用其他物理方法如超声波、高压等共同作用。本方法采用市售常见细胞裂解液对真菌细胞进行直接裂解,结果显示黑曲霉513.88和里氏木霉这两种重要的真菌可以在细胞裂解液处理后实现直接PCR扩增,但是对米曲霉2397和尼崎青霉没有效果。多糖是构成真菌细胞壁的主要成分,对于不同类群的真菌,细胞壁中多糖的类型也会有所不同[16],可能是由于米曲霉2397和尼崎青霉细胞壁多糖对裂解液成分不敏感,造成破壁困难。同时对于真菌细胞壁来讲,细胞壁各成分所占比例与细胞生活周期有关,而细胞壁成分比例的高低又会影响到破壁的难易,当细胞尚处于幼嫩阶段,较容易破壁,反之较难破壁[17],从而导致后续PCR扩增失败。本研究结果表明,市售的常见细胞裂解液,可以对部分真菌物种实现直接裂解和PCR扩增,若善加利用,可以减少真菌破壁的繁琐操作,从而简化对真菌进行基因工程改造的步骤,进一步提高改造的效率。
